广西苦丁茶不同活性部位抑菌活性研究
蔡 鹃, 黄敏桃, 黄云峰, 赖茂祥, 黄庶识*, 刘华钢
(1.广西科学院 生物物理实验室, 广西 南宁 530007; 2.江西赣州卫生学校 药剂药化教研室, 江西 赣州341100; 3.广西中医研究院, 广西 南宁 530022; 4.广西医科大学, 广西 南宁 530021)
广西苦丁茶不同活性部位抑菌活性研究
蔡 鹃1,2, 黄敏桃1, 黄云峰3, 赖茂祥3, 黄庶识1*, 刘华钢4*
(1.广西科学院 生物物理实验室, 广西 南宁 530007; 2.江西赣州卫生学校 药剂药化教研室, 江西 赣州341100; 3.广西中医研究院, 广西 南宁 530022; 4.广西医科大学, 广西 南宁 530021)
目的 考察苦丁茶不同极性部位对革兰氏阴性菌、阳性菌的抑制作用,确定苦丁茶抑菌活性的药效部位,为研究苦丁茶抑菌活性成分提供依据。 方法 采用系统溶剂提取法得到7个不同极性部位, 通过 96孔板测定不同极性部位的最低抑菌浓度 (MIC), 牛津杯法测定其抑菌圈直径, 并通过 HPLC法分别测定其中熊果酸、 齐墩果酸、 槲皮素、山柰素量,苯酚硫酸法测定多糖量,分析5种物质量与抑菌能力之间的关系。结果 不同极性部位抑菌结果显示石油醚无抑菌活性,三氯甲烷、乙酸乙酯、正丁醇提取物抑菌活性中等,乙醇、甲醇抑菌活性强,水提取物的抑菌活性最强。结论 槲皮素、熊果酸和多糖类为苦丁茶抑菌活性成分。
苦丁茶;极性部位;槲皮素;山柰素;熊果酸;齐墩果酸;多糖;抑菌
广西苦丁茶为冬青科苦丁茶冬青 Ilex kudingcha C.J. Tseng, 又名茶丁、 苦登茶, 主产于广 西、 广 东、 海南等地。叶含黄酮、多种皂苷及多糖类化合物,具有清热解毒、健胃消积、止咳化痰、生津止渴、提神醒脑、明目益智等功效[1]。 苦丁茶 在 抗 菌 抑 菌 方 面 具 有 显 著 药 理 活 性[2-4],但是对于其抑菌的药效物质基础研究成果鲜见报道。本研究采用系统溶剂提取法,用极性不同的7种溶剂提取苦丁茶中的化学成分,根据不同极性部位的抑菌效果初步推测其药效物质基础,并测定苦丁茶中含有的熊果酸、齐墩果酸、槲皮素、山柰素、多糖,探究这5种物质与抑菌能力的相关性。
1 仪器与材料
1.1 实 验 仪 器 瑞 士 梅 特 勒-托 利 多 超 越 型 分 析 天 平( Mettler Toledo XS105DU) 。 紫外分光光 度计 ( 北京瑞利分析仪器公司), 超净工作台 (苏州净化设备厂), 平板振荡器 (北京海淀电子医疗仪器厂), 戴安 U3000 高效液相仪(包括四元泵、自动进样器、 紫外可见检测器、 柱温箱、 变色龙工作站) , LichrospherTMC18(5 μm, 4.6mm×250mm)柱、 Zorbax ODS (5 μm, 4.6mm×250mm) 柱, 冰箱 (海尔药品保存箱), 旋转蒸发器 (上海亚荣生化仪器厂), 循环水式真空泵 (郑州长城科工贸有限公司), 数显电热培养箱 (上海博迅实业有限公司), 离心机 (SIGMA 1-15P),恒温摇床 (上海天呈), 96 孔板 (美国 Bio-Rad 公司), 牛津杯 (天津思利达), 0.22 μm微孔滤膜 (天津津腾公司)。
1.2 实验材料
1.2.1 药材 苦丁茶样品于 2011 年 7 月采自广西南宁市地委大院,经广西中医药研究院赖茂祥研究员鉴定为冬青科冬青属苦丁茶冬青 Ilex kudingcha C.J.Tseng, 采回后阴干,取其干燥叶片粉碎、烘干,置于干燥器保存待用。
熊果酸 ( 批号: 709-8501), 齐墩果酸 ( 批号: 0709-9803), 槲皮素 (批号: 100081-200406), 山柰素 (批号:110861-200405), 均购于中国药品生物制品检定所。
1.2.2 细菌 大肠杆菌 Escherichia coli( ATCC44102 ) 、 金黄 色 葡 萄 球 菌 Staphyloccocus aureus Rosenbach( ATCC26003 )、 绿 脓 杆 菌 Pseudomonas aeruginosa(ATCC27583) 均购 自美国模式 培养物 集存库 ( American Type Culture Collection) 。
1.2.3 试剂 石油醚、 正丁醇、 乙酸乙酯、 三氯甲烷, 无水乙醇、 甲醇 (均为天津富宇精细化工, 分析纯), 硫酸(廉江市爱廉化试剂有限公司, 分析纯), MH琼脂培养基、MH肉汤、 营养肉汤 (均为广东环凯公司), 氯化三苯四氮唑 TCC染色剂 ( Amresco公司) , 甲醇 ( fisher公司, 色谱纯), 磷酸 (天津科密欧化学试剂, 色谱纯)。
2 方法
2.1 苦丁茶不同极性提取物的提取方法 分别称取 7 份5.0 g的苦丁茶叶片粉末, 分别加入不同极性提取溶剂 (石油醚、三氯甲烷、乙酸乙酯、正丁醇、无水乙醇、甲醇、水) 200 mL, 超声提取3 次, 每次2 h, 过滤合并, 浓缩挥干, 各 不 同 极 性 部 位 得 膏 率 ( g/g) 分 别 为 5.72%、7.62%、 27.29%、 26.02%、 23.82%、 24.86%、 29.86%。有机溶剂提取物用甲醇定容至 10 mL量瓶, 水提物用水定容至 10 mL量瓶中。 得到不同极性苦丁茶提取物, 用 0.22 μm的微孔滤膜过滤除菌后, 用96 孔板法和牛津杯法分别评价其抑菌浓度效果。 用 HPLC法直接测定其中熊果酸、齐墩果酸量, 苯酚硫酸法测定多糖量。 移取2 mL提取物,加入 500 μL 25%HCl, 超声 4 h, 甲醇定容至 10 m L量瓶中, 得苦丁茶水解液后, HPLC法测定其中槲皮素、 山柰素量。
2.2 菌种的培养 将解冻、 活化后的菌液接种到营养琼脂平板, 37 ℃培养, 挑取单个菌落接种于 4 mL液体培养基内, 37 ℃恒温震摇培养 12 h。 取菌液于 4 ℃ 10 000 r/min离心 10 min, 弃上清, 沉淀用生理盐水洗 2 次, 生理盐水校正浓度至吸光度为 0.1, 待用。
2.3 微量稀释法测定样品对细菌的生长抑制作用 将苦丁茶不同极性提取物倍比稀释,将提取液用灭菌MH培养基稀释 5 倍, 加入 96 孔板中, 每孔 100 μL, 每药重复 3 孔。将细菌培养至对数生长期, 并校正到吸光度为 0.1 的菌液,将其稀释 100 倍, 每孔定量接种 100 μL。 则 1 ~10 列最终作用质量浓度分别为 50、 50、 50、 25、 12.5、 6.25、 3.13、1.57、 0.78、 0.39 mg/mL(生药浓度), 保证每孔甲醇体积分数为 10%, 第 11 列为不加药的 10%甲醇阴性对照组,第12列为不加药的灭菌水阴性对照组, 每药一行重复。 孔板加盖置微型震荡器振荡培养,使各孔内溶液混匀,封口胶密封, 35 ℃湿盒孵育 18 ~20 h。 孵育结束前 3 h 每孔加入 2.5 mg/mL氯化三苯四氮唑 (TTC) 溶液 10 μL, 继续孵育1~3 h后有细菌生长孔呈红色, 抑制细菌肉眼未见生长的最低药物质量浓度为该药对细菌的最低抑菌浓度。实验重复 3 次, 实验结果以最低抑菌浓度 (MIC) 值表示。
2.4 牛津杯法测定样品对细菌的生长抑制作用 菌株生长至对数生长期, 用无菌生理盐水调至吸光度为0.1, 按1 ∶100 倍稀释。 将稀释后的菌液吸取 50 μL(绿脓杆菌 30 μL) 涂布均匀于 MH琼脂平板表面, 稍干后将牛津杯等距离放置于琼脂表面, 向牛津杯中定量加入 200 μL按照“2.1” 项方法下提取的甲醇和水定容的 5.0 g/mL(生药浓度) 苦丁茶提取液, 4 ℃冰箱放置 10 h使其扩散, 再置于35 ℃恒温箱培养 18 ~20 h, 观察并用游标卡尺测量抑菌圈直径,每个药物抑菌实验重复3次,抑菌结果为3次实验平均值。 阴性对照组为 0.22 μm除菌过滤的纯甲醇溶液和灭菌水溶液。 抑菌圈直径结果用 ±SD表示。
2.5 HPLC测定苦丁茶不同极性部位熊果酸、 齐墩果酸、槲皮素、 山柰素 取苦丁茶不同极性部位提取液, 采用 LichrospherTMC18(5 μm, 4.6 mm×250 mm) 柱, 以甲醇-水-磷酸 (85 ∶15 ∶0.1) 为流动相, 检测波长为220 nm, 体积流量为 0.8 mL/min, 柱温 30 ℃, 测定其中熊果酸、 齐墩果酸的量[5]。
取苦丁茶不同极性盐酸水解液测定其槲皮素、山柰素量。 采用 Zorbax ODS (5 μm, 4.6 mm×250 mm) 柱, 以甲醇-0.4%磷酸水 (50 ∶50) 为流动相, 检测波长为 360 nm,体积流量 0.7mL/min, 柱温 40 ℃, 测定[6]。
2.6 苯酚硫酸法测定苦丁茶不同极性部位多糖量 葡萄糖标准曲线的制备: 精密称取无水葡萄糖纯品 20.03 mg、20.08mg, 一份用水定容于 100mL量瓶中, 一份用甲醇定容于 100 mL量瓶中, 分别吸取葡萄糖溶液0.4、 0.6、 0.8、1.0、 1.2、 1.4、 1.6、 1.8 mL, 并分别以水 (甲醇) 补至2.0mL, 加入 6%苯酚 1.0 mL及浓硫酸 5.0 mL, 静置 10 m in, 摇匀, 室温放置 20m in 后, 480 nm测吸光度, 以 2.0 mL水 (甲醇) 按同样显色操作为空白, 测定葡萄糖水溶液标准曲线和葡萄糖甲醇溶液标准曲线。
换算因素的测定 称取苦丁茶 10 g, 置圆底烧瓶中,用 300 mL水超声提取 4 次, 每次 3 h, 过滤合并滤液, 浓缩至 50 mL。 95%乙醇沉淀多糖, 乙醚、 丙酮、 无水乙醇溶剂系统反复冲洗,真空低温干燥。得苦丁茶粗多糖。
精密称取干燥至恒重的苦丁茶粗多糖 5.12 mg、 5.32 mg、 5.58 mg 3 份, 用去离子水定容于 100 mL量瓶, 得浓度为 c1、 c2、 c3的苦丁茶多糖。 取 2mL按照苯酚硫酸法测定其吸光度 A1、 A2、 A3, 根据标准曲线将 A1、 A2、 A3换算成 C1、 C2、 C3, 则
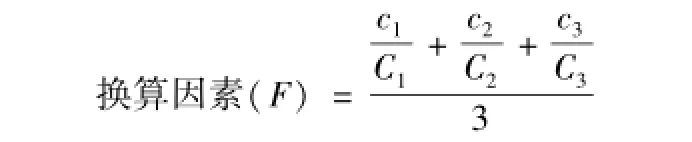
苦丁茶样品多糖量 对照标准曲线将苦丁茶多糖吸光度换算成苦丁茶多糖中葡萄糖浓度,则:
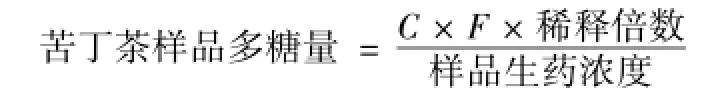
苦丁茶样品中多糖测定 吸取不同极性部位提取液0.01 mL, 甲醇定容的提取液用甲醇稀释至 2 mL, 水定容的提取液用水稀释至2 mL, 按苯酚硫酸法操作测定其吸光度,并分别代入甲醇、水制作的标准曲线换算成葡萄糖浓度。
2.7 槲皮素、 山柰素、 熊果酸、 齐墩果酸以及多糖与 3 种菌间的相关性分析 数据的相关性分析通 过 SPSS Statistics 17 软件, 采用双变量相关分析 Spearman 分析法, 对苦丁茶提取物中5种物质含有量与其对3种菌的抑菌圈直径做相关性分析。
3 结果与分析
3.1 微量稀释法测定不同极性提取物对革兰氏阳性菌、 阴性菌的生长抑菌效果 96孔板中, 经苦丁茶不同极性提取物作用18 h后, 大肠杆菌、 金黄色葡萄球菌、 绿脓杆菌 3种菌生长均受到抑制,两组阴性对照组菌均生长良好。如表1所示,水提物对3种菌的抑菌效果最优,最低抑菌质量浓度 (生药浓度) 分别为 6.25、 3.13、 6.25 mg/mL, 甲醇和乙醇次之。结果显示苦丁茶提取物对革兰氏阳性菌金黄色葡萄球菌的抑制作用均强于革兰氏阴性菌的大肠杆菌和绿脓杆菌。

表 1 样 品 对 3 种 菌 的 最 低 抑 菌 质 量 浓 度 (mg·m L-1)(生药浓度)
3.2 牛津杯法测定不同极性提取物对革兰氏阴性菌、 阳性菌的抑菌效果 用牛津杯法测定的苦丁茶不同极性提取物对大肠杆菌、金黄色葡萄球菌、绿脓杆菌的抑菌结果显示(表2), 水提物对3 种菌的抑菌效果最强, 抑菌圈直径分别为19.56mm、 32.78mm、 22.20mm, 甲醇、 乙醇提取物次之,甲醇和乙醇提取物抑菌效果差异不显著。苦丁茶提取物对革兰氏阳性菌金黄色葡萄球菌的抑制作用强于革兰氏阴性菌 大肠杆菌 和 绿 脓杆菌, 与 96 孔 板 法 测 定 结 果一致。

表 2 样品作用于 3 种菌的抑菌圈直径/mm
3.3 不同极性部位槲皮素、 山柰素、 熊果酸、 齐墩果酸以及多糖量 HPLC测定结果显示 (表 3), 随着溶剂极性的增加,槲皮素、熊果酸、齐墩果酸量均呈增加趋势,山柰素则在低极性溶剂提取物中含有量较高。

表3 样品中5种成分测定结果
3.4 槲皮素、 山柰素、 熊果酸、 齐墩果酸以及多糖与 3 种菌间的相关性分析 由表4可知,苦丁茶提取液中多糖量、熊果酸量与抑菌能力呈极显著的正相关性,特别是多糖量与其对金黄色葡萄球菌的抑菌能力之间 r=1 (P<0.01),线性相关。槲皮素量与3种菌的抑菌能力之间相关系数在0.85 左右 (P<0.01), 显著性相关。 齐墩果酸与其对 3 种菌的抑菌圈直径在 0.2 左右, 低度线性相关, 山柰素量与 3种菌的抑菌圈直径趋近于0, 无相关性。
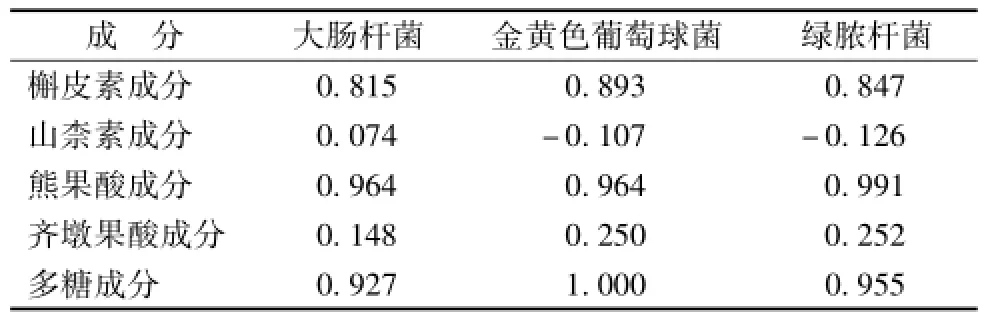
表4 样品中 5种成分与3种菌的相关性分析
4 讨论
实验结果显示,苦丁茶提取物抑菌活性与其多糖的量、熊果酸量完全相关,与槲皮素量高度相关,与齐墩果酸的量低相关,与山柰素量不相关,说明多糖、槲皮素、熊果酸是苦丁茶中重要的抑菌活性成分。目前已知多种中药的水溶性多糖具有多样的生物学功能,有显著的抗菌活性[7-8], 苦丁茶水溶性多糖也具有抗菌活性[3], 但对于苦丁茶多糖的抑菌原理有待研究。熊果酸抗伤寒杆菌、金葡菌的作用比氯霉素强[9]。 抑菌原理可能为作用于细菌细胞外膜,抑制细菌生物被膜形成,引起形态改变导致细菌自溶而产生抗革兰阳性菌 作用[10-11]; 或 可通过抑制 肽聚糖的更新, 改变细菌的细胞形态, 并促进其自溶[12]。 槲皮素是一种广谱抗菌物质,可用于防治各种细菌感染性疾病,其抗菌消炎的机制可能与炎症因子的 调节有关[13-15]。 也有研究表明槲皮素的抑菌作用与 DNA的改变有关[16]。
苦丁茶水提物中的多糖量远高于其他极性部位,而水提物抗菌性最强,提示苦丁茶水溶性多糖可能在抗菌活性上也起到一定作用。由于极性提取物中同时含有槲皮素、熊果酸和多糖成分,具体哪种成分在抗菌活性方面起主要作用或者多种成分在抗菌活性中是否有起协调作用,还有待做深入研究。苦丁茶是一种保健茶,民间习用方法是以泡茶方式饮用为主,其保健作用可能与水提液中活性物质含有量高有关。
本实验通过系统溶剂法提取苦丁茶的化学成分作用于大肠杆菌、金黄色葡萄球菌和绿脓杆菌,结果表明不同极性部位提取物的抑菌效果随着提取溶剂的极性增加而增强,水溶性提取物对3种细菌的抑制作用效果最强。
苦丁茶的抑菌活性可能与提取物中熊果酸、槲皮素、多糖的量相关,而与齐墩果酸、山柰素量无关。苦丁茶提取物对革兰氏阳性菌的抑制效果优于革兰氏阴性菌。
[ 1 ] 江苏新医学院.中药大辞典: 上册[M].上海: 上海科学技术出版社, 1985: 1288.
[2] 张 煜,王彦峰.广西常用中草药、 壮药抗幽门螺杆菌作用的筛选研究[ J].中国民族民间医药, 2008, 17 (10):19-20.
[3] 林雄平,陈晓清,苏育才.金银花和苦丁茶多糖提取物抗菌活性研究[J].亚热带植物科学, 2008, 37(1): 51-53.
[4] 杨 睿, 王 倩, 王海涛.苦丁茶等10味中草药抑菌作用研究[J].安徽农学通报, 2009, 19(6): 34-36.
[5] 路 玫,蒙大平,荣延平.广西苦丁茶嫩叶和老叶中熊果酸含量的比较[J].中国实验方剂学杂志, 2008, 14(10):14-15.
[6] 黄雪梅,蒙大平, 荣延平.广西苦丁茶嫩叶和老叶中槲皮素和山柰素的含量测定[ J].中国现代应用药学杂志,2005, 22(5): 383-385.
[7] 杨晓杰,郑云姬, 李 娜, 等.亚洲蒲公英多糖的抑菌性和抗氧化 性研究[J].时珍国医国 药, 2012, 23 (1):109-110.
[ 8 ] 陈晓清.鱼腥草与茵陈多糖提取物的抗菌活性[J].微量元素与健康研究, 2007, 24(5): 17-18.
[ 9 ] Horiuchi K, Shiota S, Hatano T, etal.Antimicrobial activity of oleanolic acid from Salvia officinalis and related compounds on vancomycin-resistant enterocci( VRE) [ J] .Biol Pharm Bull,2007, 30(6): 1147-1149.
[10] Szakiel A, Rusazkowski D, Grudniak A, et al.Antibacterial and antiparasidic activity of oleanolic acid and its glycosides isolated from marigold ( Calendula officinalis) [ J] .Planta Med,2008, 74(14): 1709-1715.
[11] Ren D, Zuo R, Gonzalez Barrios A F, et al.Differential gene expression for investigation of Escherichia coli biofilm inhibition by plant extract ursolic acid [ J] .Apple Environ Microbiol,2005, 71(7): 4022-4034.
[12] Kurek A, Grudniak A M.Szw monocytogenes[ J] .Antanie Van Leeu wenhoek, 2010, 97(1) : 61-68.
[13] 李 昕, 刘佳佳, 何 浩, 等.槲皮素对 LPS 诱导的中性粒细胞产生白介素 6 的影响[J].免疫学杂志, 2006, 22(1): 40-46.
[14] 蒋 飞, 杜春玲, 雷怀定, 等.槲皮素 对 IL-lβ刺激 肺上皮细胞表达 ICAM-1 的影响 [ J] . 郧阳 医学 院学报, 2008,27(6): 492-494.
[15] 岳 扬, 刘佳佳, 宋传旺, 等.槲皮素对 LPS 诱导中性粒细胞活性化效应的抑制作用[ J].免疫学杂志, 2005, 21(4): 296-299.
[16] 黄国霞, 李军生, 阎柳娟.几种中药提取物的抑菌作用及机理研究[J].时珍国医国药, 2011, 22(2): 425-426.
R285.5
: B
: 1001-1528(2014)01-0198-04
10.3969/j.issn.1001-1528.2014.01.052
2013-03-15
国家科技支撑计划项目 (2011BAI01B04) ; 广西科学研究与技术开发计划 (0992003A-20)
蔡 鹃 (1988—) , 女, 硕士生, 从事中药质量控制研究。 TEL: (0771) 2503990, E-mail: cjlzl123@126.com
*通信作者: 黄庶识, 研究员, 博士, 从事中药质量控制研究。 TEL: (0771) 2503990 , E-mail: hshushi@gxas.cn刘华钢, 教授, 博士, 从事中药质量控制研究。 Tel: (0771) 5350964, E-mail: lhg@gxfda.gov.cn

