香附油滴丸中 α-香附酮在血液及细胞中的移行情况探讨
田友清, 丁 平
(1.江苏联合职业技术学院连云港中医药分院, 江苏 连云港 222007;2.中国药科大学新药筛选中心,江苏 南京 210009)
香附油滴丸中 α-香附酮在血液及细胞中的移行情况探讨
田友清1,2, 丁 平1
(1.江苏联合职业技术学院连云港中医药分院, 江苏 连云港 222007;2.中国药科大学新药筛选中心,江苏 南京 210009)
目的 探讨香附油滴丸中 α-香附酮在血液及细胞中的移行情况, 为确定香附油滴丸的定量测定指标提供依据。方法 以高效液相色谱法 (HPLC) 为手段, 分别检测香附油滴丸、 香附油滴丸灌胃给药后大鼠血清及香附油滴丸给予 H9c2 细胞后细胞破碎液中 α-香附酮的移行情况。 结果 α-香附酮作为香附的主要成分, 在香附油滴丸、 含药血清及细胞破碎液中均被检测到。 结论 α-香附酮以原型移行到血液和细胞中发挥相应的药理作用, 以 α-香附酮为香附油滴丸的定量测定指标具有合理性。
香附; 香附油滴丸; α-香附酮; 质量控制
香附油滴丸是以从香附中提取的挥发油为原料制成的现代中药制剂,为了制定质量标准,需要科学确定其主要成分定量测定指标。鉴于药物的活性成分往往通过进入血液循环并与相应的靶细胞结合而发挥作用, 本研究通过考察香附油滴丸中 α-香附酮在血液及细胞中的移行情况, 探讨 α-香附酮作为香附油滴丸定量测定指标的合理性,并为中成药成分测定指标的确定提供新思路。
1 仪器与材料
1.1 动物 SPF级 SD大鼠, 体质量 200 ~250 g,雄性, 动物许可证号 SCXK (苏)2007-0008,由南京青龙山实验动物中心提供。大鼠于 SPF级动物房饲养, 定时给予全价营养饲料喂食, 室温22~25 ℃, 相对湿度 50% ~70%。
1.2 药物与试剂 香附油滴丸 (自制,批号110310)。α-香附酮对照品 (110748-200608, 中国药品生物制品检定所); 甲醇 (色谱纯, 德国 Merk公司); DMEM、 胰酶、 FBS (由 GIBCO公司)。
1.3 主要仪器 LC-2010C四元泵高效液相色谱仪、 SPD-10Avp 紫 外-可 见 检 测 器 ( 日 本 岛 津);SAVANT SPD 2010 真 空 浓 缩机 ( Thermo Electron公司); 倒 置 显 微镜 ( Olympus); 培 养箱 ( Thermo); LEGEND Micro 21R型离心机 ( 德国 Thermo scientific公司); AE240 电子天平 (梅特勒公司)。
1.4 细胞系 H9c2 心肌细胞系, 购自武汉博士德生物工程有限公司。
2 方法和结果
2.1 香附油滴丸中 α-香附酮的检测
2.1.1 色谱条件 Diamond C18色谱柱 (150 mm× 4.6 mm, 5 μm); 检测波长 254 nm; 柱温 30 ℃;体积流量 0.8 mL/min; 进样量 20 μL;流动相为甲醇-冰醋酸水溶液 (冰醋酸体积分数为 1%), 梯度见表1。
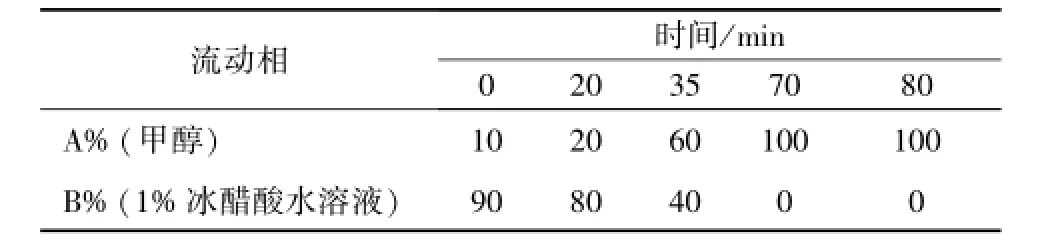
表1 流动相梯度Tab.1 G radient of mobile Phase for HPLC
2.1.2 对照品溶液的制备及标准曲线的制作 精密称取 α-香附酮对照品 0.015 34 g置于 50 mL量瓶中,加入甲醇稀释至刻度,摇匀,作为对照品溶液。 分别精密量取上述对照品溶液 1、 3、 5、 7、10 mL置于50 mL量瓶中,加入甲醇稀释至刻度,摇匀, 依法测定。 以 α-香附酮的质量浓度对色谱峰面积进行线性回归,得回归方程为 Y= 58 726X+39 618, r=0.999 7, 表明 α-香附酮在6.136 ~61.36 μg/mL内与峰面积线性关系良好。
2.1.3 供试品溶液的制备 取香附油滴丸或空白滴丸 10 粒 (约 0.20 g), 及相当量的香附油, 精密称定, 置 50 mL量瓶中, 加入甲醇 10 mL,超声溶解, 放冷, 定容, 摇匀, 用 0.45 μm微孔滤膜过滤,滤液作为供试品溶液。
2.1.4 样品检测 取各供试品溶液及 α-香附酮溶液,依法测定, 结果见图 1。 通过比较 α-香附酮对照品、 香附油、香附油滴丸及空白滴丸 HPLC, 确定峰 1、 2、 3 为香附油滴丸的主要峰, 其中峰 2 为α-香附酮, 质量分数为 3.286 mg/g。

图 1 香附油滴丸中 α-香附酮的 HPLC检测Fig.1 Assay ofα-cyPerone in droPPing Pills of volatile oil from Cyperus rotundus by HPLC
2.2 香附油滴丸灌胃给药后大鼠血清中 α-香附酮的检测
2.2.1 含药血清和空白血清样品制备 取大鼠 6只, 禁食 12 h 后眼眶采集空白血, 然后按 1.0 g/kg体质量灌胃给予香附油滴丸药液,每天 2 次,连续4 d, 末次给药 1 h后采集含药血。 空白血和含药血 低 温 放 置 后 低 速 离 心 ( 3 000 r/min ×10 min), 取上层血清 150 μL, 加甲醇 1.2 m L, 涡旋混匀, 高速离心, 取上清, 挥干, 残留物用 0.15 mL甲醇复溶, 再离心, 取上清液供 HPLC分析用。
2.2.2 样品检测 取各供试品溶液及 α-香附酮溶液, 依 “2.1.1” 项测定, 结果见图 2。 通过比较α-香附酮对照品、 香附油滴丸含药血清、 空白血清HPLC, 确定峰 2 为香附油滴丸的主要入血成分峰,即 α-香附酮, 质量浓度为 25.42 μg/mL血液,转移率为 15.47% (按大鼠平均体质量 250 g, 血液量均为10 m L计)。
2.3 香附油滴丸给予 H9c2 心肌细胞后细胞破碎液中 α-香附酮的检测

图 2 香附油滴丸灌胃给药后大鼠血清中 α-香附酮的HPLC检测Fig.2 Assay ofα-cyPerone in serum of rat adm inistered orally w ith droPPing Pills of volatile oil from Cyperus rotundus by HPLC
2.3.1 H9c2 心肌细胞培养及给药 H9c2 心肌细胞用含 12%FBS 的 DMEM培养基于 37 ℃、 5% CO2条件下培养。 称取4 mg香附油滴丸,用4 mL PBS (含 1‰的 DMSO) 涡旋溶解, 过滤灭菌, 得质量浓度为 1 mg/mL的供试液, 加入到处于对数生长期的 H9c2 心肌细胞, 并设空白对照组, 继续培养。
2.3.2 样品制备 24 h 后, 弃上清, 用适量冷PBS 洗涤 3 次, 再用适量三蒸水迅速洗涤 3 次,加三蒸水适量浸泡过夜,至细胞破裂,刮取细胞置5 mL Doff管中, 超声破碎 2 min ( 超声 10 s, 停顿15 s),加甲醇旋涡提取捕获成分并沉淀蛋白, 高速离心, 取上清在金属浴中80℃挥干。加甲醇适量超声溶解, 高速离心, 取上清供 HPLC测定用。2.3.3 样品测定 取各供试品溶液及 α-香附酮溶液, 依 “2.1.1” 项测定, 结果见图 3。 通过比较α-香附酮对照品、 加入香附油滴丸的 H9c2 心肌细胞破碎液及加入空白滴丸的 H9c2 心肌细胞破碎液HPLC, 确定峰 1、 2、 3 为香附油滴丸的细胞捕获成分峰, 其中峰 2 为 α-香附酮, 质量浓度为 4.92 μg/mL破碎液, 转移率为 74.96%。
3 讨论
香附油滴丸是为深入开发传统中药香附而自主研发的现代中药制剂,是以二氧化碳超临界流体萃取技术从传统中药香附中提取的挥发油为原料,按适宜比例与聚乙二醇 4000 等辅料混合,通过滴制法制备而成。为了有效控制香附油滴丸的质量,合理选择香附的主要活性成分进行测定是十分必要的。

图 3 香附油滴丸给予 H 9c2 心肌细胞后细胞破碎液中α-香附酮的 HPLC检测Fig.3 Assay ofα-cyPerone in disruPtion med ium of H 9c2 cells Pretreated w ith droPPing Pills of volatile oil from Cyperus rotundus by HPLC
鉴于大多数情况下药物的活性成分不但能在制剂中易被检测出来,且能进入血液并与相关的靶细胞结合。因此,选择具有该特点的成分作为药物含量测定的指标, 具有合理 性 和 科学性[1-3]。 α-香附酮作为香附的主要成分, 其活性相当广泛[4], 在香附及香附油滴丸的质量控制中曾作为定量测定指标[5-6]。为了进一步证实 α-香附酮作为香附油滴丸定量测定指标的合理性,本实验对香附油滴丸、香附油滴丸灌胃给药后大鼠血清及香附油滴丸给予H9c2 心肌细胞后细胞破碎液中 α-香附酮的移行情况进行了考察, HPLC法测定结果表明, α-香附酮能进入血液, 且能与靶细胞相结合, 从而说明 α-香附酮作为香附油滴丸的含量测定指标是合理的。
本实验选择 H9c2 心肌细胞作为 α-香附酮的靶细胞,是依据香附提取物对在体蛙心、兔心和猫心具有强心或减慢心率的作用[7]。 香附油滴丸除 α-香附酮外, 尚有其他成分进入血液或与 H9c2 心肌细胞结合,但由于缺乏相应的对照品,因此尚无法判断为何种移行成分,如能通过质谱进一步研究,可能为确定香附油滴丸其他的定量测定指标提供依据。
同时,本实验为中成药活性成分定量测定指标的确定提供了一种新的研究模式。
[ 1 ] Wang Shuping, Lei Liu, Wang Lingling, et al.Screening and analysis of themultiple absorbed bioactive components and metabolites in ratplasma after oraladministration of Jitai Tablets by high-performance liquid chromatography/diode-array detection coupled with electrospray ionization tandem mass spectrometry[ J] .Rapid Commun Mass Spectrom, 2010, 24 ( 11 ):1641-1652.
[2] 季宇彬,彭海生, 蓝苑元.血清化学的研究现状与展望[J].中草药, 2003, 34(4): 99-101.
[3] 杨秀伟,杨晓达,王 莹,等.中药化学成分肠吸收研究中 Caco-2 细胞模型和标准操作规程的建立[J].中西医结合学报, 2007, 5(6): 634-641.
[4] 田友清, 丁 平.香附挥发油的研究进展及其开发前景[J].中国药业, 2010, 19(3): 1-2.
[ 5 ] 贾宜军, 莫结丽.HPLC内标法测定香附中 α-香附酮的含量[ J] .中药材, 28(8) : 722-723.
[ 6 ] 丁 平, 田友清.HPLC法测定香附油滴丸中 α-香附酮的含量[J].江西中医药, 2010, 41(5): 55-56.
[ 7 ] Akperbekova B A.On the characteristic of chemical composition of rhizome of Cuperus rotundus L[ J] .Farmatsiia, 1967, 16(3): 36-41.
Transitional situation ofα-cyPerone in the droPPing Pills of volatile oil from Cyperus rotundus in blood and cells
TIAN You-qing1,2, DING Ping1
(1.Lianyungang TCM Branch, Jiangsu Union Technical Institute, Lianyungang 222007, China; 2.New Drug Screening Center, China Pharmaceutical University, Nanjing 210009, China)
Cyperus rotundus; dropping pills of volatile oil from Cyperus rotundus; α-cyperone; quality control
R969
: A
: 1001-1528(2014)01-0069-04
10.3969/j.issn.1001-1528.2014.01.017
2013-02-16
2012 年江苏省高校 “青蓝工程” 中青年学术带头人培养对象基金; 江苏省卫生职业技术教育研究课题 (J201215)
田友清 (1975—) , 男, 副教授, 理学博士, 从事中药物质基础研究。 Tel: 15950733866, E-mail: tyq0505@163.com

