茶多酚和银杏叶提取物联用体外抑制 ox-LDL诱导人脐静脉内皮细胞凋亡
杨 政, 蒋琳兰*
(1.广州军区广州总医院药剂科, 广东 广州 510010; 2.华南理工大学生物科学与工程学院, 广东 广州510006)
茶多酚和银杏叶提取物联用体外抑制 ox-LDL诱导人脐静脉内皮细胞凋亡
杨 政1,2, 蒋琳兰1,2*
(1.广州军区广州总医院药剂科, 广东 广州 510010; 2.华南理工大学生物科学与工程学院, 广东 广州510006)
目的 探讨茶多酚和银杏叶提取物联用对氧化型低密度脂蛋白 (ox-LDL) 诱导人脐静脉内皮细胞 (HUVEC)凋亡的体外抑制作用, 比较单个成分与两者联用组成复方的抑制效果。 方法 CCK-8 法检测药物对 HUVEC的细胞毒性,选择药物作用质量浓度;分别给予不同质量浓度茶多酚和银杏叶提取物联用组、茶多酚组和银杏叶提取物组处理HUVEC后, ox-LDL诱导细胞凋亡, 吖啶橙荧光染色观察细胞凋亡的形态学变化, Annexin V-FITC/PI流式细胞术检测HUVEC的凋亡率。 结果 低质量浓度 (20 μg/mL) 茶多酚与银杏叶提取物联合使用组的细胞毒性明显低于单独用药组, 二者联用对 ox-LDL破坏细胞形态有保护作用, 抑制 ox-LDL诱导人脐静脉内皮细胞凋亡。 结论 茶多酚和银杏叶提取物联用可抑制 ox-LDL诱导的 HUVEC凋亡; 茶多酚和银杏叶提取物联用的抑制效果好于银杏叶提取物或茶多酚单用。
茶多酚;银杏叶提取物;氧化型低密度脂蛋白;人脐静脉内皮细胞;细胞凋亡
茶多酚 ( Tea Polyphenols, TP) 是茶 叶 中 多羟 基 酚 类化合物的总称,是茶叶中的主要药用活性成分,约占干茶比例的 30%, 包括儿茶素类和黄酮类等多种成分。 TP主要成分由儿茶素类物质构成,具有较强的抗氧化活性,其中以单体表 没 食 子儿 茶 素 没 食 子 酸 酯 ( Epigallocateehin gallate, EGCG) 抗氧化活性最强, 应用范围最广[1-2]。 银杏叶提取物 (Ginkgo Biloba Extract, GBE) 是从银杏叶中提取的具有药用活性的化合物, GBE有两大主要活性成分: 总黄酮类和萜内酯类化合物,其中总黄酮类包括异鼠李素、山柰酚、槲皮素等二十多种成分;萜内酯类化合物主要包括银杏内酯 A、 B、 C和白果内酯[3], 他们具有的独特植物萜烯结构, 在治疗心脑血管疾病中被广泛应用[4]。 低密度脂蛋白 ( low density lipoprotein, LDL) 可被氧 化 修 饰 成 氧 化型低密度脂蛋白 (oxidized low density lipoprotein, ox-LDL),ox-LDL可以诱导内皮细胞表达相关炎症因子, 进一步促使泡沫细胞的形成,在动脉粥样硬化的形成和发展中发挥重要作用[5-6]。 多项研 究表明, ox-LDL可以通过 诱 导血管内皮细胞凋亡, 进而显示其细胞毒性[7]。 本实验从凋亡角度观察 TP和 GBE联用对 ox-LDL细胞毒性的体外抑制作用。目前国内外关于茶多酚和银杏叶提取物单独作用抗凋亡的研究已见报道,但尚无关于茶多酚联用银杏叶提取物抗凋亡作用研究的报道,本研究旨在探讨二者联用体外抑制 ox-LDL诱 导 的 人 脐 静 脉 内 皮 细 胞 ( humanumbilical vein endothelial cells, HUVEC) 凋 亡, 为 心 血 管 疾 病 的 联 合 用药提供依据。
1 材料与方法
1.1 主要药品及试剂 茶多酚 (纯度 >95%, 表没食子儿茶素没食子酸酯 >40%) 由广东惠州绿源保健品有限公司提供; 银杏叶提取物 (银杏黄酮≥24%, 内酯≥6%) 由广东惠州绿源保健品有限公司提供; ox-LDL购于广州奕源生物科技有限公司; CCK-8 购于日本同仁化学研究所;DMEM (高糖) 培养基、 胎牛血清、 双抗 (青霉素及链霉素溶液)、 胰蛋白酶 (0.25%EDTA) 购于美国 Hyclone公司; 吖啶橙购于 MBCHEM 公司; Annexin V-FITC/PI试剂盒购于美国 BioVision 公司。
1.2 主要仪器设备 细 胞 培 养 箱 ( Forma Scientific Inc),超净工作台 (苏州安泰空气技术有限公司); 5410 型恒温CO2培养箱 (美国 NAPCO公司); IX70 倒置显微镜 ( 日本OLYMPUS 公司); 酶标仪 (美国 BIOCELL公司); 倒置荧光显微镜 ( 日本 OLYMPUS 公司) ; 流式细胞仪 ( 美国 Millipore公司)。
1.3 细胞系 人脐静脉内皮细胞株 (HUVEC), 由广州军区广州总医院医学实验科提供。
1.4 实验方法
1.4.1 细胞培养及细胞悬液的制备 人脐静脉内皮细胞株HUVEC培养于含 10%胎牛血清、 终浓度为 100 U/mL的青霉素和链霉素的 DMEM培养液中, 置 37 ℃、 5%CO2的培养箱培养,取对数生长期细胞用于实验。
1.4.2 细胞增殖活性检测 选择对数生长期 HUVEC细胞,接种于96 孔板, 各孔体积 100 μL, 含有 1 ×104个细胞, 分别加入不同终质量浓度 (20、 40、 80、 160、 320 μg/mL) 的茶多酚和不同终质量浓度 (20、 40、 80、 160、 320 μg/mL)的银杏叶提取物培养24 h, 同时设定不加药的正常对照组和无细胞培养基空培的空白对照组,每组设6个复孔。预处理结束, 加 ox-LDL至终质量浓度为 100 μg/mL培养 24 h, 到达时点后, 加入 CCK-8 10 μL/孔, 继续培养 1 h, 于酶标仪450 nm波长测定吸光度 A值。 细胞生长抑制率计算公式:细胞增殖率 = (实验组A值-空白对照组A值) /(正常对照组 A值 -空白对照组 A值) ×100%。
1.4.3 吖啶橙 (AO) 荧光染色 细胞以每孔 1 ×105个/mL接种于6孔板中,每孔各放入一爬片专用盖玻片,细胞贴壁后加入药物作用 24 h, 接着加 ox-LDL处理 24 h。 取出细胞爬片, PBS 漂洗 3 次, 以 95%乙醇固定 5min, 待乙醇微干,用 0.01%AO染液染色 5 min, PBS 临时固封, 荧光显微镜下观察并拍照。
1.4.4 细胞凋亡检测 细胞培养 24 h 后, 实验组分别加茶多酚 (终质量浓度为 20 μg/mL)、 银杏叶提取物 (终质量浓度为 20 μg/mL)、 两药混合 (1 ∶1, 终质量浓度为20 μg/mL), 模型组、 正常对照组不加药处理 24 h 后, 除正常 对 照 组 外 其 他 各 组 均 加 ox-LDL至 终 质 量 浓 度 为100 μg/mL, 37 ℃、 5%CO2培养箱中培养 24 h, 胰酶消化制成单细胞悬液, 1 000 r/min 离心 5min, 弃上清, 用预冷的 PBS 漂洗细胞 2 次, 调整细胞密度为 1 ×105个/mL, 用190 μL预冷的 1 ×Binding Buffer轻轻重悬, 加 5 μLAnnexin V-FITC室温避光反应 10 m in, 接着加 5 μL PI室温避光反应, 随即上流式细胞仪检测, 激发波长 488 nm测定细胞凋亡率。
2 结果
2.1 CCK-8 法 检 测 细 胞 增 殖 活 性 茶 多 酚 20、 40、 80、160、 320 μg/mL 作 用 HUVEC 时, 以 正 常 对 照 组(0 μg/mL) 为准, 重复次数 (n=6), 细胞的增殖率分别为92.08%、 89.65%、 86.84%、 84.39%和 33.25%, 其中 80、160、 320 μg/mL 3 组细胞增殖率与空白对照组差异极显著(P<0.01) (表 1)。 同样计量的银杏叶提取物作用细胞时,细胞的增殖率分别为 94.06%、 89.16%、 85.09%、 83.30%和 81.57%, 其中 80 μg/mL组细胞 增 殖率与正 常 对 照组(0 μg/mL) 差异显著 (P<0.05), 160 μg/mL、 320 μg/mL组与正常对照组差异极显著 (P<0.01) (表 1)。 两种药物在剂量为 20 μg/mL和 40 μg/mL时, 细胞增殖率与正常对照组相比无显著差异,且两种剂量间也无显著差异,小剂量20 μg/mL组的细胞增殖率高于 40 μg/mL组。 因此, 为检测两种药物联用时的保护作用,银杏叶提取物和茶多酚都选择小剂量 20 μg/mL用于后续实验; 联用组 20 μg/mL, 银杏叶提取物和茶多酚比例1 ∶1。
2.2 吖啶橙 (AO) 荧光染色观察凋亡细胞形态学特征
荧光显微镜观察结果显示 (如图 1), 正常对照组 (E) 细胞形态正常,增殖旺盛,镜下可见呈正常生长分裂状态的细胞; ox-LDL 100 μg/m L单独处理细胞 24 h 后 (D), 细胞密度减少,并可见典型的凋亡细胞形态特征:核固缩、体积缩小和表面起泡,细胞核或细胞质内可见致密浓染的黄绿色荧光;茶多酚联合银杏叶提取物预处理细胞后(C), 细胞增殖旺盛, 细胞质和核仁内有大量 RNA, 被染为桔黄或桔红色荧光, 细胞核中有大量 DNA, 表现为黄绿色荧光深浅不一的结构样特征; 茶多酚组 (A)、 银杏叶提取物组 (B) 细胞形态良好, 但镜下仍有细胞体积缩小,银杏叶提取物镜下有细胞核固缩,呈现凋亡晚期状态。
表 1 HUVEC细胞增殖活性检测 (n=6,)
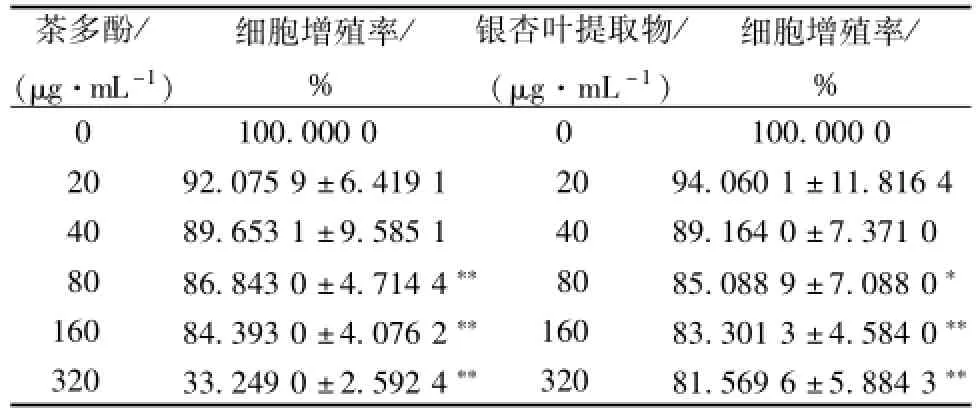
表 1 HUVEC细胞增殖活性检测 (n=6,)
注: 与正常对照组 (0 μg/m L) 比较,*P<0.05,**P<0.01
茶多酚/(μg·mL-1)细胞增殖率/ %银杏叶提取物/( μg·m L-1)细胞增殖率/ % 0 100.000 0 0 100.000 0 20 92.075 9 ±6.419 1 20 94.060 1 ±11.816 4 40 89.653 1 ±9.585 1 40 89.164 0 ±7.371 0 80 86.843 0 ±4.714 4** 80 85.088 9 ±7.088 0*160 84.393 0 ±4.076 2** 160 83.301 3 ±4.584 0**320 33.249 0 ±2.592 4** 320 81.569 6 ±5.884 3**
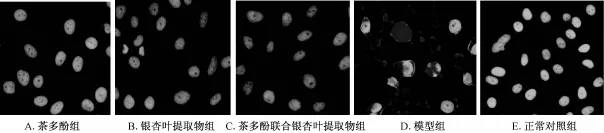
图1 吖啶橙法观察细胞细胞形态
2.3 Annexin V-FITC/PI双染法检测细胞凋亡 结果显示(如图2): 图形经十字分成四个区域, 左下角区域为正常生长的活细胞;右下角区域为早期凋亡的细胞;右上角区域为凋亡晚期的细胞和坏死细胞;左上角区域为细胞收集过程中被损伤少量细胞和细胞碎片。 不同实验组抑制 ox-LDL诱导 HUVEC凋亡作用见表2。
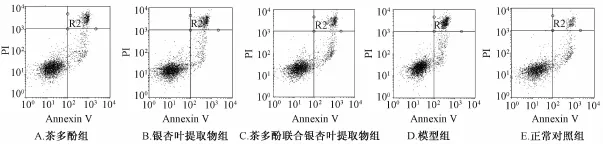
图2 流式细胞术检测细胞凋亡
表 2 不同实 验 组 抑 制 ox-LDL诱导 HUVEC凋亡 的 作 用(n=6,)

表 2 不同实 验 组 抑 制 ox-LDL诱导 HUVEC凋亡 的 作 用(n=6,)
注: 与模型组比较,*P<0.05
组别 凋亡率/%茶多 酚 20 μg/m L组20.44 ±1.32银杏 叶提 取物 20 μg/m L组 21.28 ±0.86茶多 酚联 合银杏叶提 取物 20 μg/m L组 15.30 ±1.09*模型组 22.84 ±1.18正常对照组13.93 ±0.78
3 讨论
内皮功能 紊 乱 是 动 脉 粥 样 硬 化 ( Atherosclerosis, AS )早期表现的主要特征之一[8]。 ox-LDL可以损伤内皮细胞,诱导细胞黏附分子和细胞因子的表达,促进泡沫细胞的形成, ox-LDL还能诱导内皮细胞发生凋亡, 促进 AS 形成及发展[9]。 近年来 ox-LDL通过作用内皮细胞进而影响 AS 的发生发展方面的研究越来越受到重视,为寻求更多的治疗方法,中药在预防治疗心血管疾病中的作用越来越明显[10]。 基于此, 本实验探讨了银杏叶提取物和茶多酚联合应用抑制 ox-LDL诱导的人气静脉内皮细胞凋亡作用, 为将两者联合应用于预防治疗AS提供实验依据。
本研究结果显示,不同质量浓度的银杏叶提取物和茶多酚分别作用于HUVEC, 对细胞的增殖具有抑制作用, 两者在低质量浓度时对细胞的抑制作用较对照组不明显,高质量浓度茶多酚的抑制作用明显,因此两者均选择低质量浓度用以探究两者联用对 ox-LDL诱导 HUVEC凋亡的抑制作用。 流式细胞术检测结果显示, 模型组凋亡率为 22.84%, 正常对照组凋亡率为13.93%, 茶多酚和银杏叶提取物都有抑制 ox-LDL诱导 HUVEC凋亡的作用, 两组凋亡率分别为 20.44%和21.28%, 联合用药是凋亡率为 15.30%, 结果表明单独用药作用不明显,联合应用具有协同抑制细胞凋亡作用,较单用其中一种药物时效果提高,且差异显著。吖啶橙染色后可直接观察到经 ox-LDL作用后细胞体积缩小, 胞质浓缩, 核固缩和表面起泡等凋亡的形态学特征,细胞核或细胞质内可见致密浓染的黄绿色荧光,为核染色质固缩所致。加入银杏叶提取物和茶多酚处理,细胞形态改善,但仍有核固缩和染色质固缩现象,联用组细胞形态正常,未发现异常的细胞形态。 以上结果表明银杏叶提取物和茶多酚联用能抑制 ox-LDL诱导的 HUVEC凋亡, 抑制效果要好于单独用药。 尽管两者联合应用呈现协同增强效果,但在哪些环节上产生协同作用尚不清楚,其分子机制尚需深入研究。
[ 1 ] Mukhtar H, Ahmad N.Tea polyphenols: prevention of cancer and optimizing health [ J].Am Nutr, 2000, 71 ( 6 ) :1698-1702.
[ 2 ] Erba D, Riso P, Bordoni A, et al.Effectiveness ofmoderate green tea consumption on antioxidative status and plasma lipid profile in humans[ J] .J Nutr Biochem, 2005, 16 ( 3 ):144-149.
[3] 牟玲丽,寇俊萍,朱丹妮,等.银杏叶的化学成分及其抗氧化活性[J].中国天然药物, 2008, 6(1): 26-29.
[ 4 ] Clement Y.Can green tea do that? A literature review of the clinical evidence[ J] .Prevent Med, 2009, 49(2) : 83-87.
[ 5 ] Steinberg D, Parthasarathy S, Carew T E, et al.Beyond cholesterol: modifications of low-density lipoprotein that increseits atherogenecity[ J] .N Engl JMed, 1989, 320(3) : 915-924.
[ 6 ] Lee H Y, Kima SD, Baek SH, et al.Serum amyloid A stimulates macrophage foam cell formation via lectin-like oxidized low-density lipoprotein receptor 1 upregulation [ J] .Biochem Biophys Res Communicat, 2013, 433(1) : 18-23.
[ 7 ] Chu C Y, Lee H J, Chu C Y, et al.Protective effects of leaf extract of Zanthoxylum ailanthoides on oxidation of low-density lipoprotein and accumulation of lipid in differentiated THP-1 cells[ J] .Food Chem Toxicol, 2009, 47 (6) : 1265-1271.
[ 8 ] Jaqueline M, Elisabeth W, Mariana A H, et al.Green tea extract reverses endothelial dysfunction and reduces atherosclerosis progression in homozygous knockout low-density lipoprotein receptormice[ J] .Nutrition Research, 2012, 32(9): 684-693.
[ 9 ] Ishigaki Y, Oka Y, Katagiri H.Circulating oxidized LDL: a biomarker and a pathogenic factor[ J] .Curr Opin Lipidol,2009, 20(5): 363-369.
[10] Xu Z X, Wang Y Q, Liu G P, et al.Clinical distribution of traditional Chinesemedicine syndromes on cardiovascular diseases[ J] .World Sci Technol, 2010, 12(6) : 888-891.
R285.5
: B
: 1001-1528(2014)05-1062-04
10.3969/j.issn.1001-1528.2014.05.041
2013-06-12
广东省重大科技专项 (2011A0803000)
杨 政 (1989—) , 男, 硕士生, 研究方向: 药物天然产物。 Tel: 13763339781; E-mail: jasonright@163.com
*通信作者: 蒋琳兰 (1962—) , 女, 硕士, 主任药师, 研究方向: 天然药物及医院制剂。 E-mail: jlinlan@163.net

