小儿牛黄清心散对幼年大鼠惊厥性脑损伤的保护作用
李文娟, 蒋 莉, 陈恒胜, 陈小璐
(重庆医科大学附属儿童医院 儿童发育疾病研究省部共建教育部重点实验室 儿科学重庆市重点实验室 重庆市儿童发育重大疾病诊治与预防国际科技合作基地,重庆 400014)
小儿牛黄清心散对幼年大鼠惊厥性脑损伤的保护作用
李文娟, 蒋 莉*, 陈恒胜, 陈小璐
(重庆医科大学附属儿童医院 儿童发育疾病研究省部共建教育部重点实验室 儿科学重庆市重点实验室 重庆市儿童发育重大疾病诊治与预防国际科技合作基地,重庆 400014)
目的 研究小儿牛黄清心散对幼年大鼠惊厥性脑损伤的保护作用。 方法 21 日龄 SD大鼠按随机数字表法分为5组:正常对照组,模型对照组,小儿牛黄清心散高、中、低剂量组。除正常对照组外,各组分别给予生理盐水、小儿牛黄清心散灌胃, 给药 1 d 后, 给予戊四唑 (70mg/kg) 腹腔注射, 定时取脑组织标本行病理检查、 免疫组化检测IL-1β和胶质纤维性蛋白 (GFAP) 在脑组织中的表达及采用 TUNEL染色法检测大脑皮层和海马 CA1 神经元的凋亡情况。 结果 小儿牛黄清心散高剂量组中各时间点大脑皮层和海马 IL-1β和 GFAP表达、 凋亡指数较模型对照组显著减少,与正常对照组比较无显著差异;小儿牛黄清心散中剂量组上述各指标均较模型对照组减少,但仍高于正常对照组;小儿牛黄清心散低剂量组与模型对照组比较无显著差异。结论 小儿牛黄清心散可呈剂量依赖性对由戊四唑引起的惊厥性幼鼠脑损伤起保护作用。
小儿牛黄清心散;戊四唑;惊厥;脑损伤;脑保护;幼年大鼠
惊厥是小儿时期最常见的神经系统急症,在儿童中的发生率高达 3% ~5%, 且与成人相比, 小儿惊厥更易出现严重惊厥和惊厥持续状态 ( status convulsion, SC)[1]。既往研究 证实, SC可造成脑损伤,出现皮层及海马神经元凋亡,神经元缺失,胶质疤痕形成及苔藓纤维样变。近年众多研究表明, 免疫系统也参与脑损伤的病理过程[2]。 IL-1β作为一种炎症介质参与惊厥性脑损伤的启动过程[3],不仅介导惊厥持续状态后神经元坏死的发生[4], 还可通过 IL-1R/IκB/NFκB信号通路介导星形胶质细胞 ( Astrocyte, Ast)增生活化[5]。 胶质 纤 维 性 蛋 白 ( glial fibriliary acidic protein,GFAP)是 Ast特有的细胞骨架蛋白, GFAP是反映星形胶质细胞状态的有效指标[6], 中枢神经系统受损时 Ast会发生反应性增生, GFAP表达上调。
小儿牛黄清心散是我国著名的中成药之一,主要是由天麻、胆南星等十四味中药配伍而成。前期研究表明,小儿牛黄清心散有剂量依赖性的预防大鼠惊厥的作用,但其对惊厥性脑损伤是否有保护作用,目前尚不清楚。本实验通过检测小儿牛黄清心散先干预再予戊四唑腹腔注射后不同时间点各组幼鼠大脑组织中皮层及海马神经元凋亡及 IL-1β、 GFAP表达动态变化的情况, 旨在探讨小儿牛黄清心散对惊厥幼鼠神经元的保护作用及相关机制。
1 材料与方法
1.1 实验动物 健康 SPF级 21 日龄 SD大鼠 240只, 雌雄各半, 体质量 (45 ±5) g, 由重庆医科大学 动 物 实 验 中 心 提 供。 动 物 许 可 证 号 syxk(渝) 20040001。
1.2 主要试剂及器材 小儿牛黄清心散 (山东方健制药有限公司提供, 国药准字 Z37020495); 戊四唑 ( pentylenetetrazole,PTZ, 美国 Sigma公司);IL-1β抗体 ( Santacruze公司) ; GFAP抗体 ( 美国Sigma公司); 组化试剂盒 ( 北京 中杉金桥公司)TUNEL试剂盒 (美国 Roche公司); BX-51 荧光显微镜及成像系统 (日本 Olympus公司)。
1.3 动物分组及模型制备 21 日龄 SD大鼠按随机数字表法分为5组:正常对照组,模型对照组,小儿牛黄清心散高、中、低剂量组。各组分别给予生理盐水 2 mL, 小儿牛黄 清 心 散 16、 8、 0.3 g/(kg·d)分早晚 2 次灌胃, 给药 1 d, 灌胃结束后 30 min, 给 予戊四唑 ( 70 mg/kg) 腹 腔 注 射,在戊四唑注射后 4 h、 12 h、 24 h、 48 h、 72 h、 7 d时间点, 留取脑组织标本 (每个时间点8只, 若有死亡者补充至8只)。
1.4 尼氏染色观察各组脑组织的病理变化 各组脑组织各时间点切片行尼氏染色,观察皮层及海马神经元坏死情况。
1.5 DNA原位末端标记法 (TUNEL法) 检测胰腺组织细胞凋亡 按试剂盒说明书操作,脑组织细胞核中有棕黄色颗粒者为凋亡细胞,每张切片在400 倍高倍镜下随机选取 5 个视野,计算凋亡细胞数和细胞总数, 凋亡指数 (AI) = (凋亡细胞数/总细胞数) ×100%
1.6 脑组织中 GFAP和 IL-1β的表达 采用 SABC免疫组化染色法检测。具体方法参照既往报道[7],以包浆中出现棕黄色颗粒细胞为 GFAP、 IL-1β阳性细胞。 使用 Olympus自动图像采集系统, 每张切片在光学显微镜下以相同倍数 (400) 于脑组织皮层和海马各区分别随机计数5个不相重叠的高倍镜视野, 应用 Image Pro Plus 5.0 专业图像分析软件对其测量累计光密度值 ( integrated opitical density,IOD) 进行图像分析。
SPSS 17.0 软件进行统计学处理,多个样本均数比较采用方差分析, 以 SNK-q 检验进行均数间多重比较。
2 结果
2.1 各组大鼠脑组织病理变化 正常 SD大鼠神经元细胞核大而圆,呈淡蓝色,中央有清楚核仁。模型对照组脑组织切片出现明显神经元变性、 死亡, 以24 h最为显著, 如图 1所示,高倍镜视野下海马 CA1区和皮层中可见单个或散在的变性、坏死细胞,变性细胞肿胀,体积增大,胞核偏位,死亡的细胞核深染、核体积缩小,核溶解。高剂量干预组各时间点未见明显坏死。中剂量干预组可见坏死神经元较模型对照组明显减少;低剂量干预组可见坏死神经元与模型对照组无明显差异。
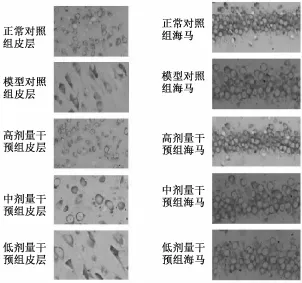
图 1 各组大鼠 24 h时间点脑组织中皮层及海马神经元尼氏染色 ( ×200 倍)Fig.1 Nissl staning of neurons in cortex and hippocam pus of the brain tissues at time point of24 hours in each group( ×200)
2.2 各组大鼠脑组织中皮层及海马神经元的凋亡情况 与正常对照组相应时间点相比,模型对照组大鼠的脑组织于 SC后12 h 时间点海马CA1 区和皮层 TUNEL阳性细胞数开始显著增加, 表现为有明显的染色质聚集、胞质浓缩、细胞核皱缩、周围空泡形成及单个圆形凋亡小体,并在 48 h达高峰(P<0.05)。 高剂量干预组各时间点海马 CA1 区及皮层 TUNEL阳性细胞数与模型组各时间点比较,差异有统计学意义,与正常对照组比较,差异无统计学意义。 中剂量干预组中 12、 24、 48 h 各亚组TUNEL阳性细胞数均较模型组显著下降 (P<0.05), 但仍显著高于正常对照组 (P<0.05), 低剂量干预组与模型对照组比较,未见统计学差异。见表1 ~2, 图 2 ~图 3。
表1 各组各时间点皮层神经元凋亡指数情况 (%,)Tab.1 Apoptotic index of neurons in cortex at different time points in each group(%,)

表1 各组各时间点皮层神经元凋亡指数情况 (%,)Tab.1 Apoptotic index of neurons in cortex at different time points in each group(%,)
注: 与正常对照组比较,°P<0.05; 与模型对照组比较,*P<0.05
4 h 12 h 24 h 48 h 72 h 7 d正常对照组组别 动物数/只8 1.16 ±0.27 1.14 ±0.26 1.16 ±0.27 1.16 ±0.32 1.36 ±0.25 1.28 ±0.31模型对照组 8 1.18 ±0.29 8.73 ±1.35° 12.36 ±2.38° 43.05 ±3.21° 28.3 ±2.75° 6.3 ±0.80°高剂量干预组 8 1.19 ±0.21 1.31 ±0.23* 1.28 ±0.18* 1.18 ±0.15* 1.15 ±0.23* 1.16 ±0.19*中剂量干预组 8 1.17 ±0.32 5.21 ±0.54* 8.35 ±1.42* 22.3 ±2.62* 11.6 ±1.83* 3.94 ±0.62*低剂量干预组8 1.16 ±0.19 8.37 ±1.63 11.59 ±2.12 41.3 ±2.14 22.4 ±1.35 6.2 ±0.42
表2 各组各时间点海马 CA1 区神经元凋亡指数情况 (%,)Tab.2 Apoptotic index of neurons in CA1 region of the hippocam pus at d ifferent time points in each group( %,)

表2 各组各时间点海马 CA1 区神经元凋亡指数情况 (%,)Tab.2 Apoptotic index of neurons in CA1 region of the hippocam pus at d ifferent time points in each group( %,)
注: 与正常对照组比较,°P<0.05; 与模型对照组比较,*P<0.05
4 h 12 h 24 h 48 h 72 h 7 d正常对照组1.3 ±0.6 1.3 ±0.5 1.7 ±0.6 1.5 ±0.8 1.3 ±0.4 1.4 ±0.4模型对照组 8 1.5 ±0.4 5.50 ±1.8° 10.7 ±2.1° 19.5 ±4.3° 9.8 ±1.2° 4.1 ±0.7°高剂量干预组 8 1.3 ±0.3 1.3 ±0.6* 1.4 ±0.4* 1.4 ±0.5* 1.3 ±0.6* 1.5 ±0.6*中剂量干预组 8 1.4 ±0.5 3.2 ±0.5* 3.8 ±0.4* 4.3 ±1.1* 3.6 ±0.8* 2.8 ±0.5*低剂量干预组8 1.3 ±0.7 5.2 ±1.3 8.6 ±2.1 17.5 ±4.1 9.3 ±1.7 4.3 ±0.5 8组别 动物数/只

图 2 各组各时间点皮层神经元凋亡情况 ( ×200 倍)Fig.2 Apoptotic neurodegeneration of neurons in cortex at different time points in each group( ×200)

图 3 各组各时间点海马 CA1 区神经元凋亡情况 ( ×200倍)Fig.3 Apoptotic neurodegeneration of neurons in the CA1 region of hippocampus at different time points in each group( ×200)
2.3 各组脑组织中 IL-1β、 GFAP的表达 免疫组化结果如表3~6所示。 结果显示正常对照组皮层和海马 CA1 区中 IL-1β的表达极弱, 模型对照组大鼠 IL-1β表达在 SC后 12 h 海马 CA1 区 IL-1β阳性细胞增多, 以 24 h 最为显著, 48 h 开始减少, IOD值也均有增高。高剂量干预组相应时间点与模型组相比, IOD差值有统计学意义 (P<0.05), 与正常对照组比较,未见统计学差异。中剂量干预组中12、 24、 48 h 组 IL-1β阳性细胞数均较模型组明显减少,但仍高于正常对照组,差异有统计学意义(P<0.05);低剂量干预组与模型对照组比较,各时间点均无显著差异 (P>0.05)。
表 3 各组大鼠不同时间点的皮层中 IL-1β的 IOD值变化的情况 ()Tab.3 Changes of IOD value of IL-1βin the cor tex at different time points in each group()

表 3 各组大鼠不同时间点的皮层中 IL-1β的 IOD值变化的情况 ()Tab.3 Changes of IOD value of IL-1βin the cor tex at different time points in each group()
注: 与正常对照组比较,°P<0.05; 与模型对照组比较,*P<0.05
4 h 12 h 24 h 48 h 72 h 7 d正常 对照 组 8 0.014 5 ±0.000 6 0.015 1 ±0.000 9 0.014 7 ±0.000 7 0.015 0 ±0.001 1 0.015 3 ±0.000 8 0.014 9 ±0.0组别 动物数/只01 2模型 对照 组 8 0.015 3 ±0.000 7 0.031 5 ±0.001 2°0.057 3 ±0.004 2°0.051 1 ±0.003 9°0.043 8 ±0.002 7°0.031 7 ±0.001 5°高剂 量干 预组 8 0.014 7 ±0.000 6 0.015 3 ±0.001 7*0.014 8 ±0.000 7*0.015 4 ±0.001 5*0.015 2 ±0.001 3*0.014 6 ±0.001 1*中剂 量干 预组 8 0.015 1 ±0.000 8 0.022 6 ±0.001 5*0.039 9 ±0.002 4*0.037 2 ±0.002 1*0.026 5 ±0.001 3*0.021 7 ±0.001 2*低剂 量干 预组 8 0.015 6 ±0.000 9 0.032 3 ±0.001 7 0.056 9 ±0.003 1 0.051 3 ±0.003 6 0.043 2 ±0.002 7 0.032 9 ±0.001 6
表 4 各组大鼠不同时间点海马 CA1 区中 IL-1β的 IOD值变化的情况 ()Tab.4 Changes of IOD value of IL-1βin the CA1 region of the hippocam pus at different time points in each group()

表 4 各组大鼠不同时间点海马 CA1 区中 IL-1β的 IOD值变化的情况 ()Tab.4 Changes of IOD value of IL-1βin the CA1 region of the hippocam pus at different time points in each group()
注: 与正常对照组比较,°P<0.05; 与模型对照组比较,*P<0.05
4 h 12 h 24 h 48 h 72 h 7 d正常 对照 组 8 0.015 2 ±0.001 7 0.015 7 ±0.000 9 0.016 1 ±0.000 7 0.014 8 ±0.001 2 0.015 6 ±0.000 8 0.015 4 ±0.组别 动物数/只001 1模型 对照 组 8 0.015 8 ±0.001 3 0.064 1 ±0.003 5°0.115 8 ±0.017 4°0.093 3 ±0.012 6°0.069 4 ±0.007 7°0.056 2 ±0.002 9°高剂 量干 预组 8 0.016 1 ±0.001 8 0.015 9 ±0.001 5*0.015 6 ±0.001 7*0.014 9 ±0.002 1*0.015 5 ±0.001 3*0.015 8 ±0.001 1*中剂 量干 预组 8 0.015 9 ±0.001 5 0.037 7 ±0.003 1*0.062 5 ±0.005 3*0.057 7 ±0.004 6*0.038 3 ±0.003 5*0.029 9 ±0.002 4*低剂 量干 预组 8 0.016 2 ±0.001 9 0.063 5 ±0.005 2 0.109 7 ±0.012 4 0.092 2 ±0.011 7 0.065 8 ±0.005 9 0.055 3 ±0.004 7
表 5 各组大鼠不同时间点皮层中 GFAP的 IOD值变化的情况 ()Tab.5 Changes of IOD value of GFAP in the cortex at different tim e points in each group()

表 5 各组大鼠不同时间点皮层中 GFAP的 IOD值变化的情况 ()Tab.5 Changes of IOD value of GFAP in the cortex at different tim e points in each group()
注: 与正常对照组比较,°P<0.05; 与模型对照组比较,*P<0.05
4 h 12 h 24 h 48 h 72 h 7 d正常 对照 组 8 0.241 3 ±0.009 2 0.241 5 ±0.008 6 0.241 8 ±0.008 3 0.242 0 ±0.007 9 0.242 3 ±0.006 5 0.238 6 ±0组别 动物数/只.007 5模型 对照 组 8 0.270 5 ±0.011 7°0.397 3 ±0.013 0°0.469 0 ±0.012 9°0.563 6 ±0.109 5°0.599 7 ±0.113 1°0.630 2 ±0.128 2°高剂 量干 预组 8 0.252 3 ±0.009 5*0.258 3 ±0.006 7*0.243 2 ±0.012 2*0.251 7 ±0.008 7*0.238 9 ±0.009 5*0.249 5 ±0.007 8*中剂 量干 预组 8 0.260 2 ±0.023 1*0.314 5 ±0.023 2*0.382 7 ±0.031 9*0.435 9 ±0.027 4*0.492 7 ±0.039 5*0.513 8 ±0.047 5*低剂 量干 预组 8 0.269 8 ±0.013 5 0.388 5 ±0.012 7 0.463 8 ±0.021 3 0.557 8 ±0.049 9 0.601 2 ±0.110 3 0.627 7 ±0.088 2
表 6 各组大鼠不同时间点海马 CA1 区中的 GFAP的 IOD值变化的情况 ()Tab.6 Changes of IOD value of GFAP in the CA1 region of the hippocam pus at different time points in each group()

表 6 各组大鼠不同时间点海马 CA1 区中的 GFAP的 IOD值变化的情况 ()Tab.6 Changes of IOD value of GFAP in the CA1 region of the hippocam pus at different time points in each group()
注: 与正常对照组比较,°P<0.05; 与模型对照组比较,*P<0.05
4 h 12 h 24 h 48 h 72 h 7 d正常 对照 组 8 0.213 9 ±0.008 7 0.218 7 ±0.013 8 0.215 8 ±0.013 1 0.231 6 ±0.075 0.227 1 ±0.006 3 0.226 3 ±0.组别 动物数/只012 1模型 对照 组 8 0.268 1 ±0.012 1°0.343 7 ±0.017 5°0.437 5 ±0.023 2°0.559 3 ±0.040 9°0.601 3 ±0.041 7°0.640 7 ±0.058 5°高剂 量干 预组 8 0.214 9 ±0.006 5*0.228 9 ±0.015 7*0.216 9 ±0.013 4*0.240 6 ±0.095*0.228 3 ±0.007 3*0.229 7 ±0.015 4*中剂 量干 预组 8 0.234 7 ±0.007 2*0.279 1 ±0.008 3*0.315 7 ±0.024 5*0.392 2 ±0.031 8*0.419 5 ±0.039 7*0.452 9 ±0.041 3*低剂 量干 预组 8 0.257 3 ±0.016 3 0.339 2 ±0.027 1 0.428 9 ±0.023 7 0.547 8 ±0.031 1 0.599 6 ±0.042 2 0.641 2 ±0.087 5
正常对照组皮层和海马 CA1 区星型胶质细胞胞浆中 GFAP有少量表达, 模型对照组大鼠皮层和海马 CA1 区在各时间点有不同程度的棕黄色阳性细胞表达, 其免疫反应累积光密度 (IOD) 值在惊厥后4 h开始稍有升高,后逐渐增高,7 d时间点最为明显,与正常对照组对应时间点比较显著增多(P<0.05)。 高剂量干预组相应时间点与模型组相比, IOD值显著减少 (P<0.05), 与正常对照组比较无显著差异 (P>0.05); 而中剂量干预组大鼠皮层及海马 CA1 区 GFAP蛋白表达在各时间点较模型组均有下降 (P<0.05), 但仍高于正常对照组 (P<0.05); 低剂量干预组与模型对照组比较, 各时间点均无显著差异 (P>0.05)。
3 讨论
近年来, 有研究报道促炎因子如 IL-1β的激活可能 在 痫 性 发 生 中 起 着 重 要 作 用[8],脂 多 糖(LPS) 诱导的炎症性反应会加重癫癎大鼠模型的癎性发生[9]。 IL-1β主要由脑内的胶质细胞, 血脑屏障的内皮细胞, 神经元, 淋巴细胞[10]通过自分泌和旁分泌的途径产生, IL-1β既可通过引起中枢神经系统潜在的神经毒性分子如花生四烯酸及其代谢产物、一氧化氮等的释放[11]而产生神经毒性作用, 使神经元凋亡并坏死, 还能够通过 IL-1 受体和 toll样受体系统的激活发挥作用[12], 刺激胶质细胞活化从而调节神经递质,突触传递,神经元的兴奋性和自发放电的产生[13]。 因此,越来越多研究证实抗炎治疗可能是治疗癫癎的靶点之一[14]。
小儿牛黄清心散是我国著名的中成药之一,主要是由天麻、胆南星、黄连、赤芍、大黄、全蝎、水牛角浓缩粉、 僵蚕 (麸炒)、 牛黄、 琥珀、 雄黄、冰片、朱砂、金礞石 (煅)这十四味中药组合而成。 研究表明, 其成分中含有的牛黄[15]、 大黄[16]等有抗炎的作用。因此,推测小儿牛黄清心散可能通过抗炎机制发挥脑保护的生物学作用。
本研究发现模型对照组大鼠在 SC后12 h 海马CA1 区及皮层 IL-1β的表达开始明显增多, 24 h 最为显著, 48 h开始减少, 7 d 下降, 但未至正常,同时该组大鼠皮层和海马神经元在惊厥发作后12 h时开始凋亡率增高、 坏死增加, 这说明 IL-1β可能参与了惊厥性脑损伤的启动的过程, GFAP的表达从4 h开始增多,余时间点均持续性增高,这与文献报道[7]相符。 而 48 h ~7 d 时间点时 IL-1β的表达下调,提示可能与胶质细胞在增生后期的分泌功能下降有关。
在给予小儿牛黄清心散干预后,发现各相同时间点的高剂量小儿牛黄清心散干预组大鼠大脑皮层和海马病理形态较好,凋亡和坏死的发生显著减少, IL-1β及 GFAP的表达明显下降, 与正常对照组未见明显差异;而中剂量小儿牛黄清心散干预组的大鼠的大脑皮层和海马坏死及凋亡减轻, IL-1β及 GFAP的表达减少但未至正常; 低剂量干预组与模型对照组的脑组织病理变化相似。提示高剂量的小儿牛黄清心散可有效减少惊厥性脑损伤,中剂量的小儿牛黄清心散可减轻幼年大鼠的惊厥性脑损伤,而低剂量的小儿牛黄清心散对惊厥性脑损伤并无显著保护作用。
因此, 小儿牛黄清心散可能通 过下调 IL-1β,减少大脑皮层和海马神经元坏死凋亡,抑制胶质细胞活化产生的下游损伤通路,发挥脑保护作用。在后续实验中,将进一步阐明其中的可能机制。
[ 1 ] Haut SR, Velísková J, MoshéS L.Susceptibility of immature and adult brains to seizure effects[ J] .Lancet Neurol, 2004,3(10): 608-617.
[ 2 ] Holopainen IE.Seizures in the developing brain : celluar and molecular mechanisms of neuronal damage, neurogenisis and cellular reorganization [ J] .Neuro Chem Int, 2008, 52 (6 ):935-947.
[ 3 ] Patel H C, Ross FM, Heenan L E, et al.Neurodegenerative actions of interleukin-l in the rat brain aremediated through increasesin seizure activity[ J] .JNeurosci Res, 2006, 83( 3 ):385-391.
[ 4 ] Allan SM, Tyrrell P J, Rothwell N J.Interleukin-1 and neuronal injury[J] .Nat Rev Immunol, 2005, 5(8) : 629-640.
[ 5 ] Moynagh P N.Interleukin-1 signalling in astrocytes, a key contributor to inflammation in the brain [ J] .J Anat, 2005, 207(3): 265-269.
[ 6 ] Martinian L, Boer K, Middeldorp J, etal.Expression patterns of glial fibrillary acidic protein (GFAP) -delta in epilepsy-associated lesional pathologies[ J].Neuropathol Appl Neurobiol,2009, 35(4): 394-405.
[ 7 ] Ravizza T, RizziM, Perego C.Inflammatory response and glia activation in developing rat hippocampus after status epilepticus[ J] .Epilepsia, 2005, 46(5) : 113-117.
[ 8 ] Ravizza T, Balosso S, Vezzani A.Inflammation and prevention of epileptogenesis[ J] .Neurosci Lett, 2011, 497 ( 3 ):223-230.
[ 9 ] Auvin S, Mazarati A, Shin D, et al.Inflammation enhances epileptogenesis in the developing rat brain[ J] .Neurobiol Dis,2010, 40(1): 303-310.
[10 ] Vezzani A, Baram T Z.New roles for interlukin-1beta in the mechanisms of epilepsy[ J].Epilepsy Cur, 2007, 7 ( 2 ):45-50.
[11 ] Patel H C, Boutin H, Allan SM.Interleukin-1 in the brain:mechanisms of action in acute neurodegeneration[ J].Ann N Y Acad Sci, 2003, 992: 39-47.
[12 ] Devinsky O, VezzaniA, Najjar S , etal.Glia and epilepsy:excitability and inflamation [ J] .Trends Neurosci, 2013, 36(3): 174-184.
[13 ] Clasadonet J, Haydon PG.Astrocytes and epilepsy[ J] .Epilepsia , 2010, 51( Suppl5) : 53.
[14 ] Pitkänen A, Lukasiuk K.Mechanisms of epileptogenesis and potential treatment targets[ J] .Lancet Neurol, 2011, 10( 2 ):173-186.
[15] 赵艳红, 阮金秀.牛黄及其代用品的药理作用及临床应用[J].军事医学科学院院刊, 2007, 31(2): 175-178.
[16] 陈 燕, 赵 辉, 谢 锐.大黄的药理及临床研究近况[J], 西南国防医药, 2005, 15(2): 178-180.
Neuroprotective effect of Xiaoer Niuhuang Qingxin Pow der on brain injury of pentylenetetrazole-induced seizure in developing rats
LIWen-juan, JIANG Li*, CHEN Heng-sheng, CHEN Xiao-lu
(Ministry of Education Key Laboratory of Child Development and Disorders, Key Laboratory of Pediatrics in Chongqing, Chongqing International Scienceand Technology Cooperation Center for Child Development and Disorders, Children’ s Hopital of Chongqing Medical University, Chongqing 400014, China)
AIM To study the neuroprotective effect of Xiaoer Niuhuang Qingxin Powder on brain injury of pentylenetetrazole-induced seizure.METHODS Juvenile Sprague-Dawley rats aged twenty one dayswere equally randomized into five groups, the normal group, model group, high-dose, middle-dose, and low-dose of Xiaoer Niuhuang Qingxins Powder group, which were given orally with saline and Xiaoer Niuhuang Qingxin Powder, respectively,except for the normal group, for one day.After the injection of pentylenetetrazole,rats in all groups were sacrificed in proper times for the pathological inspection of brain tissues.The expressions of IL-1 βand glial fibrillary acidic protein (GFAP) in the cortex and CA1 region of the hippocampuswere also observed and neuron apoptosis were examined by TUNEL assay.RESULTS No significant difference was observed between the highdose group and the normal group in the expressions of IL-1 βand GFAP and the apoptotic index, but thar in the middle-dose group were higher than these of the normal group and lower than these of the model group ( P<0.05) .No significant difference were observed between the low-dose and the model group in them.CONCLUSION Xiaoer Niuhuang Qingxin Powder can protect the rat immature brain from the seizures injury caused by pentylenetetrazole in dose dependentmanner.
Xiaoer Niuhuang Qingxin Powder; pentylenetetrazole; convulsions; brain injury;neuroprotection, immature rat
R285.5
: A
: 1001-1528(2014)05-0892-06
10.3969/j.issn.1001-1528.2014.05.002
2013-08-18
李文娟 (1987—) , 女, 硕士生, 研究方向: 未成熟脑惊厥性脑损伤与脑保护作用。 Tel: 13983467430, E-mail: 627775752 @qq.com
*通信作者: 蒋 莉 (1964—) , 女, 教授, 研究方向: 小儿神经系统疾病基础与临床。 Tel: (023 ) 63621892, E-mail: dr_jiangli@ 126.com

