不同产地栽培与野生丹参药材品质评价
宋 嬿, 赵志刚, 郜舒蕊
(1.上海华宇药业有限公司,上海 200002; 2.北京中医药大学 中药学院, 北京 100102)
[饮片炮制]
不同产地栽培与野生丹参药材品质评价
宋 嬿1, 赵志刚2, 郜舒蕊2
(1.上海华宇药业有限公司,上海 200002; 2.北京中医药大学 中药学院, 北京 100102)
目的 对丹参主产区不同产地栽培与野生丹参从活性成分含有量角度进行品质评价。方法 采用高效液相色谱法对丹参中迷迭 香 酸、 丹 酚酸 B、 隐 丹 参 酮 及 丹 参 酮 ⅡA的 含 有 量 进 行 测 定 分 析。 Wondasil C18色 谱 柱 ( 4.6 mm× 250mm, 5 μm), 甲醇-0.01%磷酸水为流动相, 梯度洗脱, 体积流量 1.0mL/min; 检测波长分别为 268 nm、 286 nm。结果 栽培丹参中迷迭香酸、 丹酚酸 B、 隐丹参酮及丹参酮ⅡA的含有量范围分别为 0.23% ~0.80%、 7.63% ~13.93%、 0.02% ~0.23%、 0.08% ~0.30%, 野生丹参上述 4 种成分的含有量范围分别为0.54% ~0.94%、 7.95% ~12.25%、 0.03% ~0.20%、 0.12% ~0.29%。 结论 栽培丹参中水溶性成分迷迭香酸、 丹酚酸 B的量多低于野生丹参, 而脂溶性成分隐丹参酮、 丹参酮ⅡA的量却较野生丹参高; 聚类分析结果表明, 多数产地丹参药材栽培种与野生种能够明显区别。
丹参;不同产地;栽培;野生;品质评价;聚类分析
丹参 Salvia miltiorrhiza Bunge为唇形科鼠尾草属多年生草本植物,是历版 《中国药典》 规定的药用丹参的唯一来源,入药部位为其干燥的根及根茎。丹参为临床常用中药,也是国家药品标准收载的 320 多个中成药的重要原料[1]。 上世纪 60 年代之前,丹参以应用野生品为主,随着市场需求的增加,野生资源锐减,因此,各地开始对丹参进行引种栽培,获得成功后,种植面积迅速扩大。目前,市场上已难寻觅野生丹参,而人工栽培品成为商品丹参的主要来源,由于广泛分散的种植没有形成统一规范的标准,导致各地丹参药材质量不均,不同土壤、不同气候环境、不同栽培管理措施、不同加工方法等都是导致丹参药材质量差异的重要因素。探讨栽培与野生丹参质量差异,有助于丹参药材的质量控制,为丹参规范化生产基地的建设以及丹参种质资源的合理利用提供依据。关于栽培丹参与野生丹参的质量研究 已有一些报道[2-8], 本实 验收集了丹参主产区不同产地栽培与野生丹参药材,测定其中水溶性成分迷迭香酸、丹酚酸B及脂溶性成分隐丹参酮、丹参酮ⅡA的量, 并进行了系统聚类分析,旨在对不同产地丹参药材进行品质评价,尝试探讨栽培与野生丹参药材质量的差异,为丹参的规范化生产,保证药材质量均一、稳定提供参考。
1 仪器与试药
1.1 仪器 高效液相色谱仪 (LC-2010AHT, 岛津公司); KQ500DE型数控超声波清洗器 (功率:500W, 昆山市超声仪器有限公司); FW100 型高速万能粉碎机 (北京中兴伟业仪器有限公司);BP211D型电子分析天平 (德国 Sartorius公司)。
1.2 试剂 迷迭香酸对照品 ( 批号: 120925)、丹酚酸 B对照品 (批号:121020)、 隐丹参酮对照品 (批号: 120925)、丹参酮ⅡA对照品 ( 批号:121029), 均购自上海融禾医药科技有限公司, 纯度均大于 98%; 甲醇、 磷酸均为色谱纯 (美国Fisher公司); 水为哇哈哈纯净水; 乙醇及其他试剂均为分析纯 (北京化工厂)。
1.3 药材 不同产地栽培与野生丹参药材为北京中医药大学中药资源课题组提供,经中国医学科学院药用植物研究所王文全教授鉴定为唇形科植物丹参 S.miltiorrhiza Bunge的根及根茎。 样品具体信息见表1。
2 样品测定方法
2.1 供试品溶液的制备 参考北京中医药大学中药资源课题组采用均匀设计法优选出的丹参超声提取工艺条件制备供试品溶液。精密称取丹参药材粉末 (过40 目筛) 约 0.5 g, 置具塞锥形瓶中, 精密加入 75%乙醇 100 mL, 超声提取 10 min (250 W,25 ℃), 放冷, 75%乙醇补足减失的质量, 取上清液用0.45 μm微孔滤膜滤过, 即得。
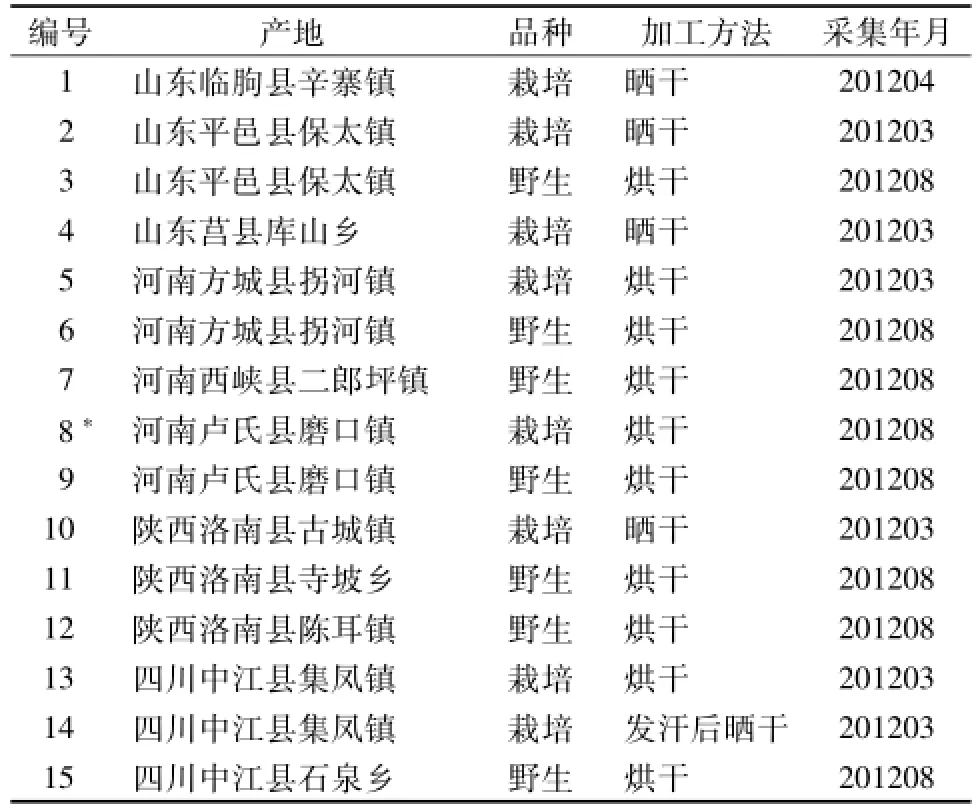
表1 不同产地丹参药材基本信息Tab.1 Basic information of Salviamiltiorrhizae Radix et Rhizoma from different habitats
2.2 色谱条件 参考北京中医药大学中药资源课题组建立的 HPLC同时测定丹参中迷迭香酸、 丹酚酸 B、 隐丹参酮、 丹参酮ⅡA等 4 种活性成分含有量的方法。 具体色谱条件如下: Wondasil C18色谱柱 (4.6 mm×250 mm, 5 μm); 流动相为甲醇(A) -0.01%磷酸水 ( B), 梯度洗脱 (0 ~3 min,30%A; 3 ~5 min, 30% ~40%A; 5 ~3 min,40%A;13 ~20 min,40% ~58%A;20 ~22 min,58% ~75%A; 22 ~24 min, 75%A; 24 ~50 min,75% ~85%A);体积流量 1.0 mL/min; 检测波长286 nm (迷迭香酸和丹酚酸 B) 和 268 nm (隐丹参酮和丹参酮ⅡA); 柱温 30 ℃; 进样体积 10 μL。
进行精密度、稳定性、重复性和加样回收试验等方法学考察,结果均良好。
2.3 样品测定 精密称取不同产地丹参药材 0.5 g,按 “2.1” 项制备供试品溶液, 按 “2.2” 项色谱条件测定,每一样品重复3次。以外标法中的标准曲线法计算丹参样品中各成分含有量。所得结果见表2。
3 结果与分析
3.1 不同产地栽培丹参药材中 4 种活性成分的比较 见表2显示,不同产地栽培丹参药材中4种活性成分的含有量差异较大。药材中迷迭香酸、丹酚酸 B、 隐丹参酮、 丹参酮ⅡA的含有量范围分别为0.23% ~0.80%、 7.63% ~13.93%、 0.02% ~0.23%、 0.08% ~0.30%, 其中隐丹参酮和丹参酮ⅡA变异较大, 最高值与最低值分别相差 10 倍、4倍。 《中国药典》 2010 年版 (以下简称药典) 规定丹参中丹酚酸 B的量不得低于 3.0%, 丹参酮ⅡA的量不得低于 0.2%, 就此标准而言, 所有产地丹参药材的丹酚酸B均达到并远超过药典标准,即使丹酚酸 B的最小含有量也较药典高 1.45 倍;对于丹参酮ⅡA, 除四川中江县未达标准外, 其他产地丹参均达到药典标准,但并未显著高于该标准。总体上看,山东临朐县、河南方城县和卢氏县丹参中4种活性成分的含有量均较高;四川中江县未经 “发汗” 丹参中丹酚酸 B的量最高, 而丹参酮ⅡA的量却非常低, “发汗” 后的丹参与未 “发汗”丹参相比,4种活性成分的量均有不同程度的降低, 该结果与潘英妮等[9]的研究一致。
3.2 不同产地野生丹参药材中 4 种活性成分的比较 表2表明,不同产地野生丹参药材中4种活性成分的含有量差异较大。药材中迷迭香酸、丹酚酸B、 隐丹参酮、 丹参酮ⅡA的含有量范围分别为0.54% ~0.94%、 7.95% ~12.25%、 0.03% ~0.20%、 0.12% ~0.29%, 其中隐丹参酮变异较大,最高值与最低值相差6倍。与栽培丹参相似,所有野生丹参药材中丹酚酸B的量均达到并远超过药典标准, 合格率为 100%; 然而丹参酮ⅡA的量普遍偏低, 合格率仅为 42.86%。 除河南方城县、陕西洛南县寺坡乡和陈耳镇外,其余产地丹参酮ⅡA均未达到药典标准。河南西峡县和四川中江县丹参药材的隐丹参酮量很低,与其他产地相比存在较大差异,较含有量最高的陕西洛南县寺坡乡分别低 85.00%和 70.00%。
3.3 不同产地栽培与野生丹参药材聚类分析 本实验以不同产地丹参药材中的迷迭香酸、丹酚酸B、 隐丹参酮、 丹参酮ⅡA的含有量及丹酚酸 B与丹参酮ⅡA的比值为考察指标, 对所得分析数据采用极差法 (Range-1to1) 进行标准化处理, 原始数据经标准化变换后,采用欧氏距离平方法( squared Euclidean distance) 计算样 品 间相似性程度, 选用中间距离法 ( median clustering) 进行聚类。 系统聚类分析结果见图1。
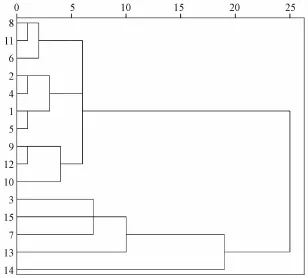
图1 不同产地丹参药材系统聚类结果图Fig.1 Clustering dendrogram of Salviam iltiorrhizae Radix et Rhizoma from different habitats
聚类结果显示,多数产地的丹参药材栽培种与野生种能够明显区别开来,如河南卢氏县、方城县及山东平邑县,且山东3个产地的栽培丹参及河南方城县栽培丹参被聚为一类,说明这几个产地丹参活性成分整体差异不明显;四川中江县栽培丹参(未 “发汗”) 与野生丹参被聚为一类, 而经过“发汗” 加工的栽培丹参却被单独聚为一类, 可见加工方法对丹参药材的活性成分影响较大。
4 讨论
不同产地丹参药材,无论栽培品还是野生品,4种活性成分的含有量均存在较大差异,这一结果与许多报道[7,9-10]一 致。 付 桂 芳 等[11]从 药 材 性 状、显微组织方面对不同产地丹参野生品与栽培品进行了比较,也发现存在较大差异。药用植物的生长受遗传因素 和 环 境 因 素 的 双 重 影 响[12-14], 其活 性 成分多为植物的次生代谢产物,在植物体内的积累很大程度上受生长环境各因素的直接或间接影响。丹参的生态适应性强,在我国许多地区均有分布,而不同产地环境因子如:气候、土壤、地形、伴生生物因素等有较大差异,这势必会对丹参的生长及药材品质造成影响。笔者在丹参种质资源调查过程中发现,野生丹参与栽培丹参所处的生长环境迥异,野生者多生于林下,阳光遮蔽,植株生长矮小,地上茎分枝少,根条细长;而栽培丹参则生长在阳光充足、土壤肥沃的丘陵或平原地区,植株高大,地上茎分枝多,根条粗。因此,对于丹参等药用植物(不论野生品种还是栽培品种) 而言,生境与药材质量的关系值得研究,这对于改善栽培药材的品质具有重要的实际意义。
从整体上看,野生丹参中水溶性成分迷迭香酸、丹酚酸B的量普遍高,而栽培丹参中脂溶性成分隐丹参酮、 丹参酮ⅡA的量普遍高。 不同产地丹参药材中丹酚酸B的量均符合药典规定,并远超过其标准; 对于丹参酮ⅡA, 栽培品尚能达到药典标准,而野生品却多数不达标。中药是一个复杂体系,多成分、多靶点是其发挥药效、治疗疾病的作用机制,丹参药材质量的优劣不能仅凭几种活性成分的量即下定论, 并且文献报道, 丹参酮ⅡA具有一定的细胞毒性,可使细胞壁剥离,并对人的细胞色素 P4501A2 活性有强的阻制作用, 影响药物在体内的代谢[9]。传统认为野生丹参药材的疗效优于栽培品,而野生品丹参酮类成分的量较低,酚酸类成分的量较高的特点是否是其质量和疗效的关键所在,这一点还需进一步研究,并辅以其他手段,如药理学、毒理学、药效学等进行综合评价。
[ 1 ] 肖 禾, 宋民宪.中成药中丹参入药情况的统计分析[J].华西药学杂志, 2005, 20(3): 279-280.
[2] 黄秀兰,陈恩鸿,王长根,等.野生与栽培丹参的质量研究[ J].中药材, 1989, 12(6) : 31-34.
[ 3 ] 徐 波.野生与栽培丹参隐丹参酮含量测定[J].基层中药杂志, 1996: 10(2): 35.
[4] 陈 幸,黎万寿,夏文娟,等.四川中江丹参与其他产地丹参化学成分的比较研究[J].中国中药杂志, 1997, 22(9): 522-524.
[5] 胡 华, 马凤彩,王 瑾.不同生长条件下丹参的质量比较研究[J].解放军药学学报, 2003, 19(3): 219-220.
[6] 齐永秀,曹明亮,王晓丹,等.泰山野生丹参与种植丹参根、 茎、 叶三种有效成分含量的分析比较[J].药物生物技术杂志, 2006, 13(4): 279-282.
[7] 代云桃,秦雪梅,郭小青,等.不同产地不同品种丹参药材内在质量评价[J].山西医科大学学报, 2006, 37(7):716-719.
[8] 王凤玲,刘炳芬,毕丽风,等.栽培与野生丹参质量的对比研究[J].中国误诊学杂志, 2007, 7(11): 2519-2520.
[9] 潘英妮,袁 丹,郑 成,等.国产丹参药材质量评价研究[ J].中国药学杂志, 2007, 42(18) : 1368-1372.
[10] 潘雪梅, 韦 辉, 刘 毅, 等.不同产地丹参药材质量研究[ J].中草药, 2011, 42 (9) : 1833-1836.
[11] 付桂芳, 冯学锋, 格小光, 等.丹参栽培品、 野生品及不同产地药材性状显微组织差异比较[J].中国中药杂志,2010, 35(10): 1235-1238.
[12] 孙洪利, 刘喜芹, 姚素娟.浅谈遗传变异与生态环境对中药物种的影响[J].中医药信息, 1993, 10(4): 43.
[13] 曹海禄, 曹国番, 魏建和, 等.遗传和环境因子对药用植物品质的影响[ J] .中草药, 2007, 38(5) : 785-788.
[14] 于福来, 王文全, 侯俊玲, 等.种质与环境对二年生甘草群体主要生物活性成分的影响[J].中国中药杂志, 2013,38(10): 1479-1483.
Quality evaluation of the cultivated and thew ild Salviam iltiorrhizae Radix et Rhizoma from different habitats
SONG Yan1, ZHAO Zhi-gang2, GAO Shu-rui2
(1.Shanghai Hua Yu Chinese Herbs Co., Ltd, Shanghai200002, China; 2.School of Chinese Pharmacy, Beijing University of ChineseMedicine, Beijing 100102, China)
AIM To evaluate the quality of the cultivated and the wild Salvia miltiorrhizae Radix et Rhizoma from different habitats in perspective of active contents.METHODS HPLC of the contents of rosmarinic acid,salvianolic acid B, crytotanshinone and tanshinoneⅡAwas performed on WondasilC18column (4.6mm×250mm,5 μm) at the wavelength of 268 nm and 286 nm, a mixed liquid ofmethanol-0.01%phosphoric acid asmobile phase in a gradient elution mode, the flow-rate was 1.0 m L/min.RESULTS In cultivated Salvia miltiorrhizae Radix et Rhizoma, the content ranges of rosmarinic acid, salvianolic acid B, crytotanshinone and tanshinoneⅡAfellwithin 0.23%-0.80%, 7.63%-13.93%, 0.02%-0.23%, and 0.08%-0.30%, respectively, however, in wild Salvia miltiorrhizae Radix et Rhizome, in the ranges of 0.54%-0.94%, 7.95%-12.25%, 0.03% -0.20%, and 0.12%-0.29%, respectively.CONCLUSION The contents ofwater-soluble constituents such as rosmarinic acid and salvianolic acid B in cultivated Salviamiltiorrhizae Radix et Rhizoma are lower than these in the wild samples, but lipophilic constituents such as crytotanshinone and tanshinoneⅡAare higher than these in the wild samples.Cluster analysis results indicate that thewild Salvia miltiorrhizae Radix et Rhizoma and the cultivated Salvia miltiorrhizae Radix et Rhizoma could be distinguished easily in most habitats.
Salvia miltiorrhizae Radix et Rhizoma; different habitats; cultivated; wild;quality evaluation;cluster analysis
R284.1
: A
: 1001-1528(2014)05-1026-04
10.3969/j.issn.1001-1528.2014.05.030
2013-11-13
国家工业与信息化部中药材生产扶持项目 (2011 年)
宋 嬿 (1970—) , 女, 高级工程师, 从事中药材资源和质量研究。 Tel: 13801653370, E-mail: hysongyan@126.com

