丁沉透膈丸中和厚朴酚、厚朴酚、白术内酯Ⅰ、白术内酯Ⅲ和儿茶素的测定
高 伟, 朱叶珊, 蔡春江, 司雁菱
(1.唐山工人医院, 河北 唐山 063000; 2.河北唐山中医院, 河北 唐山 063000)
丁沉透膈丸中和厚朴酚、厚朴酚、白术内酯Ⅰ、白术内酯Ⅲ和儿茶素的测定
高 伟1, 朱叶珊2, 蔡春江2, 司雁菱1
(1.唐山工人医院, 河北 唐山 063000; 2.河北唐山中医院, 河北 唐山 063000)
目的 采用 HPLC法测定丁沉透膈丸 (厚朴、 白术、 丁香、 沉香、 木香、 香附、 砂仁、 草豆蔻、 陈皮、 麦芽、广藿香、青皮、法半夏、云曲、茯苓、甘草)中和厚朴酚、厚朴酚、白术内酯Ⅰ、白术内酯Ⅲ和儿茶素的量。方法Hypersil C18色谱柱 (4.6 mm×200 mm, 5 μm) ; 体积流量 0.7 mL/min。 和厚朴酚与厚朴酚的测定以乙腈为流动相 A,流动相 B为 2%冰醋酸溶液 (V/V), 检测波长 294 nm; 白术内酯Ⅰ和白术内酯Ⅲ的测定以甲醇-乙腈 (1 ∶1) 为流动相 A, 流动相 B为 0.1%磷酸水溶液, 检测波长 220 nm; 儿茶素的测定以甲醇-0.5%冰醋酸溶液 (26 ∶74) 为流动相,检测波长 278 nm。 结果 和厚朴酚与厚朴酚分别在 0.032 4 ~0.648 0 μg(r=0.999 6)、 0.021 8 ~0.436 0 μg(r= 0.999 8) 范围内进样量与峰面积呈良好的线性关系, 平均加样回收率分别为 99.17%、 99.29%, RSD (n=9) 分别为 0.84%、 1.04%; 白术内酯Ⅰ和白术内酯Ⅲ分别在 0.006 8 ~0.136 0 μg(r=0.999 4)、 0.010 2 ~0.204 0 μg(r= 0.999 3) 范围内进样量与峰面积呈良好的线性关系, 平均加样回收率分别为 99.02%、 99.15%, RSD (n=9) 分别为 0.69%、 0.75%; 儿茶素在 0.004 6 ~0.092 0 μg(r=0.999 8) 进样量与峰面积线性关系良好, 平均加样回收率为99.30%, RSD(n=9) 为 0.69%。 结论 该测定方法结果准确、 灵敏度高、 重复性好。
丁沉透膈丸; 和厚朴酚; 厚朴酚; 白术内酯Ⅰ; 白术内酯Ⅲ; 儿茶素; HPLC
丁沉透膈丸为中药复方制剂,处方源于卫生部药品标准中药成方制剂第十三册,由厚朴 (姜炙)、 白术、 丁香、 沉香、 木香、 香附 (醋炙)、砂仁 (盐炙)、草豆蔻、 陈皮、麦芽 (炒)、 广藿香、 青皮 (醋炙)、 法半夏 (醋炙)、 云曲 (炒)、茯苓、甘草十六味药物组成。具有健脾和胃、行气消胀之功效,可用于胃脘疼痛、气郁结滞、胸膈痞闷、嗳气吐酸、消化不良等症的治疗。原质量标准仅对性状进行了控制,未对方中的任何药味进行定性鉴别或定量 测定[1-2]。 为保证 产品质 量, 确保临床疗效, 本实验采用 HPLC法对厚朴中和厚朴酚、厚朴酚和白术中白术内酯Ⅰ、白术内酯Ⅲ以及砂仁中的儿茶素进行测定,为完善该制剂质量标准提供依据,以有效控制产品的内在质量,确保人民用药安全有效。此法准确、方便、可靠、快速。
1 材料
日本岛津 LC-10ATVP型高效液相色谱仪; 岛津自动进样器 SIL-10ADVP;ANASTAR色谱数据工作站; SPD-1OAVP紫外可见检测器; 和厚朴酚对照品 (110730-200307)、 厚朴酚对照品 (110729-200412)、 儿茶素对照品 (110730-200307, 纯度为97.2%) 购于中国食品药品检定研究院; 白术内酯Ⅰ对照品 (73069-13-3,纯度为 98.0%) 和白术内酯Ⅲ对照品 (73030-71-4, 纯度为 98.0%) 购于上海同田生物技术股份有限公司;丁沉透膈丸(每袋装 10 g; 批号为 130910, 130912, 130915)自制;甲醇、乙腈 (色谱纯,湖北杜克化学科技有限公司);冰醋酸 (色谱纯, 天津市科密欧化学试剂有限公司); 磷酸 (分析纯, 廊坊鹏彩精细化工有限公司)。
2 方法与结果
2.1 和厚朴酚与厚朴酚的定量分析[3-12]
2.1.1 色谱条件及系统适应性 Hypersil C18色谱柱 (4.6 mm×200 mm, 5 μm); 流动相 A为乙腈,流动相 B为 2% 冰醋酸溶液 ( V/V), 梯度洗脱(0 ~8 min, 37.0%A; 9 ~27 min, 37.0%→65.0% A; 28 ~35 min, 65.0%A); 检测波长 294 nm; 体积流量 0.7 mL/min。 在此条件下和厚朴酚和厚朴酚与其他组分分离效果良好,以厚朴酚计理论塔板数应不低于 3 000。
2.1.2 检测波长的选择 分别取和厚朴酚对照品与厚朴酚对照品适量,加 65%甲醇溶解制成每1 m L含 30 μg的溶液, 在 200 ~400 nm波长处进行紫外扫描,结果和厚朴酚对照品在 292 nm处有最大吸收, 厚朴酚对照品在 294 nm处有最大吸收,参照 《中国药典》 2010 年版一部厚朴药材检验项,将检测波长定为 294 nm。
2.1.3 对照品混合溶液的制备 精密称取和厚朴酚对照品和厚朴酚对照品各适量, 加 65%甲醇制成对照品混合溶液 (和厚朴酚为 0.032 4 mg/mL,厚朴酚为 0.021 8 mg/m L)。
2.1.4 供试品溶液的配制 取本品适量,研细,取约1.0 g, 精密称定, 置 50 mL量瓶中, 精密加入 65% 甲 醇 50 mL, 称 定 质 量, 超 声 处 理(300 W, 20 kHz) 20 min, 用 65%甲醇补足减失的质量,摇匀,过滤,取续滤液作为供试品溶液。
2.1.5 阴性对照溶液的配制 按丁沉透膈丸处方比例称取适量除厚朴的其余药味,按丁沉透膈丸的生产工艺制成缺厚朴的阴性样品,按照上述供试品溶液的配制方法制成缺厚朴的阴性对照溶液。
2.1.6 线性关系考察 精密吸取对照品混合溶液1、 5、 10、 15、 20 μL, 按上述色谱条件进行测定,以峰面积积分值为纵坐标,和厚朴酚、厚朴酚量为横坐标分别绘制标准曲线,得回归方程。和厚朴酚为 Y=5.236 4 ×106X-368.9,r=0.999 6; 厚朴酚为 Y=3.698 1 ×106X+619.2, r=0.999 8。 结果表明和厚朴酚在 0.032 4 ~0.648 0 μg范围内进样量与峰面积线性关系良好;厚朴酚在 0.021 8 ~0.436 0 μg范围内进样量与峰面积线性关系良好。
2.1.7 阴性对照试验 分别精密吸取 10 μL的供试品溶液、对照品溶液及阴性对照溶液,按上述色谱条件进行色谱分析,结果供试品溶液色谱中,在与和厚朴酚对照品与厚朴酚对照品相同保留时间处有吸收峰,而阴性对照溶液在相同保留时间处未显吸收峰, 结果见图1。
2.1.8 精密度试验 取对照品混合溶液重复进样6 次, 按 “2.1.1” 项的色谱条件测定和厚朴酚与厚朴酚的峰面积, 和厚朴酚的 RSD为 0.73%, 厚朴酚的 RSD为 0.42%, 结果表明, 仪器具有良好的精密度。
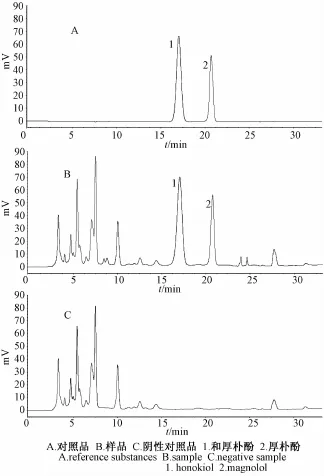
图1 和厚朴酚与厚朴酚的 HPLC色谱图Fig.1 HPLC chromatogram s of honokiol and magnolol
2.1.9 重复性试验 取同一批样品, 按上述方法制备6 份供试品溶液, 分别测定, 和厚朴酚的 RSD为 0.57%, 厚朴酚的 RSD为 0.78%。 结果表明本方法具有良好的重复性。
2.1.10 稳定性试验 取同一供试品溶液, 在放置 0、 1、 2、 4、 6、 8 h 后精密吸取 10 μL进样,测定其峰面积值, 和厚朴酚的 RSD为 0.44%,厚朴酚的 RSD为 0.53%, 供试品溶液 8 h 内基本稳定。
2.1.11 加样回收率试验 取已知含有量 (和厚朴酚 1.56 mg/g、 厚朴酚 1.12 mg/g) 的同一批样品适量, 研细, 称取 9 份, 每份 0.5g, 精密称定, 置 50 m L具塞锥形瓶中, 精密加入对照品混合溶液 20 m L、 25 m L、 30 m L各 3 份 (相当于样品量的 80%、 100%和 120%), 分别加65%甲醇至刻度 (50 m L), 按照 “2.1.3” 项下供试品溶液制备方法制成加样供试液。精密吸取加样供试液 10 μL, 按上述测定方法测定其峰面积,计算回收率,结果表明本方法回收率良好,见表1。
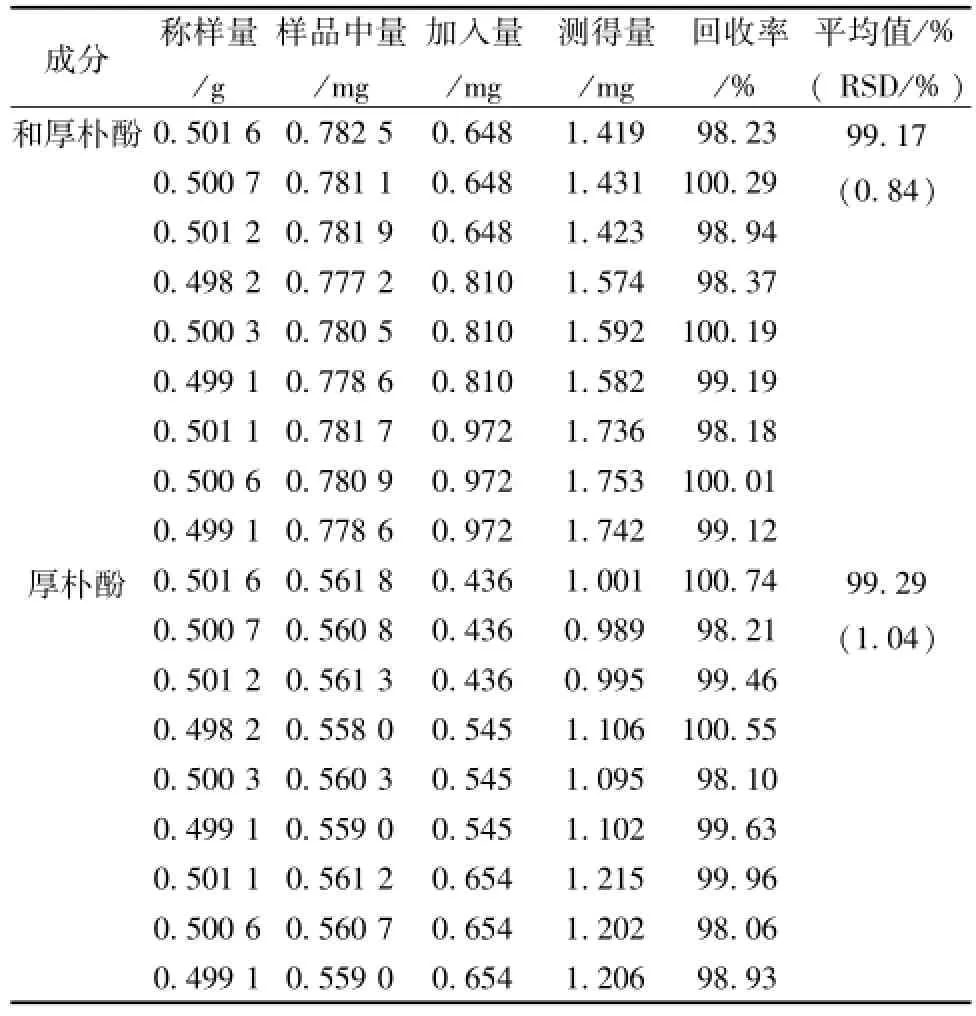
表1 和厚朴酚和厚朴酚回收率试验结果Tab.1 Results of recovery tests for honokiol and magnolol
2.2 白术内酯Ⅰ和白术内酯Ⅲ的定量分析[13-20]
2.2.1 色谱条件及系统适应性 Hypersil C18色谱柱 (4.6 mm×200 mm, 5 μm); 流动相 A为甲醇-乙腈 (1 ∶1), 流动相 B为 0.1%磷酸水溶液, 梯度 洗 脱 ( 0 ~24 min,40.0%A; 25 ~42 min,40.0%→62.0%A; 43 ~50 min, 62.0%A);体积流量 0.7 mL/min;检测波长 220 nm。在此条件下白术内酯Ⅰ和白术内酯Ⅲ与其他组分基线分离良好, 以白术内酯Ⅲ计理论塔板数应不低于 2 800。
2.2.2 检测波长的选择 分别取白术内酯Ⅰ和白术内酯Ⅲ对照品适量, 加甲醇-乙腈 (1 ∶1) 溶解制成每 1 m L含 0.06 mg的溶液, 按紫外-可见分光光度法在 150 ~300 nm波长处进行紫外扫描, 结果白术内酯Ⅰ和白术内酯Ⅲ对照品均在 220 nm处有最大吸收, 故检测波长定为 220 nm。
2.2.3 对照品混合溶液的制备 精密称取白术内酯Ⅰ和白术内酯Ⅲ对照品适量, 置50 mL量瓶中,加甲醇-乙腈 (1 ∶1) 溶解后稀释至刻度, 摇匀,即得对照品混合溶液 (白术内酯Ⅰ为0.006 8 mg/mL和白术内酯Ⅲ 0.010 2 mg/mL)。
2.2.4 供试品溶液的制备 取本品适量,研细,取约5.0 g, 精密称定, 置 50 mL量瓶中, 精密加入甲醇-乙腈 (1 ∶1) 50 mL, 称定质量,超声处理(250W, 30 kHz)25 min,用甲醇-乙腈 (1 ∶1)补足减失的质量,摇匀,过滤,取续滤液作为供试品溶液。
2.2.5 阴性对照溶液的制备 按丁沉透膈丸处方比例称取适量除白术的其余药味,按丁沉透膈丸的生产工艺制成缺白术的阴性样品,按照上述供试品溶液的配制方法制成缺白术的阴性对照溶液。
2.2.6 线性关系考察 分别精密吸取对照品混合溶液 1、 5、 10、 15、 20 μL, 按 “2.2.1” 项下的色谱条件进行梯度洗脱,以峰面积积分值为纵坐标,白术内酯Ⅰ、白术内酯Ⅲ量为横坐标分别绘制标准曲线, 白术内酯Ⅰ回归方程为 Y=3.165 7 × 106X-351.0, r=0.999 4; 白 术 内酯 Ⅲ 为 Y= 2.537 8 ×106X+635.1, r=0.999 3。 结果表明白术内酯Ⅰ在 0.006 8 ~0.136 0 μg范围内进样量与峰面积线性关系良好; 白术内酯Ⅲ在 0.010 2 ~0.204 0 μg范围内进样量与峰面积线性关系良好。
2.2.7 阴性对照试验 分别精密吸取 10 μL的供试品溶液、对照品溶液及阴性对照溶液,按“2.2.1” 项的色谱条件进行色谱分析, 结果供试品溶液色谱中,在与白术内酯Ⅰ和白术内酯Ⅲ对照品相同保留时间处有吸收峰,而阴性对照溶液在相同保留时间处未显吸收峰,见图2。
2.2.8 稳定性试验 取同一供试品溶液, 在放置0、 1、 2、 4、 6、 8 h 后精密吸取10 μL进样, 测定其峰面积值,RSD分别为 0.98% (白术内酯Ⅰ)、0.81% (白术内酯Ⅲ)。 结果表明,供试品溶液 8 h内基本稳定。
2.2.9 精密度试验 取对照品混合溶液重复进样6 次, 按 “2.2.1”项的色谱条件测定白术内酯Ⅰ和白术内酯Ⅲ的峰面积,结果表明,仪器具有良好的精密度, RSD分别为 0.66% (白术内酯Ⅰ)、0.49% (白术内酯Ⅲ)。
2.2.10 重复性试验 取同一批样品,按上述方法制备 6 份供试品溶液, 分别测定, RSD分别为0.52% (白术内酯Ⅰ)、 0.63% ( 白术内酯Ⅲ)。结果表明本方法具有良好的重复性。
2.2.11 加样回收率试验 取已知含有量 (白术内酯Ⅰ0.069mg/g、 白术内酯Ⅲ 0.103 mg/g) 的同一批样品适量, 研细, 称取 9 份, 每份 2.5 g, 精密称定, 置50 mL具塞锥形瓶中, 精密加入对照品混合溶液 20 mL、25mL、30mL各 3 份 (相当于样品量的 80%、100%和 120%), 分别加甲醇-乙腈 (1 ∶1) 至刻度 (50 mL), 按照上述 “2.2.3” 项下供试品溶液制备方法制成加样供试液。精密吸取加样供试液10 μL, 按上述方法测定其峰面积, 计算回收率,结果表明本方法回收率良好,见表2。

图2 白术内酯Ⅰ和白术内酯Ⅲ的 HPLC色谱图Fig.2 HPLC chromatogram s of atractylenolide-I and atractylenolide-Ⅲ

表2 白术内酯Ⅰ和白术内酯Ⅲ回收率试验结果Tab.2 Results of recovery tests for tractylenolide-I and atractylenolide-Ⅲ
2.3 儿茶素的测定[21-23]
2.3.1 色谱条件及系统适应性 Hypersil C18色谱柱 (4.6 mm×200 mm, 5 μm); 甲醇 -0.5%冰醋酸溶液 (26 ∶74) 为流动相, 检测波长 278 nm,体积流量为 0.7 mL/min。 在此条件下儿茶素与其他组分分离效果良好,以儿茶素计理论塔板数应不低于2 000。
2.3.2 对照品溶液的制备 精密称取儿茶素对照品适量, 加甲醇制成含儿茶素 0.004 6 mg/mL的对照品溶液。
2.3.3 供试品溶液的配制 取本品适量,研细,取约4.0 g, 精密称定, 置 50 mL量瓶中, 精密加入甲醇 50 m L, 称定质量, 超声处理 (250 W,30 kHz) 30 min, 用甲醇补足减失的质量, 摇匀,过滤,取续滤液作为供试品溶液。
2.3.4 阴性对照溶液的配制 按丁沉透膈丸处方比例称取适量除砂仁的其余药味,按丁沉透膈丸的前处理和制剂生产工艺制成缺砂仁的阴性样品,按照上述供试品溶液的配制方法制成缺砂仁的阴性对照溶液。
2.3.5 线性关系考察 精密吸取对照品溶液 1、5、 10、 15、 20 μL, 按上述色谱条件进行测定, 以峰面积积分值为纵坐标,儿茶素量为横坐标分别绘制标准曲线,计算回归方程: Y=2.364 7 ×106X+ 268.5, r=0.999 8。 结果表明儿茶素在 0.004 6 ~0.092 0 μg范围内进样量与峰面积线性关系良好。
2.3.6 阴性对照试验 分别精密吸取 10 μL的对照品溶液、供试品溶液及阴性对照溶液,按“2.3.1” 项下的色谱条件进行色谱分析, 结果供试品溶液色谱中,在与儿茶素对照品相同保留时间处有吸收峰,而阴性对照溶液在相同保留时间处未显吸收峰,见图3。
2.3.7 精密度试验 取对照品溶液重复进样 6 次,按 “2.3.1” 项下的色谱条件测定儿茶素的峰面积, 儿茶素 RSD为0.58%, 表明仪器精密度良好。
2.3.8 重复性试验 取同一批样品, 按上述方法制备6 份供试品溶液, 分别测定, 结果儿茶素 RSD为 0.73%。 结果表明本方法具有良好的重复性。
2.3.9 稳定性试验 取同一供试品溶液, 在放置0、 1、 2、 4、 6、8 h 后精密吸取10 μL进样, 测定其峰面积值, 儿茶素 RSD为 0.91%, 供试品溶液8 h内基本稳定。
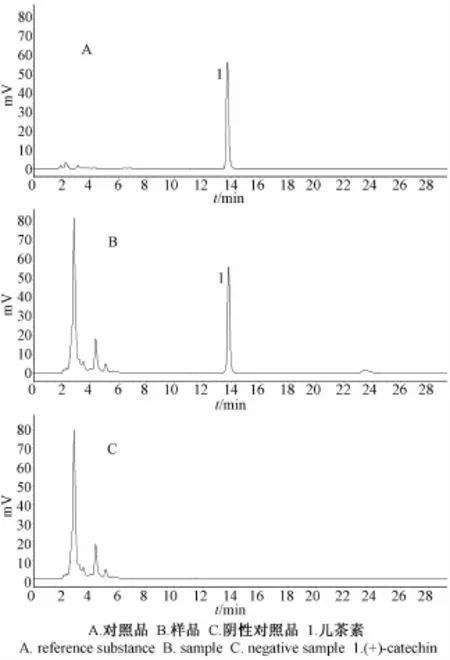
图3 儿茶素的 HPLC色谱图Fig.3 HPLC chromatograms of( +) -catechin determ ination
2.3.10 加样回收率试验 取已知含有量 (儿茶素 0.056mg/g) 的同一批样品适量, 研成细粉, 称取 9 份,每份 2.0 g, 精密称定, 置 50 mL具塞锥形瓶中, 精密加入对照品溶液 20、 25、 30 m L各 3份 (相当于样品量的80%、 100%和120%), 分别加甲醇至刻度 (50 mL),按照上述 “2.3.3” 项下供试品溶液制备方法制成加样供试液。精密吸取加样供试液 10 μL, 按上述方法测定其峰面积, 计算回收率, 结果表明本方法回收率良好, 见表3。

表3 儿茶素回收率试验结果Tab.3 Results of recovery tests for( +) -catechin
2.4 样品测定 取 3 批样品按 “2.1”项、 “2.2”项和 “2.3” 项下方法测定, 结果见表4。
表4 样品测定结果 (, n=3)Tab.4 Results of conten t determ ination(, n=3)
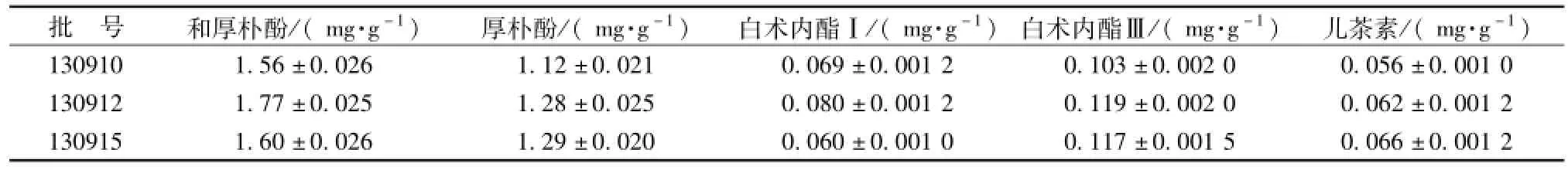
表4 样品测定结果 (, n=3)Tab.4 Results of conten t determ ination(, n=3)
批 号 和厚 朴酚 /( mg·g-1) 厚 朴酚 /( mg·g-1) 白术内 酯Ⅰ /( mg·g-1) 白 术内酯 Ⅲ /( mg·g-1) 儿茶 素 /( mg·g-1)130910 1.56 ±0.026 1.12 ±0.021 0.069 ±0.001 2 0.103 ±0.002 0 0.056 ±0.001 0 130912 1.77 ±0.025 1.28 ±0.025 0.080 ±0.001 2 0.119 ±0.002 0 0.062 ±0.001 2 130915 1.60 ±0.026 1.29 ±0.020 0.060 ±0.001 0 0.117 ±0.001 5 0.066 ±0.001 2
3 讨论
3.1 和厚朴酚与厚朴酚测定时分别以乙腈-0.1%磷酸水溶液、甲醇-0.1%磷酸水溶液、 乙腈-2%冰醋酸溶液为流动相不同比例进行梯度洗脱。结果乙腈-0.1%磷酸水溶液为流动相梯度洗脱时两成分分离效果不好,未达到基线分离;甲醇-0.1%磷酸水溶液为流动相梯度洗脱时和厚朴酚与其他色谱峰能达到基线分离但厚朴酚与其他色谱峰不能达到基线分离。 而乙腈-2%冰醋酸溶液为流动相按照本实验中比例梯度洗脱时和厚朴酚、厚朴酚与其他色谱峰均能达到基线分离。 故选用乙腈-2%冰醋酸溶液按照本实验中比例为流动相进行梯度洗脱。
3.2 白术内酯Ⅰ和白术内酯Ⅲ测定时, 供试品制备提取时间分别采用超声 (250 W, 30 kHz) 15 min、 25 min、 35 min 进行处理, 以确定最佳提取时间。 结果超声 15 min 明显低于超声 25 min 和 35 min, 超声 25 min 和超声 35 min 差异不大, 故选择超声 (250W,30 kHz) 25 min 作为供试品制备的提取时间。
[ 1 ] 国家药典委员会.中华人民共和国药典: 2010 年版一部[S].北京: 中国医药科 技出版社, 2010: 95-96, 235,附录 30, 附录 36.
[2] 国家药典委员会.国家药品标准中药成方制剂第十三册[S].北京: 人民卫生出版社, 1998: 7.
[ 3 ] 陈玉秀.HPLC测定整肠正气丸中和厚朴酚及厚朴酚的含量[ J].中国现代中药, 2013, 15(5) : 410-412.
[4] 苏 伟.高效液相色谱法测定半夏厚朴汤不同煎液中和厚朴酚含量 [ J].中国保健 营养: 下旬刊, 2013, 23 (3 ):1460-1460.
[ 5 ] 张赫名.HPLC法测定香砂养胃丸 (浓缩丸) 中厚朴酚、和厚朴酚的含量[J].医药前沿, 2013(2): 295-296.
[6] 王 东,蔡佳良,郭丽冰,等.不同灭菌方法对保济丸及厚朴有效成分的影响[J].时珍国医国药, 2013, 24(6):1415-1416.
[7] 刘 霞,唐骁爽,汪永强,等.制备型高效液相色谱法制备和厚 朴 酚与 厚 朴 酚 [ J].中 成 药, 2010, 32 (11 ):2006-2008.
[ 8 ] 郑晓英, 黄 威, 周子平.RP-HPLC法测定开胸顺气丸中厚朴酚与和厚朴酚的含量 [ J].中成药, 2003, 25 (8 ):683-684.
[9] 刘晓鹏,姜 宁,向东山,等.厚朴叶中厚朴酚及和厚朴酚的提取与测定[J].中国医院药学杂志, 2007, 27(5):694-696.
[10] 邢俊波, 贾恒明.HPLC法测定养胃软胶囊中厚朴酚、 和厚朴酚的含量[ J].中国中医药信息杂志, 2008, 15(1):55-56.
[11] 刘 翔.HPLC法测定麻仁丸中厚朴酚、 和厚朴酚、 大黄素和大黄酚[J].中草药, 2010, 41(4): 582-583.
[12] 唐 倩, 石 珊, 赵云丽, 等.HPLC法测定厚朴温中汤中山姜素、 和厚朴酚、 小豆蔻明和厚朴酚[J].中草药,2009, 40(10): 1581-1583.
[13] 李鸿翔, 彭 腾, 邓 赟, 等.HPLC测定不同产地白术水煎液中的白术内酯Ⅲ[J].华西药学杂志, 2013, 28(2): 197-198.
[14] 张英丰, 朱黎霞, 梁东辉, 等.HPLC同时测定黄芪白术药对提取物毛蕊异黄酮苷、白术内酯Ⅰ、白术内酯Ⅲ含量[J].中国实验方剂学杂志, 2012, 18(9): 86-89.
[15] 刘玉强, 才 谦.50 批不同来源白术药材及饮片中白术内酯Ⅰ和白术内酯Ⅲ含量的 HPLC法测定[J].药物分析杂志, 2012, 32(7): 1249-1252.
[16] 祁银涛, 杨 杰, 李建娟, 等.白术药材质量标准研究[J].时珍国医国药, 2012, 23(5): 1260-1262.
[17] 田 颖, 刘志刚, 孟庆莉.不同产地白术药材中白术内酯Ⅱ和Ⅲ的含量测定[ J].海峡药学, 2012, 24(8) : 65-68.
[18] 许祥君, 陈 敏, 宗 露, 等.不同品规白术中白术内酯Ⅰ、 Ⅲ的含量测定[ J].中国医院药学杂志, 2011 (17):1421-1424.
[19] 何宏生, 李 鹏, 陈琴华.高效液相色谱法测定白术饮片及其炮制品中白术内酯Ⅰ含量[ J].医药导报, 2011, 30(5): 651-652.
[20] 阎克里, 朱秀卿, 赵 丽.白术挥发油的 HPLC定量质控和特征图谱研究[J].药物分析杂志, 2011, 31 (4):758-763.
[21] 李晓光.HPLC法测定砂仁药材中儿茶素的含量 [A]. 2001 年第三届全国医院 药品 质量监督管 理学术研讨会, 2001.
[22] 王增明, 郭庆东, 谢 芳, 等.HPLC测定茶多酚中儿茶素类及咖啡因含量[J].中国药学杂志, 2011, 46(21):1674-1676.
[23] 刘 刚, 谭生建, 王海涛, 等.高效液相色谱法测定跌打活血散中儿茶素和表儿茶素的含量[J].中国药学杂志,2011, 46(18): 1444-1446.
Determ ination of honokiol, m agnolol, atractylenolide-Ⅰ, atractylenolide-Ⅲand( +)-catechin in Dingchen Touge Pills by HPLC
GAOWei1, ZHU Ye-shan2, CAIChun-jiang2, SIYan-ling1
(1.Tangshan Workers Hospital, Tangshan 063000, China; 2.Hebei Tangshan Hospital of Traditional Chinese Medicine, Tangshan 063000, China)
Dingchen Touge Pills;honokiol; magnolol; atractylenolide-Ⅰ;atractylenolide-Ⅲ; ( +) -catechin;HPLC
R927.2
: A
: 1001-1528(2014)05-0980-06
10.3969/j.issn.1001-1528.2014.05.021
2013-10-25
唐山市科技局2012 年计划 (121302110b)
高 伟 (1972—), 男, 硕士, 副主任医师, 主要从事脂肪肝、 炎性肠病、 肝硬化等临床治疗和药学研究。 Tel:( 0315)3722459, E-mail: gaoweilunwen@163.com

