葛根素磷脂复合物固体自微乳的研制及体外评价
谷珊珊, 李津明, 赵金凤, 武文强
(1.哈尔滨商业大学 药学院, 黑龙江 哈尔滨 150076; 2.厦门医学高等专科学校, 福建 厦门 361008)
葛根素磷脂复合物固体自微乳的研制及体外评价
谷珊珊1, 李津明2*, 赵金凤1, 武文强1
(1.哈尔滨商业大学 药学院, 黑龙江 哈尔滨 150076; 2.厦门医学高等专科学校, 福建 厦门 361008)
目的 研制葛根素磷脂复合物固体自微乳制剂并对其进行体外评价。 方法 采用 HPLC方法, 以葛根素的溶解度为指标,采用伪三元相图法对油相、表面活性剂、助表面活性剂进行筛选,从而确定葛根素磷脂复合物自微乳制备的最佳处方。 结果 最佳的处方比为油酸乙酯-复合表面活性剂 ( 吐温 80 ∶聚氧乙烯蓖麻油 EL=1 ∶2) -无水乙醇为20 ∶40 ∶40。 经 HPLC法测定空白自微乳的最大载药量为 238 mg/g(相当于葛根素 100mg/g)。 结论 本工艺制备的葛根素磷脂复合物固体自微乳制剂,性质稳定,形成的自微乳粒径小,溶出速度快,有利于药物的体内吸收。
葛根素;磷脂复合物;伪三元相图;固体自微乳
葛根素 (puerarin) 是从豆科植物野葛 Pueraria labata (Willd) Ohwi或甘葛 藤 Pueraria thansonii Benth 的干燥根中提取、 分离得到的异黄酮类化合物,临床上主要用于心肌缺血、高血压、冠心病、心绞痛、 心脑梗 塞等心脑血管疾病的治疗[1]。 其水溶性和脂溶性均较小,口服吸收差,生物利用度低,目前临床以注射给药为主,但其注射液可引起皮疹、速发喉头水肿、消化道出血、急性血管内溶血及肝肾损害等多种不良反应[2], 且生产成本高、生产过程中难过滤。本研究首先将葛根素制备成葛根素磷脂 复 合 物[3-4], 增 加 其 脂 溶 性[5-7], 之 后 采用固体自微乳技术,制备成葛根素磷脂复合物固体自微 乳[8-10], 提 高 其 水 溶 性, 从 而 克 服 其 半 衰 期短、消除快、口服生物利用度低的缺点,有效规避注射给药引起的不良反应[11], 对于改进临床应用现状,具有较大的实际意义,同时为自乳化给药系统的研究开辟了新的思路。
1 仪器与试药
1.1 AUTO-SCIENCE AS3120A超声波清洗仪 (上海黄海药检仪器厂); XK 96-A快速混匀器 (姜堰市新康医疗器械有限公司); ZRS-8G智能溶出仪(天津大学无线电厂);UV-2102PC型紫外可见分光光度计 (尤尼科仪器有限公司); 79-Z型双向恒温磁力搅拌器 (江苏省金坛市荣华仪器制造有限公司); SHA-A水浴恒温振荡器 (江苏金坛市环宇科学 仪 器 厂 ); DGX-9243BC-1R-202 旋 转 蒸 发 器(上海申胜生物技术有限公司); 数控恒温水浴锅HWS12 (上海一恒科技有限公司); Dionex高效液相色谱仪 (泵系统 P680 HPLC Pump, 进样系统ASI-100 Automated Sample Injector, 柱温箱 Thermostatted Column Compartment TCC-100 , 检 测 器UVD340U);ODSC18色谱柱 (4.6 mm×250 mm,5 μm, 迪马公司) ; JEM-100CXR透射电镜 ( 日本电子公司) ; BI-200SM 型广角度动 /静态激光散射仪 (美国 Brookhaven 公司)。
1.2 葛根素 (陕西中鑫生物科技有限公司,纯度≧99%, 批号 111102); 大豆卵磷脂 Lipoid E80(德国 Lipoid, 批号 1031783-31901 ) ; 愈风宁心片(北京同仁堂制药有限公司,批号 1120282); 三氯甲烷、甲醇 (色谱纯, 天津市科密欧化学试剂有限公司, 批号 20110505、 20110328); 乙腈 (色谱纯,山东禹王实业有限公司化工分公司,批号2011111606); 其他试剂均为国产分析纯。
2 方法与结果
2.1 葛根素磷脂复合物的制备及含药量测定
2.1.1 制备方法 称取葛根素 16 g, 磷脂 24 g于150 mL锥形瓶中, 加入 100 mL无水乙醇, 使反应物质量浓度为 160 mg/mL, 于恒温磁力搅拌器上30 ℃恒温搅拌 1.5 h, 得黄色澄明溶液。 将溶液移入500 mL磨口梨形瓶中于50 ℃旋转蒸发除去反应溶剂后加入三氯甲烷复溶,减压抽滤,除去未反应沉淀,再旋转蒸发除去三氯甲烷,所得干燥物真空干燥, 过 100 目筛, 即得黄白色略黏的葛根素磷脂复合物细粉。
2.1.2 葛根素磷脂复合物中葛根素的测定 精密称取葛根素对照品 0.002 3 g, 置 50 mL量瓶中用无水乙醇定容, 再分别精吸 0.5、 1.0、 1.5、 2.0、2.5 mL置 10 mL量瓶中定容, 于紫外分光光度计250 nm处测定吸光度[12], 绘制葛根素在无水乙醇中的标准曲线, 得出标准曲线方程为 y=67.26x-0.021, r=0.999 9, 线性范围 2 ~10 μg/mL。 取精密称定的按 “2.1.1” 项下方法平行制备的 3 批葛根素磷脂复合物各 0.005 5、 0.005 7、 0.005 4 g置50 mL量瓶中, 加入无水乙醇定容至刻度, 制得的母液质量浓度分别为: 0.016 5、 0.017 1、 0.016 2 mg/mL。 再精吸 1.5 mL置 10 mL量瓶中定容, 于紫外分光光度计 250 nm处测定吸光度, 平行 3 次。所测得的吸光度值分别为 0.485、0.458、 0.422。将测得的吸光度代入标准曲线方程计算质量浓度。3批葛根素磷脂复合物中葛根素的含有量分别为42%、38%、37%。
2.1.3 精密度试验 取低、 中、 高 3 个质量浓度(4.2、 6.3、 8.4 μg/mL) 的葛根素无水乙醇溶液,按 “2.1.2” 项下方法测定吸光度, 每个质量浓度一天内连续测 5 次,连续测 5 d, 求各质量浓度 RSD值。结果日内、日间吸光度的 RSD均 <1.65%, 表明仪器精密度良好。
2.1.4 回收率考察 精密称取 80、 100、 120 mg葛根素磷脂复合物各 3 份, 置 100 mL量瓶中, 加无水乙醇超声 10min, 冷却后加无水乙醇稀释至刻度, 用0.45 μm微孔滤膜滤过, 弃去初滤液, 取续滤液1 m L于 100 mL量瓶中定容。 按 “2.1.2”项下方法测定吸光度,代入标准曲线方程得回收率, 结果回收率均 >99.7%,RSD<0.35%。
2.2 葛根素磷脂复合物的测定
2.2.1 色谱条件 ODS C18色谱柱 (4.6 mm× 150 mm, 5 μm)。 流动相为水-乙腈 (75 ∶25);检测波长为 250 nm。 理论板数按葛根素峰计算不低于 5 000。
2.2.2 葛根素标准曲线的制备 取葛根素对照品0.024 0 g用流动相溶解于 100mL量瓶中, 取 5mL于10 mL量瓶中, 依次稀释5 次,得6 个等比例浓度系列溶液, 用 0.45 μm滤过, 取续滤液 5 μL进样,以质量浓度为横坐标,以峰面积为纵坐标,绘制标准曲线,所得标准曲线方程为 y=0.568 2x-0.489 8, 线性范围 7.5 ~120 μg/mL。
2.2.3 精密度试验 取低、 中、 高 3 个质量浓度(22.30、 33.50、 45.00 μg/mL) 的葛根 素 溶 液,按 “2.2.1” 项下方法测定吸光度,每个质量浓度一天内连续测 5 次,连续测 5 d, 求各质量浓度 RSD值。 结果日内、 日间精密度 RSD值均 <1.75%, 表明仪器精密度良好。
2.2.4 回收率试验 精密称取 80、 100、 120 mg葛根素磷脂复合物各3 份, 置50 mL量瓶中, 加流动相超声 10 min, 冷却, 加流动相稀释至刻度, 用0.45 μm微孔滤膜滤过, 弃去初滤液取续滤液1 mL于 50 mL量瓶中定容。 取 5 μL进样, 将峰面积代入标准曲线方程得回收率。结果回收率均 >99.8%, RSD均 <0.35%。
2.3 葛根素磷脂复合物自微乳的处方研究[13]
2.3.1 油相的选择 本研究选择豆油、 蓖麻油、亚油酸和油酸乙酯为油相,分别取5 mL油相于试管中,加入适量的葛根素磷脂复合物制成过饱和溶液, 于 60 ℃水浴涡旋混合, 再于 37 ℃恒温水浴振荡器上平衡 24 h 后, 经 3 000 r/min 离心 15 min,取上清或下清液用流动相稀释适宜的倍数后,经0.45 μm微孔滤膜过滤, 按 “2.2” 项下方法测定,结果见表1。

表1 葛根素磷脂复合物在各油相中的溶解度Tab.1 Puerarin phospholipid com plex solubility in the oil phase
由表1可知葛根素磷脂复合物在油酸乙酯中的溶解度最大,故选择油酸乙酯为油相。
2.3.2 表面活性剂的选择 选择吐温 80、 吐温60、 聚氧乙烯蓖麻油为表面活性剂, 按 “2.2” 项下方法,以葛根素磷脂复合物溶解度为指标考察上
述3种表面活性剂, 结果见表2。

表2 葛根素磷脂复合物在各表面活性剂中的溶解度Tab.2 Solubility of puerarin phospholipid complex in the surface active agen ts
根据文献报道,复合乳剂可显著增大 O/W型微乳的成乳区域, 故选择吐温 80和聚氧乙烯蓖麻油 EL为复合乳化剂, 二者比例为 2 ∶1, 1 ∶1,1 ∶2与油酸乙酯按 4 ∶6 比例混合, 进行自乳化考察, 以蓖麻油为对照, 平行3次。 结果见表3。

表3 油相与表面活性剂的自乳化效果Tab.3 Self-emulsifying effect of oil phase and su rfactant
由表3可知,以油酸乙酯为油相,与不同比例的吐温 80 和聚氧乙烯蓖麻油 EL组成的复合表面活性剂均能形成澄清并有蓝色乳光的自微乳。故选择吐温 80 和聚氧乙烯蓖麻油 EL作为复合表面活性剂。
2.3.3 助表面活性剂的选择 选择无水乙醇、1,2-丙二醇、 丙三醇、聚乙二醇-400 为助表面活性剂。 按 “2.2” 项下方法, 以葛根素磷脂复合物溶解度为指标考察上述4种助表面活性剂,结果见表4。

表4 葛根素磷脂复合物在各助表面活性剂中的溶解度Tab.4 Solubility of puerarin phospholipid complex in the cosur factant
假定油相与乳化剂、助乳化剂的重量比为4 ∶6, 将筛选的混合表面活性剂与上述助表面活性剂以 Km=1 ∶1 的比例, 即吐温 80-聚氧乙烯蓖麻油 EL-无水乙醇的比例为 1 ∶2 ∶3 或 1 ∶1 ∶2 或2 ∶1 ∶3相混合, 再与筛选的油相进行成乳试验,以确定助乳化剂。 结果见表5。

表5 油相、 表面活性剂与助表面活性剂成乳情况Tab.5 Oil phase, surfactant and cosurfactant emulsifying situation
由表5可知,当油相、表面活性剂、助表面活性剂分别为油酸乙酯、 吐温80和聚氧乙烯蓖麻油EL混合物、无水乙醇时且各组分比例为4∶1∶2 ∶3时能形成淡蓝色澄明微乳。 故选择吐温 80 和聚氧乙烯蓖麻油EL作为复合表面活性剂, 且二者比例为1 ∶2, 无水乙醇为助表面活性剂。
2.3.4 伪三元相图的制备 将筛选的复合表面活性剂吐温 80 和聚氧乙烯蓖麻油 EL与助表面活性剂无水乙醇按 Km分别为 4 ∶1、 3 ∶2、 1 ∶1、2 ∶3、 1 ∶4的比例的混合物, 与确定的油相油酸乙酯按照1 ∶9、 2 ∶8、3 ∶7、4 ∶6、 5 ∶5、 6 ∶4、7 ∶3、 8 ∶2、 9 ∶1 的比例混匀, 37 ℃恒温, 在搅拌下逐滴加水,记录形成微乳临界点时各组分的质量百分数。
以油相、水相、表面活性剂与助表面活性剂混合物为3个顶点,绘制伪三元相图,确定微乳区界限。若所形成的混合液为乳白色且平行光入射有散射现象,即为乳剂;混合液为澄清透明或有蓝色乳光,且平行光入射时有丁达尔现象,即为微乳;若稠厚且澄清透明,则为凝胶。沿着伪三元相图中微乳区域的边线由水的顶点做切线,朝向混合乳化剂的顶点区域内的体系可以用水无限稀释,为自微乳化区域。 所绘制伪三元相图如图 1, ME区为微乳区。

图1 空白微乳的伪三元相图Fig.1 Pseudo-ternary phase diagram of the blank m icroemulsion
由图1可知, 随着Km值的减小所形成的的微乳区域逐渐增大, 当Km=1∶1时所形成的微乳区域最大,之后又随 Km值的继续减小而呈减小趋势。 故当 Km=1∶1时各组分的质量百分数为制备自微乳的最佳配比量。油相油酸乙酯为 20%, 复合乳化剂吐温 80 和聚氧乙烯蓖麻油 EL与助乳化剂无水乙醇各为 40%。
2.4 葛根素磷脂复合物固体自微乳的处方研究
2.4.1 空白自微乳的制备 根据伪三元相图研究所得最佳处方比例, 称取吐温 80 4 g,聚氧乙烯蓖麻油 EL 4 g, 于25 mL锥形瓶中于 37 ℃恒温磁力搅拌至混合均匀,再加入8 g无水乙醇继续搅拌、混合均匀,最后加入油酸乙酯4 g继续保温搅拌、混匀,即得黄色澄明空白自微乳。
2.4.2 载药量的测定 称取过量葛根素磷脂复合物 (过100 目筛) 细粉, 准确加入 1 mL空白自微乳, 涡旋 15 min, 充分混匀, 使之成过饱和状态,置于 37 ℃ 恒温水浴振荡器中振荡 24 h, 离心(3 000 r/min, 30 min), 取 上 清 液, 用 流 动 相 稀释, 经 0.45 μm微孔滤膜过滤后, 按 “2.2” 项下方法测定,平行做3份,代入标准曲线方程,计算求得空白自微乳的最大载药量为 238 mg/g(相当于含葛根素 100 mg)。
2.4.3 葛根素磷脂复合物自微乳的制备 取制备的空白自微乳 10 g, 加入葛根素磷脂复合物细粉2.38 g, 于 25 mL锥形瓶中利用超声波使其充分溶解,即得黄色澄明葛根素磷脂复合物自微乳 (每1 g微乳中含葛根素 100 mg)。
2.4.4 固体吸收剂的选择 取 5 种固体吸收剂甘露醇、 PEG 6000、 淀粉、 微晶纤维素、 微粉硅胶各1 g, 分别逐滴加入葛根素磷脂复合物自微乳,直至形成固体自微乳。所能吸收的自微乳量,见表6。
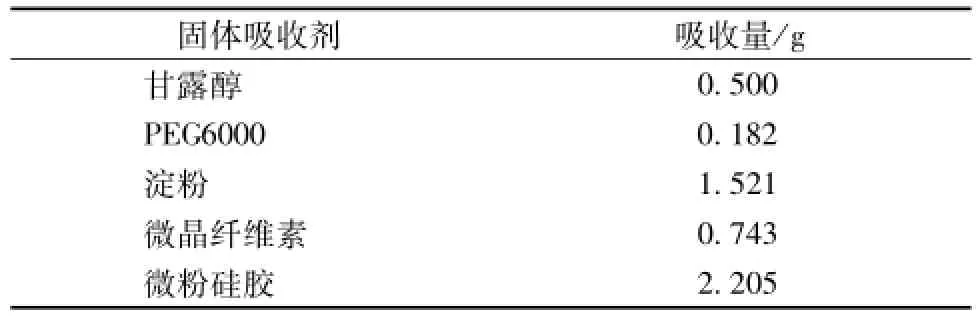
表6 5种固体吸收剂吸收的自微乳量的比较Tab.6 Comparison of five kindsof solid absorbent self-m icroemulsion volume
由表6可知,淀粉、微晶纤维素、微粉硅胶的吸附能力较强。故对其作进一步的溶出度考察。称取制备的葛根素磷脂复合物自微乳3份, 每份1 g,分别加入淀粉、微晶纤维素、微粉硅胶中混合直至形成固体自微乳粉, 放入 100 mL蒸馏水的溶出杯中, 温度 (37 ±0.5)℃, 转速 50 r/min, 药粉与水接触时开始转动浆杆并计时, 分别于 5、 10、20、 30、 45、 60 min 取样, 稀释, 超声, 经 0.45 μm微孔滤膜过滤后按 “2.2” 项下方法进样, 计算累积溶出百分率。 结果见表7。

表7 3种固体吸收剂的累积溶出率Tab.7 Cumulative percentage release 3 solid absorbent
由表7可知,其中3种固体吸收剂的累积溶出率均 >90%, 差别不显著, 但微粉硅胶的用量较少且吸附能力最强,故选择微粉硅胶为吸收剂。
2.4.5 葛根素磷脂复合物固体自微乳的制备 于室温下,取制备的葛根素磷脂复合物自微乳,加入一定量的固体载体,混匀, 研细, 过 60目筛即得葛根素磷脂复合物固体自微乳制剂。
2.5 葛根素磷脂复合物固体自微乳的体外评价
2.5.1 外观 所制备的葛根素磷脂复合物固体自微乳为黄白色细粉,触手略黏。
2.5.2 形态学研究 将上述制备的葛根素磷脂复合物固体自微乳适量, 加入 100 倍的蒸馏水稀释,超声溶解,至乳化完全。即得淡黄色澄明葛根素磷脂复合物自微乳。取葛根素磷脂复合物自微乳适量, 用2%磷钨酸复染, 在透射电镜下观察, 乳滴为圆球形,大小基本均匀,经测定其平均粒径为30 nm左右。 采用染色法对葛根素磷脂复合物固体自微乳的类型进行鉴别,选用色素为亚甲蓝 (水溶性染料)和苏丹红 (油溶性染料), 经鉴别葛根素磷脂复合物固体自微乳为 O/W型。
2.5.3 葛根素磷脂复合物固体自微乳的稳定性研究 将制备的葛根素磷脂复合物固体自微乳在室温、 40 ℃、60 ℃、 4 500 Lx及相对湿度 75%的条件下, 于第 5、 10 天取样, 分别对其外观, 葛根素含有量进行测试,结果外观无明显变化,仍为黄白色细粉, 定量测定所得结果见表8。
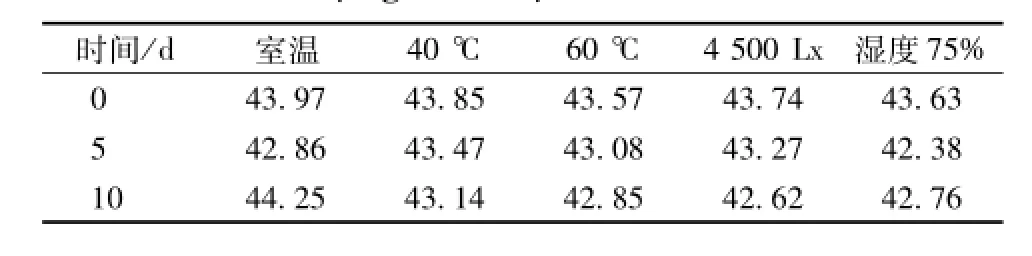
表8 葛根素磷脂复合物固体自微乳的测定结果 (mg· m L-1)Tab.8 Preparation and in vitro evaluation of puerarin phospholipid com p lex the self-m icroemulsion solid content(mg·m L-1)
由表可知,葛根素磷脂复合物固体自微乳在上述条件下性质稳定,外观性状和成分量均符合要求。
2.5.4 溶出度的测定 按 《中国药典》2010 年版二部附录 XC第二法桨法溶出度测定法[14], 分别以 900 mL超声除气的蒸馏水、 0.1 mol/L HCl、 pH 6.8 PBS 为溶出介质,称取制备的葛根素磷脂复合物固体自微乳适量 (含葛根素 100 mg), 温度(37 ±0.5) ℃, 转速 50 r/min, 药粉与水接触时开始转动浆杆并计时, 分别于 5、 10、 20、 30、 45、60 min 取样 5 mL, 同时补充各溶出介质 5 mL,超声, 经0.45 μm微孔滤膜过滤后 HPLC进样, 计算累积溶出百分率。以自制的葛根素磷脂复合物、葛根素自微乳 (制备方法同葛根素磷脂复合物自微乳) 及市 售 的 愈风 宁 心 片[15]为 对 照。结果 见 图2 ~4。
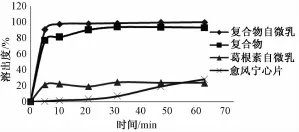
图2 葛根素磷脂复合物固体自微乳与各对照制剂在蒸馏水中的溶出率Fig.2 Puerarin phospholip id com p lex solid self-m icroemulsion and the controlagents in the stripping percentage distilled water
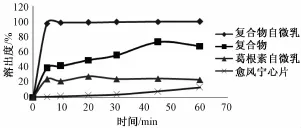
图 3 葛根素磷脂复合物固体自微乳与各对照制剂在 0.1 m ol/L HCl中的溶出率Fig.3 Puerarin phospholip id com p lex solid self-m icroemulsion with the control preparations in 0.1 m ol/L HCl in the stripping percentage
由图2~4可知, 制备的葛根素磷脂复合物固体自微乳在蒸馏水、 0.1 mol/L HCl、 pH 6.8 PBS,3 种溶出介质中 5 min 时累积溶出均在 90%以上,均高于自制的葛根素磷脂复合物、葛根素自微乳及市售的愈风宁心片。而市售的愈风宁心片在蒸馏水、 0.1 mol/L HCl、 pH 6.8 PBS, 3 种溶 出介质中, 5 min 时累积溶出仅为 20%左右。 以上结果说明葛根素制备成磷脂复合物固体自微乳后溶出度明显得到提高。
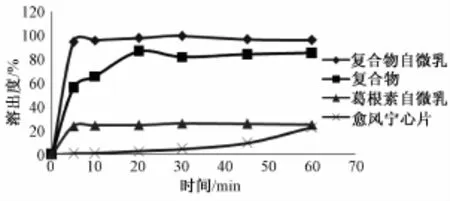
图 4 葛根素磷脂复合物固体自微乳与各对照制剂在 pH 6.8 PBS中的溶出率Fig.4 Puerarin phospholipid complex solid self-m icroemulsion w ith the control preparations in pH 6.8 PBS in the stripping percentage
3 结论
以市售的愈风宁心片作为参比制剂,本实验所制备的葛根素磷脂复合物固体自微乳在蒸馏水、0.1 mol/L HCl、pH 6.8 PBS, 3 种溶出介质中的溶出度均明显提高。且葛根素制备成磷脂复合物固体自微乳,性质稳定,溶出速度快,所形成的自微乳粒径小,有利于药物的体内吸收。本研究对扩大葛根素的临床给药途径,减少因注射给药而导致的诸多不良反应,具有一定的理论与实际应用价值。但因时间和条件的限制,葛根素磷脂复合物固体自微乳制剂在体内吸收及药效学等方面尚需深入研究。
[ 1 ] 徐 蕴.葛根素对心血管疾病治疗作用的研究[J].时珍国医国药, 2007, 18(12): 3114-3115.
[ 2 ] 徐世国.葛根素的临床应用与不良反应[J].时珍国医国药, 2005, 16(12): 1307-1308.
[ 3 ] Li Y, Pan W S, Chen S L, et al.Studies on preparation of puerarin phytosomes and their solid dispersions[ J] .Chin Pharm J, 2006, 41(15) : 1162-1167.
[4] 马云淑,赵浩如,林以宁.葛根素及其磷脂复合物的体外透皮 实 验 研 究 [ J].中 国 中 药 杂 志, 2000, 25 (5 ):274-276.
[5] 冯少华,肖小河,高文远,等.提高难溶性药物生物利用度方法研究概述 [ J].解放军药学学报, 2005, 21 (5 ):372-374.
[6] 刘振威,陈雪梅,高 尔,等.磷脂对大鼠离体肠管吸收葛根素的影响[J].潍坊医学院学报, 1998, 20(4): 253.
[7] 刘振威,潘爱美,李公宝,等.磷脂对葛根素改善家兔血液流变学和微循环作用的影响[J].潍坊医学院学报,1998, 20(4): 250.
[8] 于爱华,翟光喜,崔 晶,等.葛根素固体自微乳的研制[J].中药材, 2006, 29(8): 834-838.
[ 9 ] Quan D Q, GuoW Y.Studies on absolute bioavailability of puerarin with self-emulsifying drug delivery systems[ J] .Sci Techno Eng, 2010, 10(35): 8773-8775.
[10 ] Chen X X, Yuan S , LIG, et al.Pharmacokinetics and bioavailability of puerarin self-microemulsion in beagle dogs[J] .J Chin Med Mater, 2011, 34(5) : 750-753.
[11] 徐世国.葛根素的临床应用与不良反应[ J].时珍国医国药, 2005, 16(12): 1307-1308.
[12] 杨振林, 寇玉玺, 李红举.紫外分光光度法测定葛根冲剂中葛根素含量[J].中国医学论坛, 2005, 26(6): 57.
[13 ] Quan D Q, Xu G X, Wu X G.Studies on preparation and absolute bioavailability of a self-emulsifying system containing puerarin[ J] .Chem Pharm Bull, 2007, 55(5) : 800-803.
[14] 国家药典委员会.中华人民共和国药典: 2010 年版二部[S].北京: 中国医药科技出版社, 2010.
[15] 闵庆旺, 谭生建.薄层扫描法测定愈风宁心片中葛根素的含量[J].药物分析杂志, 1994, 14(1): 57-58.
Preparation and in vitro evaluation of puerarin phospholipid com p lex solid self-m icroemulsion
GU Shan-shan1, LIJin-ming2*, ZHAO Jin-feng1, WUWen-qiang1
(1.College of Pharmacy, Harbin University of Commerce, Harbin 150076, China; 2.Xiamen Medical College, Xiamen 361008, China)
puerarin; phospholipid complex; pseudo-ternary phase diagram; solid selfmicroemulsion
R944
: A
: 1001-1528(2014)05-0946-06
10.3969/j.issn.1001-1528.2014.05.014
2013-08-15
黑龙江省教育厅科技资助项目 (11521060)
谷珊珊 (1989—) , 女, 硕士生, 研究方向: 中药制剂新剂型。 Tel: 15846343917, E-mail: gushanshan0320@163.com
*通信作者: 李津明, 教授, 博士生导师, 研究方向: 中药制剂现代剂型。 Tel: 18054821390, E-mail: lijinming1962@163.com

