壳聚糖对草鱼人工感染水霉的影响
孙 琪 胡 鲲 杨先乐
(上海海洋大学, 国家水生动物病原库, 上海 201306)
壳聚糖对草鱼人工感染水霉的影响
孙 琪 胡 鲲 杨先乐
(上海海洋大学, 国家水生动物病原库, 上海 201306)
水霉病给水产养殖业造成巨大经济损失[1,2], 水霉是引起鱼类发生水霉病的主要病原, 其适应温度范围广(5—26 ), ℃ 分布范围亦很广[3]。水霉对宿主无严格的选择性[4,5], 除鱼卵外, 鱼类水霉病均非原发性疾病, 而是继发性疾病[6,7]。当鱼类皮肤或鳃受到机械损伤及其他病原体的伤害时, 水霉孢子会在伤口处侵染萌发。目前国内市场上还没有一种药物可有效防治水霉病, 防治水霉病成为水产养殖行业的一个重要难题。如何减少水霉病的发生成为水霉病研究的重要部分。由于水霉是腐生性的, 未受伤的鱼不受感染[8,9], 所以促进鱼体伤口愈合成为减少水霉病发生的一条重要途径。
甲壳素(Chitin)是唯一一种在自然界中大量存在的氨基多糖, 其化学命名为 β-(1→4)-2-乙酰氨基-2-脱氧-D-葡萄糖。壳聚糖(Chitosan)是甲壳素的脱乙酰基产物, 也叫脱乙酰甲壳素, 简称(CTS)[10]。甲壳素分布极其广泛, 大量存在于海洋节肢动物(如虾、蟹)的甲壳中, 也存在于昆虫、藻类细胞膜和高等植物的细胞壁中, 在自然界的储量仅次于纤维素[11], 每年生物合成的甲壳素有10万亿千克之多。壳聚糖有促进伤口愈合的作用[12], 壳聚糖可促进内白细胞杀菌素和巨噬细胞的迁移, 用壳聚糖处理的伤口,可以加速Ⅲ型胶原蛋白的分泌, 从而促进了肉芽组织和上皮组织的形成[13]。Mori, et al.[14]通过鼠体外实验证明壳聚糖对内皮细胞和表皮细胞有趋化性吸引作用, 可以促进纤维母细胞及血管内皮细胞的迁移和增殖。Kawakami, et al.[15]通过对小鼠实验发现壳聚糖对伤口疼痛有很好的舒缓作用。Allan, et al.[16]发现壳聚糖与伤口接触时能起到清凉而舒服的润肤作用。
壳聚糖已在水处理、日用化学品、生物工程、农业、食品和医药等领域得到了广泛的应用[17—19], 在水产养殖上的研究, 主要以其能增强鱼虾的免疫功能而逐渐引起国内外水产工作者的关注[20], 而有关壳聚糖对鱼类的其他作用, 如对鱼类疾病有无预防、治疗效果的研究很少,就其在促进鱼类伤口愈合、预防水霉病等作用方面的研究还未涉及。因此, 本研究将壳聚糖添加到受伤草鱼以及人工感染水霉草鱼的养殖水体中, 研究壳聚糖对草鱼伤口愈合以及对人工感染水霉草鱼的影响。通过壳聚糖治疗鱼类体表外伤, 减低鱼类感染水霉的概率, 为壳聚糖应用于预防鱼类水霉病提供理论依据。
1 材料与方法
1.1 实验用鱼
草鱼(Ctenopharyngodon idellus), 规格约为(50±10) g,体长(15±2) cm,购自江苏省南通国营农场, 体表以及解剖观察健康。200 L玻璃容器, 24h增氧, 水源为已曝气、消毒自来水, 各项指标均符合渔业水质标准。草鱼实验前暂养 10d, 每天定时投喂饲料 2次, 饲料配制参照 National Research Council(NRC)营养标准。
1.2 实验试剂
壳聚糖, 纯度为90%—95%, 购自上海卡博工贸有限公司; 马铃薯葡糖糖琼脂(PDA), 购自国药集团化学试剂有限公司。
1.3 实验菌株
水霉菌株为寄生水霉(Saprolegnia parasitica), 购自于 ATCC, 菌株编号: 200013。
1.4 实验方法
壳聚糖对草鱼伤口愈合的影响 取 5个同样规格的鱼缸(65 cm×40 cm×50 cm, 本实验均为此规格鱼缸)加入等量已曝气水, 每个鱼缸中分别加入相应量的壳聚糖, 混匀, 使其壳聚糖最终浓度分别为0、12.5、25、50、100 mg/L。
取健康草鱼 100条, 在每条草鱼一侧背鳍下方的位置, 用刀片划“ ”Ⅱ 型伤口, 伤口以不出血为标准, 将带有伤口的草鱼随机地分配到5个鱼缸中, 每缸20条。停止投喂, 5d后观察伤口愈合情况。重复以上实验3次。
草鱼人工感染水霉实验 挑取保存于试管内的水霉菌丝, 转接于马铃薯葡糖糖琼脂培养基(PDA, 配方: 葡萄糖20 g/L, 琼脂粉20 g/L, 马铃薯淀浸出粉15 g/L)培养皿中, 20℃培养72h, 使菌丝长满整个培养基表面。取20个培养好的培养皿, 将水霉菌连同培养基一起放入过滤网袋中, 放入已曝气水体中, pH 6.5—6.8, 在水温20℃的条件下培养水霉, 18h后, 用血球计数板每隔2h计数一次水体中孢子数, 直至水体中孢子浓度达到 1×104个/mL,作为感染水体。
取养殖于25℃水温中健康草鱼20条, 用手术刀将其背鳍下方两侧的鳞片去掉, 刮拭去掉鳞片部位的皮肤约9 cm2, 并用刀片轻微划伤皮肤, 擦拭掉伤口表面的黏液。
将20条划伤过的草鱼置于感染水体中, 并使水温在1h内下降到15 ℃ , 48h 后开始观察记录实验结果。重复以上实验10次。
壳聚糖对水霉菌丝生长的影响 配置浓度分别为0、12.5、25、50、100 mg/L的壳聚糖悬浮液, 分别取5 mL加入 6孔板的相应各孔中, 然后每孔中加入水霉菌块(5 mm×5 mm)。20℃培养20h后, 观察水霉菌丝生长情况。每个浓度分别作3组平行实验。
壳聚糖对草鱼人工感染水霉实验的影响 (1) 感染水体中添加壳聚糖, 对草鱼人工感染水霉实验的影响:实验组感染水体中含有壳聚糖, 其浓度为25 mg/L, 对照组为已曝气自来水, pH 6.5—6.8, 用上述草鱼人工感染水霉实验方法, 将划伤的草鱼随机的放到上述两组鱼缸中,每缸各20条, 48h后开始观察记录实验结果。重复以上实验3次。(2) 壳聚糖浸泡受伤草鱼后, 对草鱼人工感染水霉实验的影响: 按照草鱼人工感染水霉实验中划伤鱼体的方法处理草鱼 40条, 随机平均分配为两组, 实验组水体中加入壳聚糖, 使其浓度为25 mg/L, 对照组为已曝气自来水, pH 6.5—6.8, 养殖72h后, 进行感染实验。
用上述草鱼人工感染水霉的实验方法, 对以上两组草鱼进行人工感染, 养殖 48h后, 开始观察记录实验结果。重复以上实验3次。
1.5 数据分析
用 SPSS13.0软件统计所有数据并进行方差分析(one-way-ANOVA), 差异显著时采用最小显著性差异法(Least Significant Difference, LSD)对各组平均样之间进行多重比较, 数据表示为平均值加减标准差(Mean±SD)。
2 结果
2.1 壳聚糖对草鱼伤口愈合的影响
壳聚糖浓度≥25 mg/L时, 对草鱼伤口愈合效果显著,且伤口表面附有黏液(图 1 a); 对照组草鱼伤口红肿, 未愈合, 甚至伤口有溃烂(图1 b)。

图1 草鱼伤口愈合情况Fig. 1 The wound healing situation of grass carp
对照组草鱼伤口愈合率为1.67%。在水体中添加壳聚糖对草鱼伤口愈合率有显著影响(P<0.05)。在壳聚糖浓度为50 mg/L时, 草鱼伤口愈合率与浓度为100和25 mg/L时的无显著差异(P>0.05)(表1)。
2.2 草鱼人工感染水霉实验
10次重复实验发现, 本实验方法可成功地完成草鱼人工感染水霉, 且有较高的感染率。从表2可看出, 草鱼人工感染水霉平均感染率为 84.00%, 且在感染过程中草鱼平均死亡率为2.00%, 各实验组间无显著差异(P>0.05)。
2.3 壳聚糖对水霉菌丝生长的影响
20h后, 对照组水霉菌丝平均长度为7.67 mm。200 mg/L壳聚糖悬浮液中水霉菌丝平均长度与对照组的有显著差异(P<0.05), 其他浓度组与对照组无显著差异(P>0.05)(表3)。
从表 3中可以看出: 低浓度壳聚糖对水霉菌无直接的抑制或杀灭作用, 在感染水体中添加壳聚糖不会对水霉菌产生直接影响。
2.4 壳聚糖对草鱼人工感染水霉实验的影响
感染水体中添加壳聚糖, 对草鱼人工感染水霉实验的影响 在死亡率相同条件下, 对照组草鱼人工感染水霉感染率为86.67%。在感染水体中添加25 mg/L壳聚糖悬浮液时,其感染率为61.67%与对照组有显著差异(P<0.05)(图2)。
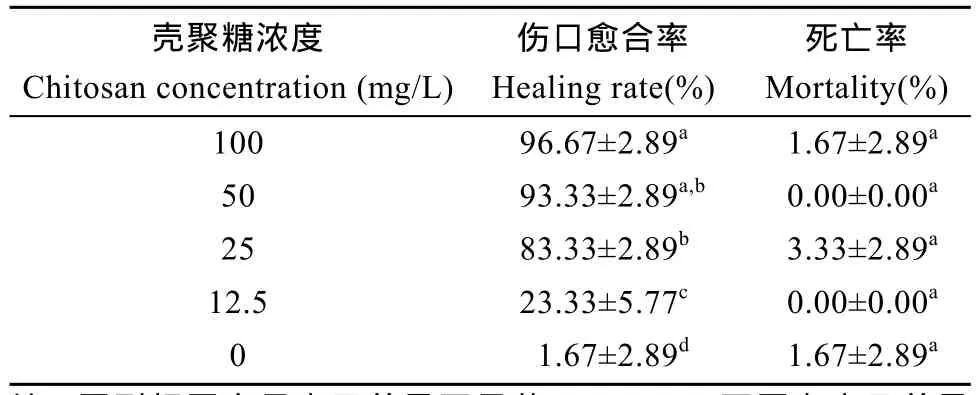
表1 不同浓度壳聚糖对草鱼伤口愈合影响(n=3)Tab. 1 Effect of different concentrations of chitosan on grass carp wound healing(n=3)
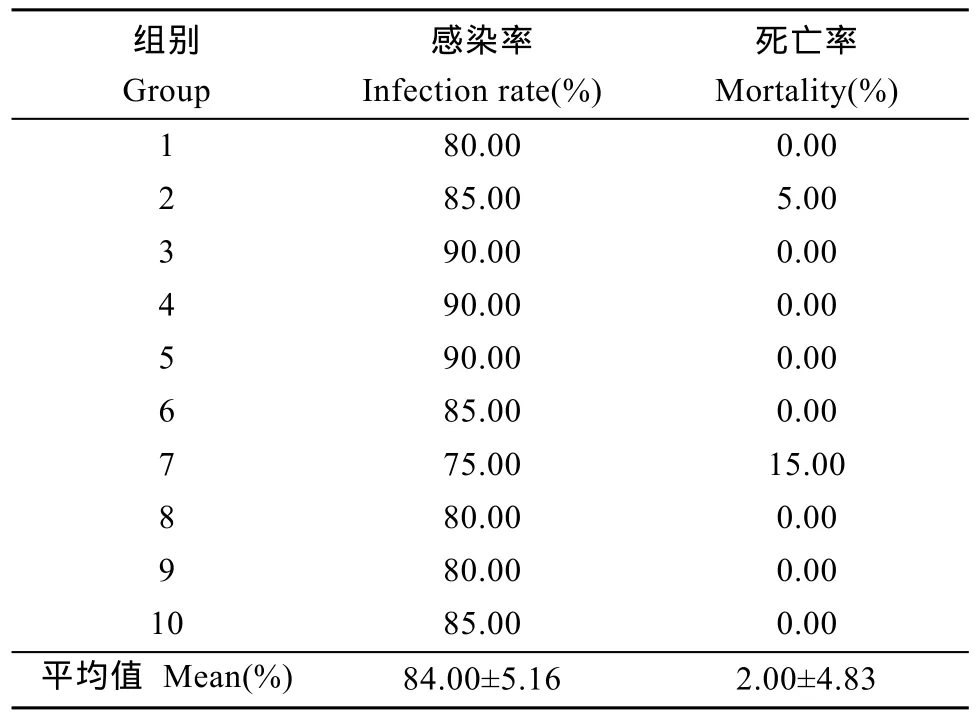
表2 草鱼人工感染水霉实验结果Tab. 2 The results of artificial infection of saprolegnia on grass carp
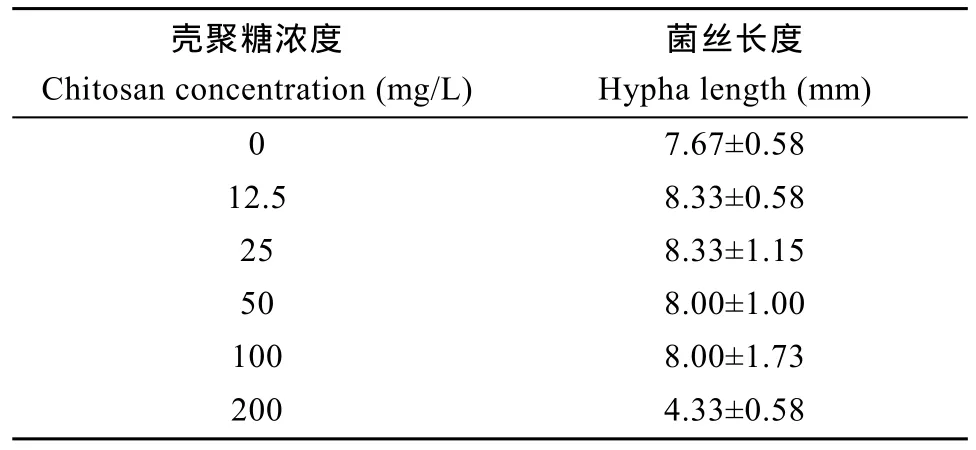
表3 20h后不同浓度的壳聚糖中水霉菌丝的长度(n=3)Tab. 3 Hypha length of saprolegnia in different concentrations of chitosan after 20 hours(n=3)
感染前, 壳聚糖浸泡受伤草鱼后, 对草鱼人工感染水霉实验的影响 在死亡率相同条件下, 对照组草鱼人工感染水霉感染率为86.67%。感染前, 25 mg/L壳聚糖浸泡受伤草鱼3d后, 其感染率为43.33%与对照组有显著差异(P<0.05)(图 2)。且未感染的草鱼伤口明显愈合, 且伤口表面附有黏液。
在感染水体中添加25 mg/L壳聚糖悬浮液时, 草鱼人工感染水霉感染率为61.67%; 感染前, 25 mg/L壳聚糖浸泡受伤草鱼3d后, 其感染率为43.33%。感染前, 25 mg/L壳聚糖浸泡受伤草鱼 3d后, 能极显著的降低其感染率(P<0.05)。

图2 草鱼人工感染水霉感染率(n=3)Fig. 2 The results of artificial infection of saprolegnia on grass carp with different chitosan treatments(n=3)
3 讨论
3.1 伤口愈合
本实验所用的壳聚糖利用虾、蟹壳生产, 适量添加到受伤鱼体养殖水环境中 5d, 壳聚糖在水体中的浓度达到25 mg/L以上时, 对草鱼体表伤口有显著的愈合作用。Usami, et al.[21]对牛、Okamoto, et al.[22]对狗、Kaoru, et al.[23]对鼠伤口研究均发现壳聚糖具有很好的促进伤口愈合作用, Graeme, et al.[24]对人体皮肤体外实验发现壳聚糖可促进纤维母细胞和角质细胞增殖。壳聚糖正被人医、兽医作为伤口愈合增效加速剂在医学界广泛使用[25], 本实验首次证实壳聚糖对非哺乳动物体表伤口有愈合作用, 为进一步推广壳聚糖的应用提供理论依据。
3.2 人工感染
水霉病作为当今水产养殖业一个较重大难题, 现今还不存在一种可用的特效药物防治水霉病。因此, 预防水霉病的发生成为重中之重。通过10次草鱼人工感染水霉平行实验证明: 本方法稳定可靠、可重复性高, 可作为草鱼人工感染水霉基本方法用于科学研究。
本实验验证了低浓度壳聚糖对水霉菌无直接的抑制或杀灭作用, 在感染水体中添加壳聚糖对水霉菌无直接影响。在此基础上, 分别采用在感染水体中添加25 mg/L的壳聚糖以及感染前用 25 mg/L的壳聚糖浸泡受伤草鱼3d, 结果表明: 草鱼人工感染水霉感染率均降低。而感染前用壳聚糖浸泡受伤草鱼, 感染率相对更低, 死亡率与对照组无显著差异, 说明25 mg/L壳聚糖对草鱼无毒害作用, 在生产实践中可用于降低受伤鱼类水霉病发病率,减少经济损失。
[1] Hussein M M A, Hatai K. Pathogenicity of Saprolegnia species associated with outbreaks of salmonid saprolegniosis in Japan [J]. Fisheries Science, 2002, 68(5): 1067—1072
[2] Tampieri M P, Galuppi R, Carelle M S, et al. Effect of selected essential oils and pure compounds on Saprolegnia parasitica [J]. Pharmaceutical Biology, 2003, 41(8): 584—591
[3] Monica M S, Alan P, Kanak B. Saprolegnia bulbosa sp. nov. isolated from an Argentine stream: taxonomy and comparison with related species [J]. FEMS Microbiology Letters, 2007, 268(2): 225—230
[4] Kanit C, Kishio H. Freshwater fungi isolated from eggs of the common carp (Cyprinus carpio) in Thailand [J]. Mycoscience, 2004, 45(1): 42—48
[5] Kitancharoen N, Hatai K. Some biological characteristics of fungi isolated from salmonid eggs [J]. Mycoscience, 1998, 39(2): 249—255
[6] Behrens P W, Sicotte V J, Delents J. Microalgae as a source of stable isotopically labeled compounds [J]. Journal of Applied Phycology, 1994, 6(2): 113—121
[7] Khulbe R D, Bisht G S, Chandra J. An ecological study on watermolds of some rivers of Kumaun Himalaya [J]. Journal of the Indian Botanical Society, 1995, 74(3): 61—64
[8] Behrens P W, Sicotte V J, Delents J. Micro algae as a source of stable isotopically compounds [J]. Journal of Applied Physics, 1994, 6:113—121
[9] Song X H, Chen K W, Zhu C F, et al. Effects of EM and deuterium sulfate treatment on the inhibition rate of Saprologenia parasitia during the hatching of Pseudobagrus fulvidraco fertilized eggs [J]. Freshwater Fisheries, 2007, 37(1): 9—12,18 [宋学宏, 陈葵王, 朱春峰, 等. EM及重氢硫酸盐对黄颡鱼卵孵化中水霉的抑制作用. 淡水渔业, 2007, 37(1): 9—12, 18]
[10] Wang Y T, Liu Y H, Zhang S Q. Advances in chemical modofication and application of chitin, chitosan and their derivatives [J]. Journal of Functional Polymers, 2002, 15(3): 107—114 [汪玉庭, 刘玉红, 张淑琴. 甲壳素、壳聚糖的化学改性及其衍生物应用研究进展. 功能高分子学报, 2002, 15(3): 107—114]
[11] Muzzarelli R, Jeuniaux C, Gooday G W. Chitin in Nature and Technology [M]. NewYork: Plenum Press. 1986, 354
[12] Chen Y, Dou G F, Tan H M, et al. Application of chitin and chitosan in the wound dressing. Journal of Functional Polymers, 2005, (1): 94—100 [陈煜, 窦桂芳, 谭惠民, 等. 甲壳素和壳聚糖在伤口敷料中的应用. 高分子通报, 2005, (1): 94—100]
[13] Koch A E, Polverini P J, Kunkel S L, et al. Interleukin-8 as a macrophage-derived mediator of angiogenesis [J]. Science, 1992, 258(5089): 1798—1801
[14] Mori T, Okumura M, Matsuura M, et al. Effects of chitin and its derivatives on the proliferation and cytokine production of fibroblasts in vitro [J]. Biomaterials, 1997, 18: 947—951
[15] Kawakamia K, Miyatakea K, Okamotoa Y, et al. Analgesic effects of chitin and chitosan [J]. Carbohydrate Polymers, 2002, 49(3): 249–252
[16] Allan G G, Altman L C, Bensinger R E, et al. In Chitin, Chitosan and Related Enzymes [M]. Amsterdam: Academic Press. 1984, 119—133
[17] Ma N, Wang Q, Wang A Q, et al. Progress in chemical modification of chitin and chitosan [J]. Progress in Chemistry, 2004, 16(4): 643—653 [马宁, 汪琴, 王爱勤, 等. 甲壳素和壳聚糖化学改性研究进展. 化学进展, 2004, 16(4): 643—653]
[18] Chen J Y, Le X Y. Applications of chitosan and its derivatives in agricultural production [J]. Chemical Research and Application, 2011, 23(1): 1—8 [陈佳阳, 乐学义. 壳聚糖及其衍生物在农业上的应用. 化学研究与应用, 2011, 23(1): 1—8]
[19] Zhao X R, Xia W S. Antimicrobial activities of chitosan and applications in food preservation [J]. Food Research and Development, 2006, 27(2):157—160 [赵希荣, 夏文水. 壳聚糖的抗菌防腐活性及其在食品保藏中的应用. 食品研究与开发, 2006, 27(2):157—160]
[20] Hua X M, Zhou H Q, Zhou H, et al. Effect of dietary supplemental chitosan and probiotics on growth and some digestive enzyme activities in juvenile Fugu obscurus [J]. Acta Hydrobiologica Sinica, 2005, 29(3): 299—305 [华雪铭, 周洪琪, 周辉, 等. 饲料中添加壳聚糖和益生菌对暗纹东方鲀幼鱼生长及部分消化酶活性的影响. 水生生物学报, 2005, 29(3): 299—305]
[21] Usami Y, Okamoto Y, Minami S, et al. Chitin and chitosan induce migration of bovine polymorphonuclear cells [J]. The Journal of Veterinary Medical Science, 1994, 56: 1215—1216
[22] Okamoto Y, Minami S, Matsuhashi A, et al. Evaluation of chitin and chitosan on open wound healing in dogs [J]. The Journal of Veterinary Medical Science, 1993, 55: 743—747
[23] Kaoru M, Hiroshi A, Masayuki I, et al. Hydrogel blends of chitin/chitosan, fucoidan and alginate as healing-impaired wound dressings [J]. Biomaterials, 2010, 31(1):83—90
[24] Graeme I, Peter W, Edward J, et al. The effect of chitin and chitosan on the proliferation of human skin fibroblasts and keratinocytes in vitro [J]. Biomaterials, 2001, 22: 2959–2966
[25] Takashi M, Toru F, Hiroshi U. Topical formulations and wound healing applications of chitosan [J]. Advanced Drug Delivery Reviews, 2001, 52(2): 105—115
EFFECT OF CHITOSAN ON ARTIFICIAL INFECTION OF GRASS CARP SAPROLEGNIASIS
SUN Qi, HU Kun and YANG Xian-Le
(State Collection Center of Aquatic Pathogen, Shanghai Ocean University, Shanghai 201306, China)
壳聚糖; 水霉; 草鱼; 人工感染; 伤口愈合
Chitosan; Saprolegnia parasitica; Ctenopharyngodon idellus; Artificial infection; Wound healing
S941.43
A
1000-3207(2014)01-0180-04
10.7541/2014.24
2012-11-20;
2013-10-25
科技部863课题“新型环境友好型渔药的研制与渔药安全性评价”(2011AA10A216); 上海市科技兴农重点攻关项目“一种高效无毒防治水霉病制剂的研制”(沪农科攻字(2011)第 4-8号); 国家科技基础条件平台建设运行项目(2012)资助
孙琪(1987—), 女, 山东威海人; 硕士研究生; 主要从事鱼类水霉病研究。E-mail: silviasun1987@163.com
杨先乐, E-mail: xlyang@shou.edu.cn

