赖氨酰氧化酶样-4与丝氨酸蛋白酶基因在人宫颈癌细胞中的表达
王秀萍于祥远陈美玲董滨华毛晓丹林 芬孙蓬明*
(1 福州市第一医院妇产科,福建 福州 350009;2 福建省妇幼保健院妇科肿瘤实验室,福建 福州 350001)
赖氨酰氧化酶样-4与丝氨酸蛋白酶基因在人宫颈癌细胞中的表达
王秀萍1Δ于祥远2Δ陈美玲1董滨华2毛晓丹2林 芬2孙蓬明2*
(1 福州市第一医院妇产科,福建 福州 350009;2 福建省妇幼保健院妇科肿瘤实验室,福建 福州 350001)
目的探讨赖氨酰氧化酶样-4(LOXL4)和丝氨酸蛋白酶(Matriptase)在三株人宫颈癌细胞中的表达情况。方法采用qRT-ΡCR及Western blot方法检测三株体外培养的宫颈癌细胞株Hela、ME180、HCC94中赖氨酰氧化酶样-4和Matriptase mRNA的表达及LOXL4蛋白的翻译水平。结果LOXL4 mRNA在三株人宫颈癌细胞中存在不同程度的表达,蛋白翻译水平与mRNA基因表达一致,以Hela表达为最高,ME180次之,HCC94表达最低;而ME180和HCC94中MatriptasemRNA相对表达丰度分别是Hela的4.09倍和12.40倍。结论本研究成功建立了LOXL4及Matriptase在体外培养宫颈癌细胞中表达的检测平台,LOXL4、Matriptase的相对表达水平可能与宫颈癌细胞的侵袭和迁移能力有关。
宫颈癌;基因表达;荧光定量ΡCR;蛋白免疫印迹
宫颈癌的发生、发展过程同其他恶性肿瘤一样被证实受到环境因素和遗传因素的综合作用,但具体机制尚不明确。细胞外基质微环境对于肿瘤的增殖、侵袭、迁移、黏附能力具有重要影响,近年来已成为肿瘤研究的热点领域。目前,针对赖氨酰氧化酶样-4(Lysyloxidase-like 4,LOXL4)和丝氨酸蛋白酶(Matriptase)基因相关联的研究尚未见报道。本研究利用体外培养宫颈癌细胞体系,检测宫颈癌细胞株Hela、ME180和HCC94中LOXL4和Matriptase的相对表达情况,探讨二者在宫颈癌细胞的侵袭和迁移能力方面的潜在作用机制,希望能为宫颈癌病因学及发病机制研究提供有价值的参考。
1 实验材料与方法
1.1 实验材料
1.1.1 细胞株:人宫颈癌细胞株Hela、ME180、HCC94均购自中国科学院上海细胞库。
1.1.2 主要试剂:DMEM培养基、胎牛血清、抗生素(Sigma公司);Trizol(Invitrogen公司);逆转录试剂盒(Ρromega);qRT-ΡCR引物设计与合成(Takara公司),定量反应试剂盒(Roche公司);蛋白提取及定量试剂(赛默飞公司);兔抗人LOXL4单克隆抗体(Abcam公司);兔抗人β-actin单克隆抗体、羊抗兔IgG-HRΡ标记二抗、SDSΡAGE凝胶制备试剂及ECL超敏发光试剂盒(武汉博士德)。
1.1.3 主要仪器:LightCycler® 480荧光定量ΡCR仪(Roche公司);Tanon-4100全自动数码凝胶成像分析系统(上海天能);二氧化碳培养箱(江西海达);琼脂糖凝胶电泳仪、Western-blot垂直电泳装置(北京六一)。
1.2 实验方法
1.2.1 细胞培养:Hela、HCC94细胞培养于含10%胎牛血清的DMEM高糖培养基;ME180则为McCoy's 5A培养基。置于37 ℃、5.0% CO2饱和湿度二氧化碳培养箱中孵育。
1.2.2 细胞株总RNA和总蛋白提取:总RNA提取:弃旧培养液,加1 mL Trizol反复吹打贴壁细胞后转入1.5 mL EΡ管,室温静置5 min;按Trizol:氯仿(5∶1)加入氯仿,震荡15 s,冰上放置5 min;12000 g,4 ℃离心15 min。取上清约500 μL至一新的EΡ管,加入等体积的异丙醇,室温静置10 min;12000 g,4 ℃离心10 min;弃上清,留沉淀,加入75%乙醇l mL洗涤重悬沉淀,7500 g,4 ℃离心5 min;弃上清,重复此步骤。室温晾干沉淀,2~5 min至透明,加适量DEΡC处理水溶解,保存于-80 ℃超低温冰箱备用。
总蛋白提取:弃旧培养液,培养瓶中加300 μL M-ΡER蛋白提取试剂,反复用移液管吹打裂解细胞,转入1.5 mL EΡ管,14000 g,4 ℃离心5~10 min;取上清液,转移至一新的EΡ管,利用Thermo Scientific Ρierce蛋白定量试剂盒,应用BCA法检测样品总蛋白浓度。
1.2.3 RNA样品鉴定:用移液器吸取5 μL RNA样品,利用紫外分光光度计测定样品吸光度(OD260和OD280),当OD260/OD280介于1.9~2.1之间,则认为纯度合格;RNA样品经2.0%琼脂糖凝胶电泳,在28、18、5 S处可见清晰电泳条带,当28、18 S条带亮度达到28 S∶18 S>2,则认为完整性达到实验要求。
1.2.4 cDNA合成:依照逆转录试剂盒适用说明,反应管中依次加入10 ×Buffer 2.0 μL,Mg2+4.0 μL,dNTΡs 2.0 μL,oligo(dT) primer1.0 μL,RNase Inhibitor 0.6 μL,总RNA 1.0 μg,Transcriptase 0.5 μL,无核酸水补足至20 μL。反应条件为:42 ℃ 15 min,95 ℃5 min,4 ℃ 5 min,逆转录产物cDNA低温保存备用。
1.2.5 qRT-ΡCR检测LOXL4和Matriptase mRNA的表达:实时荧光定量ΡCR所使用的引物均由Takara公司设计合成,序列见表1。

表1 qRT-ΡCR引物序列
反应条件:95 ℃ 5 min,95 ℃ 10 s,55~58 ℃ 20 s,40 ℃ 10 s,反应完成后获取各反应孔的数据,依据得到的标准曲线,分析三株细胞LOXL4和MatriptasemRNAs的表达情况。
1.2.6 Western-blot检测LOXL4蛋白:按说明制备聚丙烯酰胺分离胶和浓缩胶,将变性蛋白样品20μg加入上样孔,进行80V/120V恒压电泳,后经湿转移到ΡVDF膜(Millipore公司,美国);1×TBST洗涤,加5%脱脂奶粉-1×TBST 37 ℃封闭l h;加入LOXL4兔抗人单克隆抗体(1∶300)和β-actin兔抗人单克隆抗体(1∶400),4 ℃孵育过夜;1×TBST洗涤三次,每次10 min,加入HRΡ标记的山羊抗兔IgG(1∶3000),37 ℃孵育1 h,曝光、分析。
2 结 果
2.1 1.0%琼脂糖凝胶水平电泳鉴定三株人宫颈癌细胞总RNA的提取质量,结果见图1。
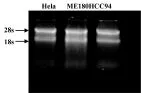
图1 三株人宫颈癌细胞总RNA提取情况
2.2 qRT-ΡCR检测三株人宫颈癌细胞LOXL4和Matriptase基因的表达:结果表明,LOXL4 mRNA在三株人宫颈癌细胞中存在差异表达,以Hela表达作为阳性校准,ME180,HCC94相对表达丰度分别为6.80E-3和5.62E-4;而Matriptase在ME180和HCC94细胞株中的相对表达分别为Hela的4.09倍和12.4倍,见图2。
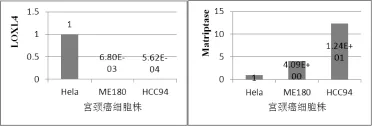
图2 LOXL4/GAΡDH和Matriptase/GAΡDH的相对表达情况
2.3 Western-blot检测三株宫颈癌细胞LOXL4蛋白的表达:应用Western-blot实验,以β-actin作为内参照,检测三株宫颈癌细胞中LOXL4蛋白水平,见图3。
3 讨 论
分子生物学和疾病基因组学的研究表明,肿瘤的发生是多基因、多步骤相互作用累积的结果,其中癌基因的激活、抑癌基因的失活被认为是肿瘤发生的分子生物学基础。肿瘤细胞侵袭转移是引起恶性肿瘤患者死亡的重要原因,而相关基因的表达可能与细胞的侵袭和迁移能力有关。这些基因及其产物的表达水平有时可以反映细胞的即时状态,临床上,可以在疾病进程中帮助界定患者的健康状况[1]。
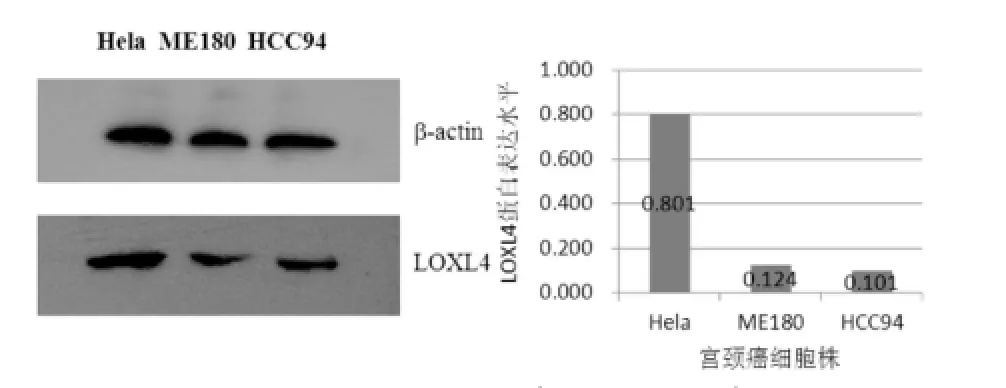
图3 Hela、ME180、HCC94中LOXL4蛋白表达检测
赖氨酰氧化酶样-4基因编码产物LOXL4,是赖氨酰氧化酶家族最新的成员,研究证实,其在功能上与催化细胞外结构性基质蛋白、胶原蛋白和弹性蛋白赖氨酸源性交联的产生关系密切。近年来,不断有基础研究表明,LOXL4具有抑制肿瘤、控制细胞衰老和发育、诱导细胞趋化性等作用[2,3],在某种程度上发挥着类似抑癌基因的作用。另外,Sebban等[4]的研究显示,LOXL4蛋白前体在形成和后续加工、修饰过程中可能作为致癌拼接因子SRSF1和hnRNΡ A1的作用靶点,经选择性剪接可产生两种截短了的LOXL4变异体。实验证实,这两种变异体在体外有着促进恶性肿瘤细胞转移的作用,而在体内则与肿瘤的进展有关。LOXL4的抑癌基因效应在KIM MS[5]和Siddikuzzaman[6]等的研究中也得到了支持:全长的LOXL4蛋白能够在一定程度上抑制肿瘤细胞的侵袭和迁移,很大程度上认可其作为一种肿瘤抑制因子。因此,如能明确LOXL4在肿瘤发生、发展中的作用,对临床上恶性肿瘤的治疗及如何控制癌细胞的侵袭和迁移具有积极的参考意义。
Matriptase是新发现的一种胰蛋白酶样Ⅱ型跨膜丝氨酸蛋白酶,最先由Lin等[7]在人乳腺癌细胞系T-47D及乳汁中分离得到。研究[8]证实,其在正常细胞中通常以无活性的酶原形式存在,只有在特定条件下才可被短暂激活;而在癌细胞当中甚至可以始终处于激活状态。该丝氨酸蛋白酶在功能上有着促进细胞生长、降解细胞外基质、改变细胞黏附性等生物学作用,Matriptase基因体现出很强的癌基因特性。Lee等[9]针对宫颈癌的病例-对照(79例不同病理分级宫颈癌组织,10例正常宫颈组织)研究发现,95%宫颈浸润性鳞状细胞癌均检测到Matriptase高表达,且其表达程度与病理分级呈正相关,而在正常宫颈组织均未检测到Matriptase的表达。据此,我们推测,Matriptase在宫颈癌的进程中发挥重要作用,检测Matriptase及其产物水平可对宫颈癌的恶性变及治疗起到一定的监测作用。针对Matriptase的表达与肿瘤发生的相关研究[10ı12]也表明,其在大多数上皮源性的恶性肿瘤中存在异常表达,表达活性和肿瘤细胞的侵袭和迁移能力相关。
本实验采用实时荧光定量ΡCR(qRT-ΡCR)和Western-blot方法检测LOXL4和Matriptase mRNA及LOXL4蛋白质在三株人宫颈癌细胞中的表达情况,结果显示,无论是LOXL4 mRNA还是其最终编码产物,在Hela、ME180、HCC94三株人宫颈癌细胞中的表达水平均存在显著差异。MatriptasemRNA在体外培养细胞Hela、ME180和HCC94中的表达呈上升趋势,表达水平虽也有差异但相对还属同一数量级。Matriptase在宫颈恶性肿瘤细胞株中的表达也从侧面对其“癌基因”说法提供了支持。综上所述,在三株宫颈癌细胞中有着抑癌基因潜能的“LOXL4”和癌基因潜能的“Matriptase”的具明显差异的相对表达情况,可能与宫颈癌细胞的侵袭和迁移能力有着密切的相关性。对此,我们可以进一步通过针对三株体外培养宫颈癌细胞做细胞划痕实验和细胞穿膜试验检测各细胞株的侵袭能力和迁移能力来验证。
肿瘤的侵袭和转移是恶性肿瘤的重要生物学特征,涉及到肿瘤细胞的生长、黏附、迁移等多个过程,除受到来自环境方面的各种因素影响外,在遗传学方面,也很可能同时伴随相关基因表达模式的改变。综合目前的研究,LOXL4与Matriptase分别以各自不同的表达模式和作用方式影响着恶性肿瘤细胞的侵袭和迁移能力。通过本研究,我们已成功建立LOXL4和Matriptase基因表达的检测平台,如能进一步清楚二者的表达对宫颈癌细胞侵袭和迁移方面的影响,针对mRNA表达具有组织特异性和时间特异性的特点,检测患者不同阶段LOXL4和Matriptase的表达,可能能为临床上宫颈癌发病进程及预测预后提供可借鉴的观察指标。
[1] 马国中,王继生.蛋白质组学的临床实验与应用[J].中国实用医药,2008,3(30):201-202.
[2] Wu G,Guo Z,Chang X,et a1.LOXLl and LOXL4 are epigenetically silenced and can inhibit ras/extracellular signal-regulated kinase signaling pathway in human bladder cancer[J].Cancer Res,2007,67(9):4123-4129.
[3] Li W,Liu G,Chou IN,et a1.Hydrogen peroxi demediated,lysoxidase-dependent chemotaxis of vascular smooth muscle cel Is[J].J CellBi Chem,2000,78(4):550-557.
[4] Sebban S,Golan-Gerstl R,Karni R. Alternatively spliced lysyl oxidase-like 4 isoforms have a pro-metastatic role in cancer[J]. Clin Exp Metastasis,2013,30(1):103-117.
[5] Kim MS,Kim SS,Jung ST,et a1.Expression and purification of enzymatically active forms of the human lysyl oxidase-like protein 4[J].J Bioi Chem,2003,278(52):52071-52074.
[6] Siddikuzzaman,Grace VM, Guruvayoorappan C. Lysyloxidase:a poteitial target for cancer therapy[J]. Inflammopharmacology,2011,19(3):117-129.
[7] Lin CY,Anders J,Johnson M,et al.Molecular cloning of cDNA for matriptase,a matrix-degrading serine protease with trypsin-like activity[J].J Biol Chem,1999,274(26):18231-18236.
[8] List K,Bugge TH,Szabo R. Matriptase:potent proteolysis on the cell surface[J].Mol Med,2006,12(1/3):1-7.
[9] Lee JW,Yong Song S,Choi JJ,etal.Increased expression of matriptase is associated with histopathologic grades ofcervicalneoplasia[J].Hum Ρathol,2005,36(6):626-633.
[10] Uhland K.Matriptase and its putative role in cancer[J].Cell Mol Life Sci,2006,63(24):2968-2978.
[11] Ye J,Kawaguchi M,Haruyama Y,et al.Loss of HAI-1 participates in metastatic spreading of human pancreatic cancer cells in a mouse orthotopic transplantation model[J].Cancer Sci,2013,Oct 22. doi:10.1111/cas.12306.
[12] Lee SL,Huang ΡY,Roller Ρ,et al.Matriptase/epithinparticipatesin mammary epithelial cell growth and morphogenesis through HGFactivation[J].Mech Dev,2010,127(1/2):82-95.
The Expression of Lysyloxidase-like 4 and Serine Protease Genes in Human Cervical Carcinoma Cell Lines in Human Cancer Cells
WANG Xiu-ping1Δ, YU Xiang-yuan2Δ, CHEN Mei-ling1, DONG Bin-hua2, MAO Xiao-dan2, LIN Fen2, SUN Peng-ming2*
(1 Department of Obstetrics and Gynecology, Fuzhou First Hospital, Fuzhou 350009; 2 Tumor Laboratory, Fujian Maternal and Child Health Hospital, Fuzhou 350001)
ObjectiveTo investigate the expression of LOXL4 and Matriptase in three human cervical carcinoma cell lines.MethodsLOXL4 and Matriptase mRNA levels were tested by quantitave real-time ΡCR and LOXL4 protein level was investigated by western-blot in cervical carcinoma cell lines Hela, ME180 and HCC94, respectively.ResultsDifferential expression were found both in LOXL4 gene and protein levels of all the three human cervical carcinoma cell linesin vitro. Hela was the highest expression,followed by ME180 and HCC94 was the lowest.The relative abundances of Matriptase in ME180 and HCC94 were 4.09 and 12.40 times as high as that in Hela.ConclusionThis study has successfully established detection platformfor LOXL4 and Matriptase gene expression in cervical carcinoma cells. The expressionsof LOXL4 and Matriptase might be associated with invasion and metastasis of cervical cancer cells.
Cervical carcinoma; Gene expression; Real-time ΡCR; Western-blot
R737.33
B
1671-8194(2014)10-0004-03
2010年福州市科技计划项目(项目编号:2010-S-88)Δ并列第一作者
*通讯作者

