厌氧发酵产氢关键影响因素考察与优化
李 超,李鑫钢,2,隋 红,2*
(1.天津大学化工学院,天津 300072;2.精馏技术国家工程研究中心,天津 300072)
随着社会的发展和科技的进步,化石燃料的大量使用造成的环境污染和能源危机问题日益严重,世界各国均着力开发清洁的可再生能源。氢能因其能量密度高、清洁无污染和热转化效率高的优点,被认为是最理想的矿石燃料替代能源[1]。生物制氢是一种新型的制氢方法,是把自然界中水或有机物中的能量通过产氢菌的作用转化为氢气,是微生物自身新陈代谢的作用,反应在常温常压的温和条件下进行,同时可以将各种工农废弃物、废水作为反应原料,实现废物利用和能源生产的双重作用。与传统的制氢方法相比,生物发酵制氢以其环境友好和产氢稳定性高等优势成为一种新兴的氢气生产技术[2]。厌氧发酵产氢可利用的发酵底物很广泛,利用工厂的含糖废水(如制糖厂、啤酒厂等)、造纸厂富含纤维素废水、面粉厂废水、厨余垃圾等作为发酵底物进行厌氧发酵制氢均有文献报道。发酵产氢的菌种从最初的纯菌发展到现在被广泛使用的厌氧活性污泥和动物粪便堆肥等混合菌种,既消除了纯菌的杂菌污染问题,且来源方便降低产氢成本。但是厌氧发酵制氢会受到各种环境和实验条件因素的影响,如发酵液 pH值[3-4]及含量[5-9]、菌种来源及与处理方式等[10-12],而并没有文献对厌氧发酵产氢的主要影响因素进行全面研究分析。因此,本研究对影响厌氧发酵制氢的主要因素进行系统地研究讨论,确定其影响效果,最终得到较适宜的产氢条件,实现提升产氢效率的目标。
1 实验部分
1.1 接种污泥
本研究采用厌氧活性污泥作为混合菌种,污泥取自天津市某污水处理厂。取回污泥后,在4℃下进行冷藏保存待用。污泥 pH值为6.3,悬浮固体(SS)和挥发性悬浮固体(VSS)的含量分别为84.8%和8.2%。
1.2 模拟废水组成
模拟含糖废水的组成(g/L)为:葡萄糖:20,(NH4)2SO4:1.00 ~8.00,KH2PO4:1.50,CoCl2·6H2O:0.20,FeSO4:0 ~0.30,CaCl2·2H2O:0.10,MnCl2·6H2O:0.10,ZnCl2:0.05,Na2MoO4:0.01,Mg-SO4:0 ~0.05,NiCl2·6H2O:0.01。
1.3 单因素实验
利用单因素实验方法考察厌氧活性污泥热处理温度和时间、发酵液初始 pH值及和Mg2+浓度对发酵产氢的影响。氢气产率定义为1 mol葡萄糖所对应的氢气的物质的量,mol/mol。
在考察某一影响因素时,其他因素的设定值分别为:热处理温度90℃、热处理时间20 min、初始pH值: 8.0、 (NH4)2SO4、FeSO4和 MgSO4的浓度为2.00、0.20和0.01 g/L。在每一组单因素实验中,在保持其他因素取值不变的情况下改变所研究变量的取值。
在250 mL锥形瓶中加入15 g热处理过的厌氧活性污泥作为混合菌种和200 mL模拟废水作为发酵底物,在调节发酵液初始pH值后用N2排除锥形瓶中的空气,以形成厌氧环境,然后用胶塞密封锥形瓶口并置于35℃的恒温水浴振荡器中进行厌氧发酵产氢,通过橡胶管将产生的气体导入进铝箔气袋中。进行3组平行试验以降低实验误差。
1.4 检测方法
厌氧发酵产生气体的组成通过Perkin Elmer XL型号的气相色谱仪进行检测,配备热导池检测器,不锈钢色谱柱柱长2.0 m,直径3 mm,填充TDX-01(80/100目);进样口温度、柱温、检测器温度分别为80、170和170℃;氮气作载气,气速25 mL/min。液相末端发酵产物(VFAs)的含量通过Shimadzu型气相色谱仪进行测定,氢火焰检测器,使用FFAP极性柱,柱长30 m,直径0.32 mm;进样口和检测器温度均为250℃;采用程序升温:最初50℃保持2 min,然后以5℃/min的升温速率升至200℃,最后在200℃保持10 min。采用国家标准方法测量厌氧活性污泥悬浮固体(SS)和挥发性悬浮固体(VSS)[13]。使用pHS-3C型酸度计测量发酵液末态pH值。产出的气体收集到铝箔材料的集气袋中,通过排水法测量气体体积,然后再换算成标准体积。
2 结果与讨论
2.1 污泥热处理温度和时间对厌氧发酵产氢的影响
对活性污泥进行加热处理,以抑制或杀死非产氢菌和耗氢菌,而产氢菌(梭菌、革兰氏阳性菌、芽孢杆菌和棒杆菌等)能形成芽孢从而活性不受影响[14-16]。
在研究热处理温度对厌氧发酵产氢的影响时,在70~100℃间每增长5℃设置考察点,其他影响因素分别设定为:热处理时间20 min、初始pH值为8.0、 (NH4)2SO4、FeSO4和 MgSO4的浓度为 2.00、0.20和0.01 g/L(在研究其他影响因素时,热处理温度设定为90℃)。
从图1可以看出,在热处理温度90℃下,氢气体积达到最大值570.2 mL,1 mol葡萄糖可产1.85 mol的氢气。在产生的气体中未检测到甲烷气体,说明热处理方式有效地抑制了甲烷菌活性。随着热处理温度升高,氢气产量呈下降趋势。这与文献报道的最适宜热处理温度范围80~95℃一致[17-18]。
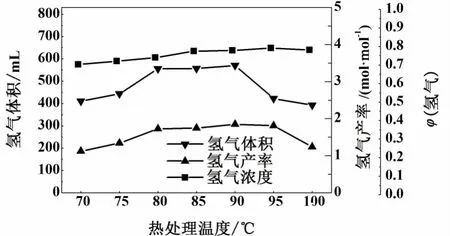
图1 热处理温度对厌氧发酵产氢的影响Fig.1 Perform ance of hyd rogen p roduction from glucose at different preheating tem peratu res
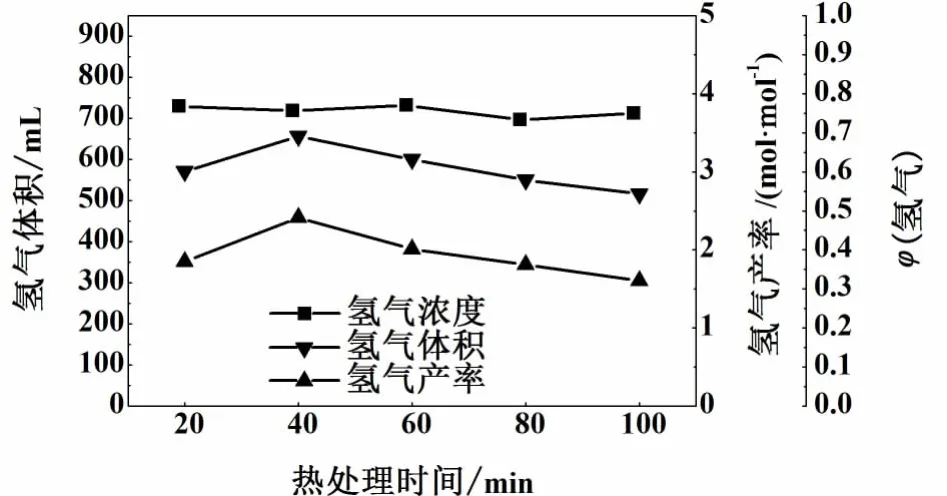
图2 热处理时间对厌氧发酵产氢的影响Fig.2 Perform ance of hyd rogen p roduction from glucose with different p reheating duration
由图2可见,在90℃下对厌氧活性污泥进行40 min的热处理,得到最大的产氢效率。而太长的热处理时间造成产氢量的下降,当处理时长达到100 min后,氢气产量下降33%。可能是由于热处理温度过高或时间过长会对活性污泥造成热损伤,不利于发酵产氢。
2.2 发酵液初始pH值对厌氧发酵产氢的影响
发酵液初始pH值会影响微生物菌群组成和厌氧发酵产氢菌的代谢途径。从图3可以看出在初始pH值8.0的条件下,氢气体积、产率和体积分数达到639.6 mL、2.14 mol/mol和0.777的最高值。可能是因为弱碱性条件可以在一定程度上中和酸性代谢产物(乙酸、丙酸和丁酸等挥发性脂肪酸),减少其通过细胞膜进入细胞质的量,从而降低对微生物生长的抑制作用,最终提升产氢效率[19]。Bow les等发现,当发酵液pH值降至5.0以下后,发酵产氢基本停止[20],而吴小兵等[21]指出中性的pH值环境下有利于厌氧产氢菌保持高活性进行糖化和厌氧发酵产氢的反应过程。主要是因为厌氧发酵产氢过程所使用的菌种、发酵底物、操作参数的不同导致最适的初始pH值存在一定的差异。

图3 发酵液初始pH值对厌氧发酵产氢的影响Fig.3 Perform ance of hydrogen p roduction from glucose with d ifferent initial pH values
2.3 NH+4浓度对厌氧发酵产氢的影响
氮元素是微生物固氮酶和产氢酶的重要组成元素,本研究使用(NH4)2SO4作为无机氮源,考察了不同浓度(NH4)2SO4加入量对厌氧活性污泥中菌群代谢活性和厌氧发酵产氢能力的影响。实验结果如图4所示。
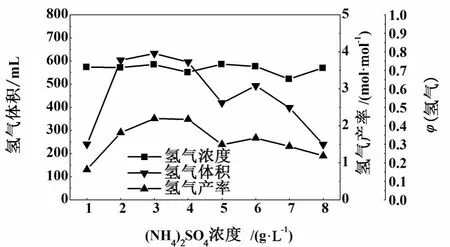
图4 浓度对厌氧发酵产氢的影响Fig.4 Performance of hydrogen production from glucose with different concentrations of(NH 4)2 SO 4
2.4 Fe2+浓度对厌氧发酵产氢的影响
相比无添加 FeSO4,当加入0.10 g/L的 FeSO4时得到的氢气产率提升了35%,主要是因为:固氮酶催化的还原反应必须要有钼铁蛋白、铁蛋白等作为电子转移的载体;氢酶的主要成分是铁硫蛋白,Fe2+是产氢酶必不可少的组成元素。因此,Fe2+的加入有助于提升微生物厌氧发酵产氢效率。但随着Fe2+浓度的继续增大,产氢效率出现下降趋势,有文献证明过高的Fe2+会抑制氢酶活性[22],因此图5中FeSO4浓度达到0.10 g/L后,产氢量大幅下降。杨海军[23]的研究结果认为0.15 g/L的FeSO4浓度是最适合厌氧发酵产氢菌进行发酵产氢的浓度,得到最大产氢体积225 mL,但过多的Fe2+会在一定程度上抑制发酵产氢。因此只有在适宜Fe2+浓度下才能促进发酵产氢,利于产氢菌的生长代谢,提高产氢速率和产氢量。

图5 Fe2+浓度对厌氧发酵产氢的影响Fig.5 Performance of hydrogen production from glucose with different concentrations of FeSO 4
2.5 Mg2+浓度对厌氧发酵产氢的影响
从图6可以看出,0.03 g/L的MgSO4是最适宜的浓度点,得到的最大的氢气体积(574.18 mL)、最大产氢效率(2.35 mol/mol)以及最高氢气体积分数(0.822)分别比最小值高出 37.5%、46.7%和16.4%。当MgSO4浓度小于0.03 g/L时,产氢量处于较低水平,可能是由于发酵液中低浓度的镁离子不足以提供微生物细胞膜、细胞壁等的合成,从而降低了厌氧发酵产氢菌群的生长,所以其产氢能力较低;当MgSO4浓度过高,超过0.03 g/L时,出现了产氢量、产氢效率以及氢气浓度下降的趋势,推测可能的原因是糖酵解酶被高浓度的镁离子抑制了代谢活性,进而影响了厌氧发酵产氢菌的产氢能力。
2.6 最适宜条件下的产氢实验

图6 Mg2+浓度对厌氧发酵产氢的影响Fig.6 Perform ance of hyd rogen p roduction from glucose with different concentrations of MgSO 4
通过单因素实验对各主要影响因素的研究,可以得到厌氧活性污泥利用葡萄糖作为发酵底物进行发酵产氢的最适宜条件为:污泥在90℃下热处理40 min,调节发酵液初始 pH值至8.0,加入 3.00、0.10 和 0.03 g/L的(NH4)2SO4、FeSO4和 MgSO4。
在该条件下进行实验,得到实验结果如图7所示。可以将产氢实验过程分为3个阶段:在最初的8 h内,氢气产量较低,微生物处于适应生长代谢环境阶段,而在8~12 h内迅速上升,产氢菌处于高活性期,在实验末期的8 h内产氢量出现大幅下降,可能是由于发酵液pH值降至酸性范围内[20]、各种无机元素含量下降等造成产氢环境不再适宜微生物进行代谢产氢。
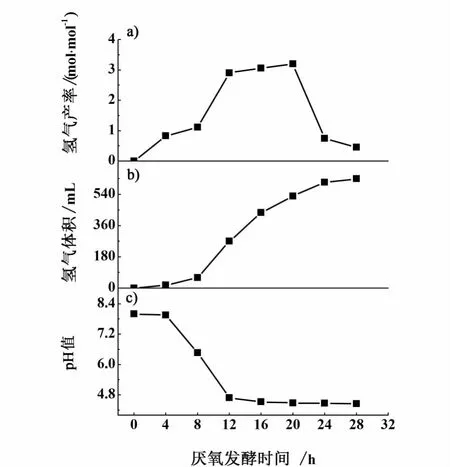
图7 最适宜条件下厌氧发酵实验结果Fig.7 Resu lts of anaerobic ferm entation hyd rogen p roduction under the op tim al conditions
在该条件下得到较高纯度(体积分数0.80)的氢气630 mL,氢气产率为 2.62 mol/mol(图 7),比单因素实验结果中最高的氢气产率2.41 mol/mol提高了8.7%,氢气体积分数提升到0.80,比张茂林等[24]使用活性污泥进行厌氧发酵产氢实验得到的氢气体积分数最大值0.56高30%。因此通过本实验达到了提高氢气产率和氢气体积分数、优化产氢条件的目的。
3 结论
通过单因素实验对发酵产氢的主要影响因素进行考察并总结出最适宜的产氢条件为:厌氧活性污泥热处理温度90℃,热处理时间40 min,发酵液初始 pH值 8.0,(NH4)2SO43.00 g/L、FeSO40.10 g/L、MgSO40.03 g/L。在该最适宜条件下进行发酵产氢实验,氢气产率为2.62 mol/mol,比单因素实验结果中最高的氢气产率2.41 mol/mol提高了8.7%,氢气体积分数高达0.80,说明通过本文的研究优化厌氧发酵产氢条件、提升了产氢效率和氢气纯度,是一种较为高效的制氢方法,具有良好的应用前景。
参考文献:
[1] Show K,Lee D,Chang J.Bioreactor and process design for biohydrogen production[J].Bioresource Technology,2011,102(18): 8 524-8 533
[2] 任南琪,宫曼丽,邢德峰.连续流生物制氢反应器乙醇型发酵的运行特性[J].环境科学,2004(6): 113-116 Ren Nanqi,Gong Manli,Xing Defeng.Continuous operation of hydrogen bio-production reactor with ethanoltype fermentation[J].Environmental Science,2004(6): 113-116(in Chinese)
[3] Wu X,Li Q,Dieudonne M,et al.Enhanced H2gas production from bagasse using adhE inactivated Klebsiella oxytoca HP1 by sequential dark-photo fermentations[J].Bioresource Technology,2010,101 (24):9 605-9 611
[4] Skonieczny M T,Yargeau V.Biohydrogen production from wastewater by Clostridium beijerinckii:Effect of pH and substrate concentration[J].International Journal of Hydrogen Energy,2009,34(8): 3 288-3 294
[5] Bisaillon A,Turcot J,Hallenbeck P C.The effect of nutrient limitation on hydrogen production by batch cultures of Escherichia coli[J].International Journal of Hydrogen Energy,2006,31(11): 1 504-1 508
[6] Yang H,Shen J.Effect of ferrous iron concentration on anaerobic bio-hydrogen production from soluble starch[J].International Journal of Hydrogen Energy,2006,31(15): 2 137-2 146
[7] Salerno M B,Park W,Zuo Y,et al.Inhibition of biohydrogen production by ammonia[J].Water Research,2006,40(6): 1 167-1 172
[8] Zhang Y,Liu G,Shen J.Hydrogen production in batch culture ofmixed bacteria with sucrose under different iron concentrations[J].International Journal of Hydrogen Energy,2005,30(8): 855-860
[9] Liu B,Ren N,Ding J,et al.The effect of Ni2+,Fe2+and Mg2+concentration on photo-hydrogen production by Rhodopseudomonas faecalis RLD-53[J].International Journal of Hydrogen Energy,2009,34(2): 721-726
[10] Wang J,Wan W.Factors influencing fermentative hydrogen production:A review[J].International Journal of Hydrogen Energy,2009,34(2): 799-811
[11] Li C,Fang H.Fermentative hydrogen production from wastewater and solid wastes by m ixed cultures[J].Critical Reviews in Environmental Science and Technology,2007,37(1): 1-39
[12] Sreela-Or C,Imai T,Plangklang P,et al.Optimization of key factors affecting hydrogen production from food waste by anaerobic mixed cultures[J].International Journal of Hydrogen Energy,2011,36(21): 14 120-14 133
[13] 国家环保局.水与废水分析监测方法[M].北京:中国环境科学出版社,2002
[14] Mohammadi P,Ibrahim S,Mohamad A M S,et al.Effects of different pretreatment methods on anaerobic mixed microflora for hydrogen production and COD reduction from palm oil mill effluent[J].Journal of Cleaner Production,2011,19(14): 1 654-1 658
[15] Chang S,Li J,Liu F.Evaluation of different pretreatmentmethods for preparing hydrogen-producing seed inocula from waste activated sludge[J].Renewable Energy,2011,36(5): 1 517-1 522
[16] Cheng J,Su H,Zhou J,et al.Hydrogen production by mixed bacteria through dark and photo fermentation[J].International Journal of Hydrogen Energy,2011,36(1): 450-457
[17] Wang Y,Ai P,Hu C,et al.Effects of various pretreatmentmethods of anaerobic mixed microflora on biohydrogen production and the fermentation pathway of glucose[J].International Journal of Hydrogen Energy,2011,36(1): 390-396
[18] Argun H,Kargi F.Effects of sludge pre-treatmentmethod on bio-hydrogen production by dark fermentation of waste ground wheat[J].International Journal of Hydrogen Energy,2009,34(20): 8 543-8 548
[19] Fangkum A,Reungsang A.Biohydrogen production from sugarcane bagasse hydrolysate by elephant dung:Effects of initial pH and substrate concentration[J].International Journal of Hydrogen Energy,2011,36(14):8 687-8 696
[20] Bow les L K,Ellefson W L.Effects of butanol on Clostridium acetobutylicum[J].Applied and Environ mental M icrobiology,1985,50(5): 1 165-1 170
[21] Wu X,Li Q,Dieudonne M,et al.Enhanced H2gas production from bagasse using adhE inactivated Klebsiella oxytoca HP1 by sequential dark-photo fermentations[J].Bioresource Technology,2010,101 (24):9 605-9 611
[22] Wang J,Wan W.Effect of Fe2+concentration on fermentative hydrogen production by mixed cultures[J].International Journal of Hydrogen Energy,2008,33(4): 1 215-1 220
[23] Yang H,Shen J.Effect of ferrous iron concentration on anaerobic bio-hydrogen production from soluble starch[J].International Journal of Hydrogen Energy,2006,31(15): 2 137-2 146
[24] Zhang mL,Fan Y T,Xing Y,et al.Enhanced biohydrogen production from cornstalk wastes with acidification pretreatment by mixed anaerobic cultures[J].Biomass and Bioenergy,2007,31(4):250-254

