猪2型链球菌安徽分离株的毒力基因、溶血性及耐药性分析
焦安心,许大文,赵洪武,程 谦,郑 浩,马建华,魏建忠,孙 裴,李 郁
猪链球菌(Streptococcussuis,S.suis)是世界范围内引致猪链球菌病最主要的病原,根据荚膜多糖可将S.suis分为35个血清型,即1型~34型和1/2型,其中2型(Streptococcussuisserotype 2,S.suis2)对猪的致病性最强,在世界范围流行最广,而且是重要的人兽共患病病原菌之一[1]。
S.suis2的致病性与其携带的毒力因子密切相关,目前公认的主要毒力因子有荚膜多糖(Capsular polysaccharide,CPS)、溶菌酶释放蛋白(Muramidase-released protein,MRP)、胞外因子(Extracellular protein factor,EPF)和溶血素(Suilysin,SLY)等[2]。S.suis2毒力基因的分布具有地域性差异,不同地区S.suis2分离株可能含有不同的毒力因子,这是S.suis2不同分离株毒力不同的重要原因[3]。SLY在S.suis2侵入和裂解细胞的过程以及导致脑膜炎过程中发挥重要作用,溶血类型及溶血价常作为初步判断其致病力强弱的重要指标之一[4]。目前,由于抗生素不合理应用,S.suis2耐药现象日益严重,不同地区在抗生素的选择压力下,S.suis2的耐药表型出现了地域性差异。
本研究通过对来自兽医临床上19株S.suis2安徽分离株的毒力基因、溶血性及耐药性进行检测分析,旨在为进一步研究S.suis2 安徽分离株的致病性奠定基础,为有效防控猪链球菌病提供科学依据。
1 材料和方法
1.1受试菌株 19株S.suis2安徽分离株由安徽农业大学动物科技学院传染病研究室分离、鉴定与保存,主要来自合肥、阜阳、亳州、安庆、宿州和蚌埠等地区。
1.2质控菌株 肺炎链球菌ATCC49619 购于中国食品药品检定研究院。
1.3主要试剂 胰酪胨大豆酵母浸膏肉汤(TSB-YE)、胰酪胨大豆酵母浸膏琼脂(TSA-YE)、水解酪蛋白琼脂(M-H)购自绍兴天恒生物科技有限公司;2×TaqPCRMasterMix,DNA Marker D2000、DNA Marker I均购自北京天根生化有限公司;25种药敏纸片:氨苄西林(AMP)、阿莫西林(AMX)、头孢唑啉(CFZ)、头孢呋辛(CXM)、头孢他啶(CAZ)、新霉素(NEO)、庆大霉素(GEN)、卡那霉素(KAN)、丁胺卡那霉素(AN)、红霉素(E)、阿奇霉素(AZZ)、吉他霉素(KIT)、四环素(TET)、强力霉素(DOX)、恩 诺 沙 星 (ENR)、环丙沙星(CIP)、氧氟沙星(OFX)、克林霉素(CM)、洁霉素(LIN)、杆菌肽(BAC)、复方新诺明(SXT)、甲氧苄啶(TMP)、磺胺异恶唑 (SIZ)、氟苯尼考(FLO)、利福平(RA)均购于杭州天和微生物试剂有限公司。
1.4毒力基因检测 参考文献[5-6]分别针对cps2J、mrp、epf、sly合成引物(见表1),特异性引物均由上海生物工程技术有限公司合成。
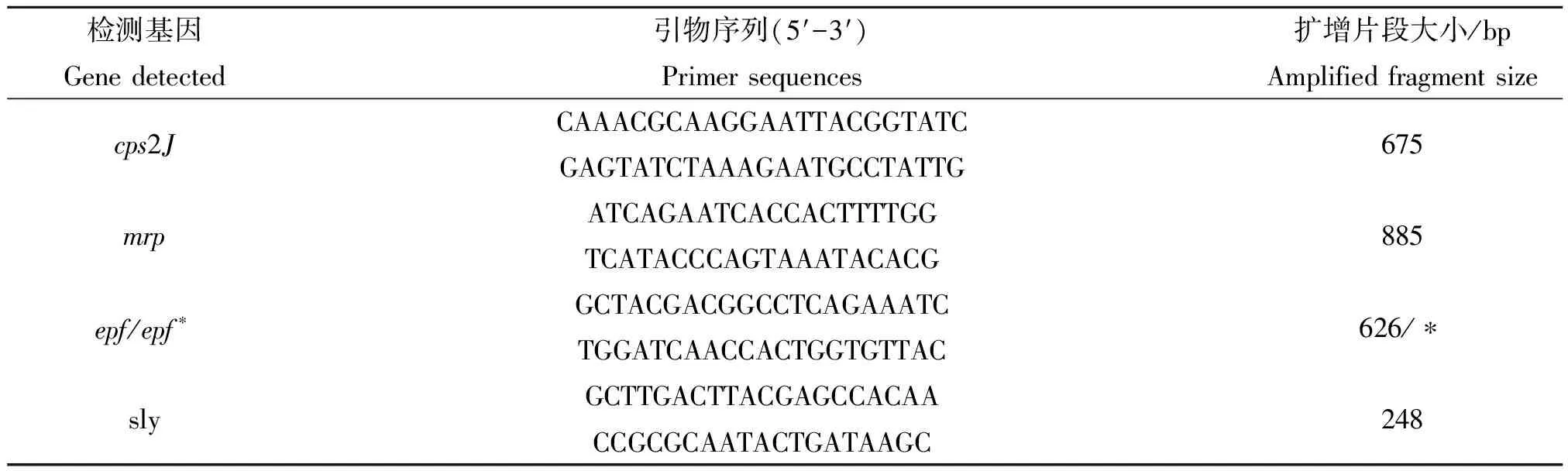
表1 用于扩增四种毒力因子的PCR引物
采用裂解法提取细菌DNA:挑取单菌落接种到含有5%血清的TSB中,培养24 h,取1 mL菌液加入1.5 mL离心管中,10 000 r/min 离心5 min,弃上清液,加入100 μL灭菌ddH2O混匀,置沸水中煮沸10 min,冰浴10 min,10 000 r/min离心10 min,取上清液,即为DNA模板。
PCR扩增的反应体系:总体积25 μL ,其中2×TaqPCRMasterMix12.5 μL,ddH2O 5.5 μL,上下游引物各1 μL,模板5 μL。反应条件:95 ℃ 预变性5 min;95 ℃ 变性45 s,cps2J、mrp、epf、sly退火温度及时间分别为56 ℃ 50 s、55 ℃ 1 min、60 ℃ 55 s、58 ℃ 1 min,72 ℃ 延伸1 min,扩增30个循环;72 ℃ 延伸10 min。PCR扩增产物经琼脂糖凝胶电泳检测。
1.5溶血性检测
1.5.1PA法检测溶血类型 将19株S.suis2安徽分离株接种于含5%兔血的TSA平板,37 ℃培养24 h后观察菌落周围溶血状态。单菌落周围有透明溶血环的菌株判定为β溶血;单菌落周围有草绿色溶血环的菌株判定为α溶血;不发生溶血的菌株为γ溶血。
1.5.2micro-ELISA法检测溶血价 参考文献[4,7]测定菌株溶血价,将各菌株接种于含5%血清的TSB,37 ℃静止培养24 h制成种子液,取种子液按1%比例接种于含5%血清的TSB,37 ℃静止培养,接种后8 h、12 h、16 h、20 h和24 h取培养液,12 000 r/min离心5 min,取上清,10 mmol/L Tris-HCl(pH 7.8)生理盐水倍比稀释,将不同倍数稀释的上清液和等量的1%兔红细胞加入96孔板中,振荡混匀,37 ℃作用2 h,4 ℃过夜沉淀,测OD540。溶解50%红细胞的上清液的稀释倍数即为溶血价,以5个时间点中测定的最高溶血价作为该菌株的溶血价。
1.6药物敏感性检测 以肺炎链球菌ATCC49619为质控菌株,采用美国临床实验室标准化委员会推荐的Kirby-Bauer纸片琼脂扩散法及判定标准[8]。
2 结 果
2.1毒力基因检测 19株S.suis2安徽分离株cps2J、mrp、epf和sly基因的检出率分别为100%、68.4%、68.4%、89.5%,共分为7个基因型:cps2J+/mrp+/epf+/sly+、cps2J+/mrp+/epf-/sly+、cps2J+/mrp+/epf-/sly-、cps2J+/mrp-/epf+/sly+、cps2J+/mrp-/epf-/sly+、cps2J+/mrp-/epf-/sly-,其中cps2J+/mrp+/epf+/sly+所占比例达57.9%,为优势基因型(见表2)。
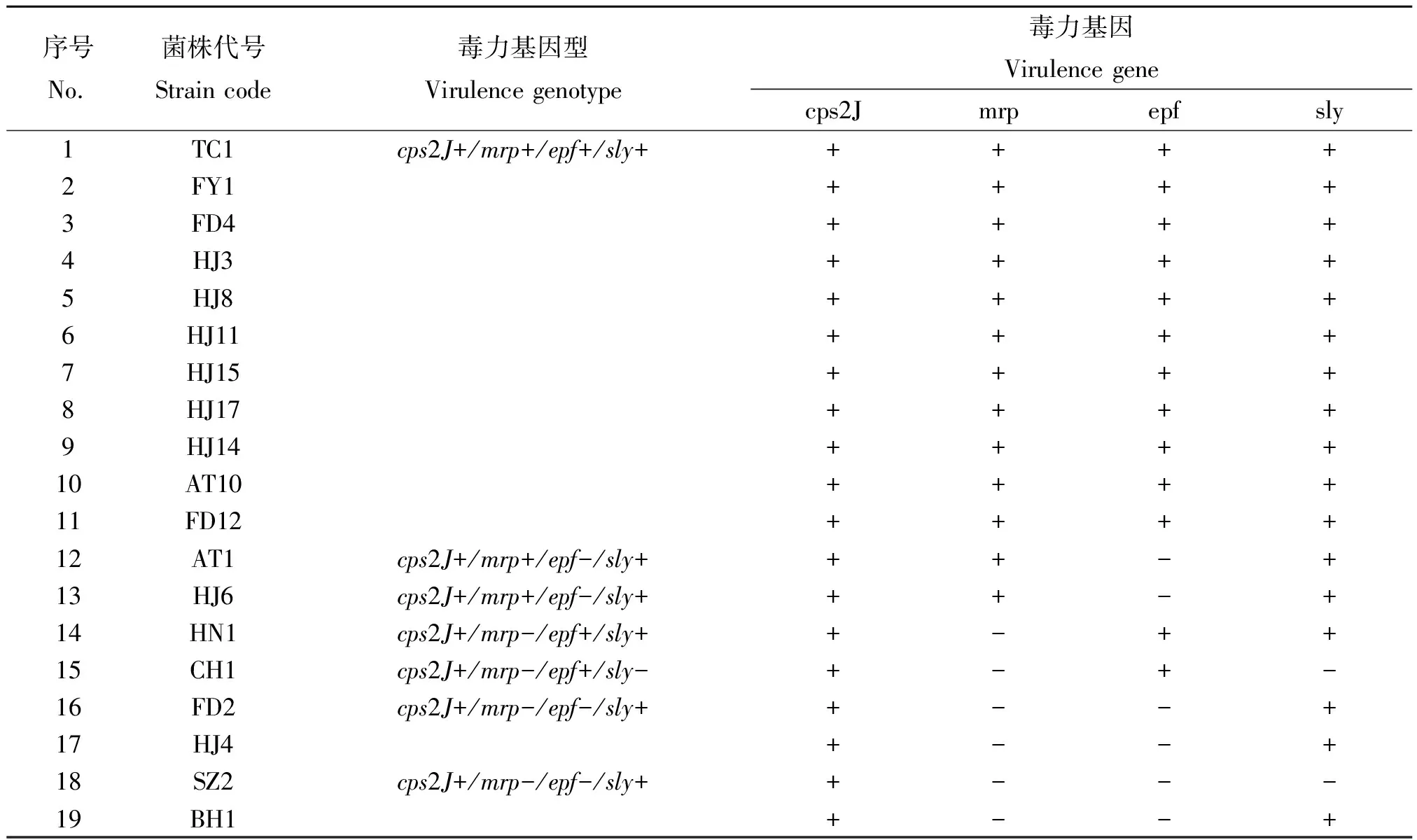
表2 19株S. suis 2安徽分离株毒力基因检测结果
2.2溶血性检测 在19株S.suis2安徽分离株中,13株呈α溶血,溶血价为1∶4~1∶32;6株呈β溶血,溶血价为1∶32~1∶128。其中CH1溶血价为1∶64(β溶血),SZ2溶血价为1∶32(α溶血),未检出sly基因。各菌株溶血类型、溶血价结果见表3。

表3 19株S. suis 2安徽分离株的溶血性
2.3药物敏感性检测 19株S.suis2安徽分离株对利福平、头孢他啶、氟苯尼考、头孢唑啉的敏感率较高,分别达到89.5%、89.5%、78.9%、78.9%,对强力霉素、四环素、杆菌肽和磺胺异恶唑的耐药率较高,分别为84.2%、84.2%、84.2%、78.9%;分离菌株普遍对氨基糖苷类抗生素耐药或中介(见表4)。19株S.suis2安徽分离株均耐3种以上抗生素,且多重耐药谱为强力霉素、四环素、杆菌肽和磺胺异恶唑,构成比为63.2%(见表5)。
3 讨 论
目前虽然对S.suis2致病机制并不十分清楚,但普遍认为其致病性强弱与其毒力基因有关。cps2J、mrp、epf、sly是S.suis2重要的毒力基因,常作为检测的靶基因,然而在不同的S.suis2分离株中,其分布特征存在着地区性差异。2009年,Verena Blume等[9]检测101株源自脑膜炎、败血症、关节炎或肺炎猪体的S.suis2,cps2J+/mrp+/epf+/sly+的菌株所占比例为33.7%;同年,Wei等[10]针对我国16个省份,检测176株源自脑膜炎、肺炎、关节炎或心内膜炎猪体的S.suis2,cps2J+/mrp+/epf+/sly+的菌株所占比例为54%。本研究中,来自临诊患病猪的19株S.suis2安徽分离株cps2J+/mrp+/epf+/sly+的菌株所占比例为57.9%,表明安徽地区猪群中S.suis2的毒力基因型与国内相关报道基本一致,而与国外的报道存在一定差异。此外,不同健康状况猪体上的S.suis2分离株中,cps2J、mrp、epf、sly的分布特征也存在差异。2000年,Florence等[2]同时对分离自患病猪和健康猪体的S.suis2进行检测,54株源自患病猪体的S.suis2,cps2J+/mrp+/epf+/sly+的菌株占35.2%,9株源自健康猪的S.suis2,cps2J+/mrp+/epf+/sly+的菌株仅占30%;2013年,纪少博等[11]检测194株源自我国不同地区健康猪上的S.suis2,cps2J+/mrp+/epf+/sly+的菌株为33.5%。从而显示cps2J、mrp、epf、sly4种毒力基因与S.suis2的致病力强弱相关。
根据链球菌在血琼脂平板上的溶血现象分为α、β和γ共3类,α-溶血性链球菌多为条件致病菌,β-溶血性链球菌致病力强,而γ-链球菌无致病性,故溶血性在鉴定链球菌的致病性方面有一定的意义。本研究中,19株S.suis2安徽分离株在兔血平板上呈现α和β两种溶血类型,表明不同S.suis2安徽分离株对兔红细胞溶血能力的差异性及其致病力的不同。链球菌溶血性的形成与其产生的SLY相关,SLY的产生量可以用溶血价来衡量。本研究中19株S.suis2,β溶血菌株的溶血价(1∶32~1∶128)高于α溶血菌株(1∶4~1∶32),表明β溶血菌株能产生较多SLY,其毒力可能强于α溶血菌株,因为决定S.suis2毒力大小的因子是多方面的。SLY由sly基因编码,sly基因全长1 494 bp,其5′端可发生变化,从而使sly基因丧失完整性,但这种不完整性却没有改变其溶血特性,甚至不影响其毒力大小[12]。本研究中,19株S.suis2安徽分离株均具有溶血活性,但其中1株β溶血和1株α溶血菌株未检出sly基因,表明这两株S.suis2安徽分离株的sly基因发生了改变。
抗生素疗法是目前治疗猪链球菌病的重要手段,由于临床上滥用、乱用抗生素现象普遍,导致细菌耐药性增强,给该病的防治带来一定困难。本研究中,19 株S.suis2安徽分离株均为多重耐药,其中对强力霉素、四环素、杆菌肽和磺胺异恶唑的耐药率较高,分别为84.2%、84.2%、84.2%、78.9%,且对该4种抗生素的多重耐药率达63.2%,对氨基糖苷类抗生素的耐药率也较高(50%以上),且中敏率高达42.1%,显示出向产生耐药性发展的趋势,应得到足够的重视。2005年,Vela等[13]报道,22株S.suis2法国分离株对四环素类、大环内酯类、磺胺类、林克酰胺类多重耐药率达68.2%。2010年,徐引弟等[14]对35株S.suis2河南分离株药敏试验结果显示,对复方新诺明、庆大霉素、四环素、链霉素、万古霉素、氯霉素的耐药情况严重。表明在抗生素选择的压力下,不同地区S.suis2分离株的耐药特性及多重耐药性谱存在一定的差异,因此,适时监测S.suis2的耐药性及其变化趋势,药敏试验筛选药物,合理、科学、规范用药,有利于减少和控制耐药菌株的产生,对有效防控S.suis2病具有十分重要的意义。
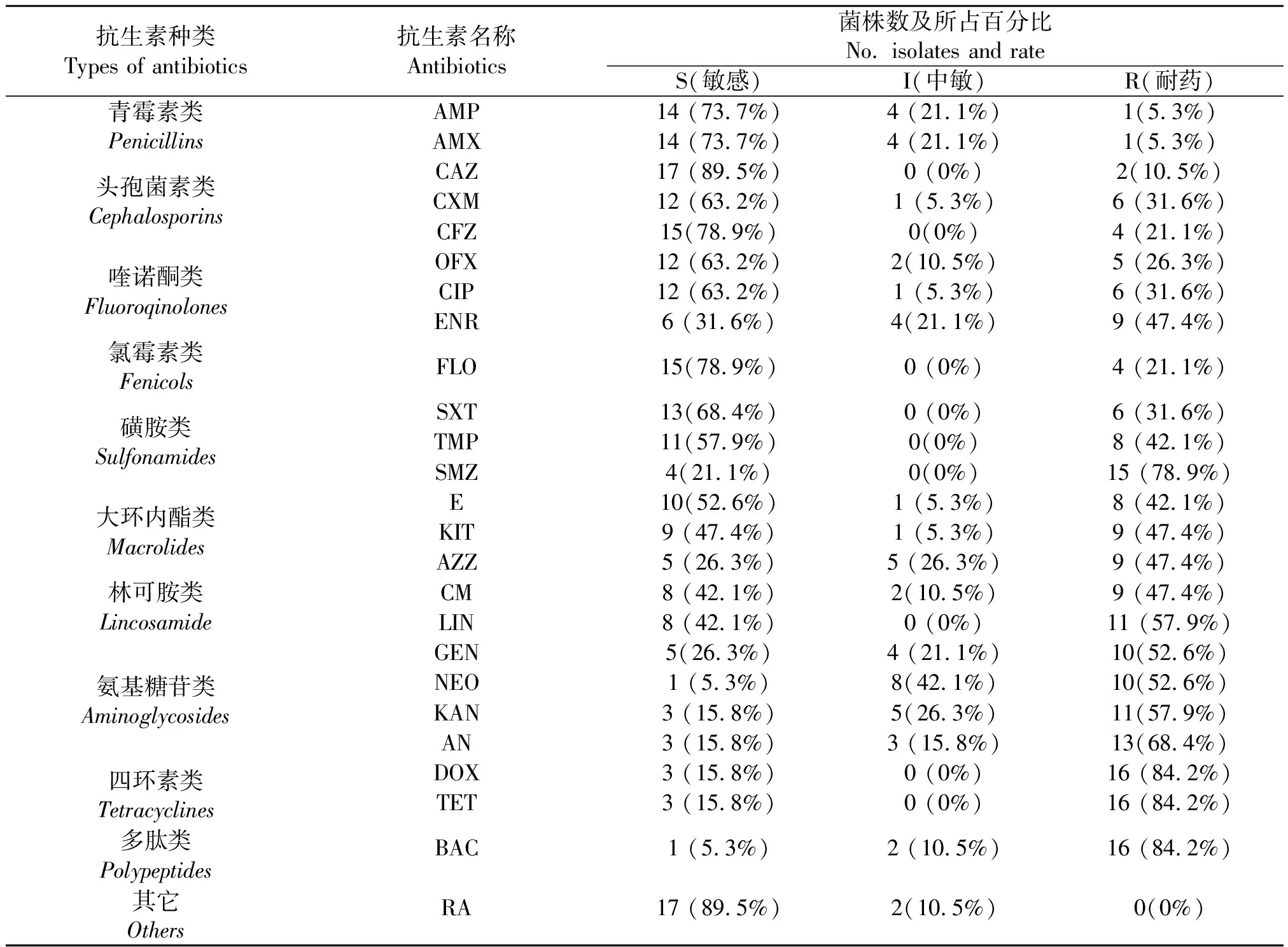
表4 19株S. suis 2安徽分离株的药物敏感程度分布
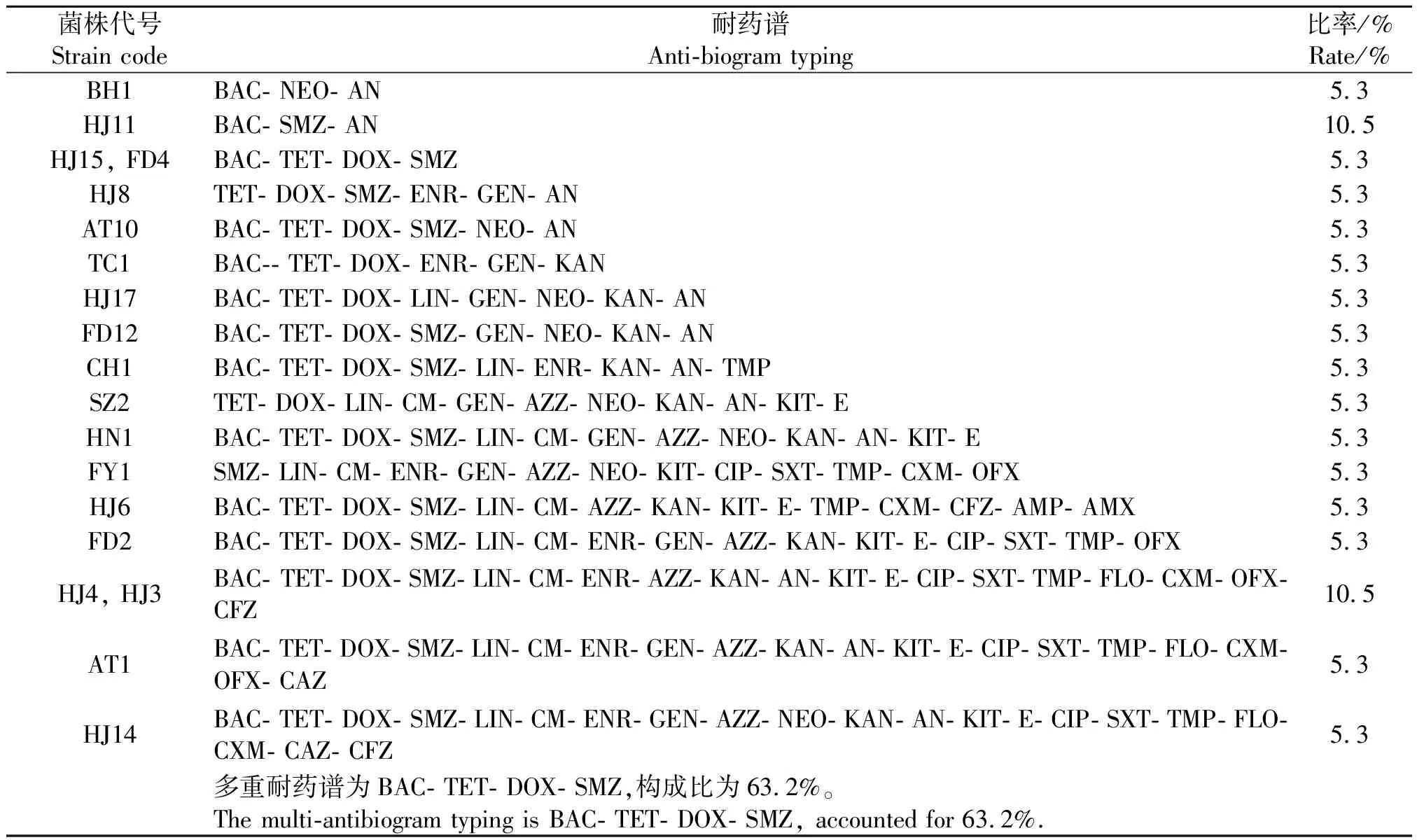
表5 19株S. suis 2安徽分离株多重耐药谱的分布
参考文献:
[1]Marcelo G, Annie L, Henk W, et al. Production of virulence-related proteins by Canadian strains ofStreptococcussuiscapsular type 2[J]. Can J Vet Res, 1998, 62: 75-79.
[2]Berthelot HF, Morvan H, Keribin AM, et al. Production of muraminidase-released protein (MRP), extracellular factor (EF) and suilysin by field isolates ofStreptococcussuiscapsular types 2, 1/2, 9, 7 and 3 isolated from swine in France[J]. Vet Res, 2000, 31(5): 473-479.
[3]Martinez G, Pestana de Castro AF, Ribeiro Pagnani KJ, et al. Clonal distribution of an atypical MRP+, EF*, and suilysin+ phenotype of virulentStreptococcussuisserotype 2 strains in Brazil[J]. Can J Vet Res, 2003, 67(1):52-55.
[4]Chen GQ, Yao HC, Lu CP, et al. Effects of cultural conditions on yield of Hemolytic toxin byStreptococcussuisand its characterization[J]. J Najing Agr Univ, 2000, 23(3): 71-75. (in Chinese)
陈国强, 姚火春, 陆承平, 等. 猪链球菌2型溶血毒素的产生条件及其特性分析[J]. 南京农业大学学报, 2000, 23(3): 71-75.
[5]Silva LM, Baums CG, Rehm T, et al. Virulence-associated gene profiling ofStreptococcussuisisolates by PCR[J]. Vet Microbiol, 2006, 115(1-3): 117-127.
[6]Wisselink HJ, Reek FH, Vecht U, et al. Detection of virulent strains ofStreptococcussuistype 2 and highly virulent strains ofStreptococcussuistype 1 in tonsillar specimens of pigs by PCR[J]. Vet Microbiol, 1999, 67(2): 143-157.
[7]Hu M, Pan ZH, Lu CQ, et al. Biological characterization of epidemic Aeromonas hydrophilastrains[J]. Chin Vet Sci, 2013, 43(05): 441-445. (in Chinese)
胡萌,潘子豪,陆承平,等. 嗜水气单胞菌流行菌株的生物学特性[J].中国兽医科学,2013,43(05): 441-445.
[8]Clinical and Laboratory Standards Institute/NCCLS. Performance standards for antimicrobial susceptibility testing, Fifteent informational supplement. CLSI/NCCL Sdocument M100-S15[S]. Wayne: Pennsylvania, Clinical and Laboratory Standards Institute, 2005, 25(1): 1.
[9]Blunme V, Luque I, Vela AI, et al. Genetic and virulence-phenotype characterization of serotypes 2 and 9 ofStreptococcussuisswine isolates[J]. Int Microbiol, 2009, 12(3): 161-166.
[10]Wei Z, Li R, Zhang A, et al. Characterization ofStreptococcussuisisolates from the diseased pigs in China between 2003 and 2007[J]. Vet Microbiol, 2009, 137(1/2): 196-201. DOI: 10.1016/j.vetmic.2008.12.01
[11]Ji SB, Bai XM, Liu K, et al. Detection rate ofStreptococcussuisin healthy pig in different regions of China[J]. Chin J Zoonoses, 2013, 29(5): 423-426. (in Chinese)
纪少博,白雪梅,刘凯,等.我国不同地区健康猪猪链球菌检出率调查[J].中国人兽共患病学报,2013, 29(5): 423-426.
[12]Staats JJ, Plattner BL, Stewart GC, et al. Presence ofStreptococcussuisSuilysin gene and expression of MRP and EF correlates with high virulence inStreptococcussuistype 2 isolates[J]. Vet Microbiol, 1999, 70(3/4): 201-211.
[13]Vela AI, Moreno MA, Cebolla JA, et al. Antimicrobial susceptibility of clinical strains ofStreptococcussuisisolated from pigs in Spain[J]. Vet Microbiol, 2005, 105(2): 143-147.
[14]Xu YD, Wang ZW, Zhu WH, et al. Isolation, identification and drug susceptibility ofStreptococcussuis2 from large-scale pig farms in Henan Province[J]. China Anim Husb Vet Med, 2005, 105(2): 143-147. (in Chinese)
徐引弟, 王治方, 朱文豪, 等. 河南省规模化猪场猪链球菌2型的分离鉴定和药敏试验[J]. 中国畜牧兽医, 2010, 37(1): 155-157.

