结核分枝杆菌H37Ra抗结核作用相关研究进展
樊 超,张万江
结核病是一种古老的疾病。据统计全世界约有1 /3的人口感染结核分枝杆菌(Mycobacteriumtuberculosis,MTB) ,每年大约有200万结核病患者死亡,90% 的感染者为潜伏感染,病原体以休眠的方式存在于机体内,约有 10%的感染者为活动性结核患者[1]。
从1921年至今,由牛结核分枝杆菌减毒株制成的卡介苗(Bacillus Calmette-Guerin vaccine, BCG)是世界上唯一获准用于预防结核病的疫苗,由于其价廉与高安全性的特性,全球有大约有40亿人接受BCG免疫[2]。但目前研究发现卡介苗对结核病的预防作用十分有限,在不同的人群,其免疫保护作用差异较大,效果不稳定,尽管BCG在预防小儿结核发病和防止重症化上曾发挥过相当有效的作用,但对青春期或成人追加接种并未证实能取得如同乳儿期初次接种那样的效果[3]。迄今为止成年人的肺结核是结核病传播的重要来源,可是卡介苗并没有控制疾病的传播,并且给AIDS等免疫功能受损的患者接种卡介苗后还可能导致严重的播散性结核病[4],全球20亿人感染结核分枝杆菌但大多数人都没有明显的临床症状,在这样的潜伏感染者中,主要是由病原体与机体免疫细胞相互作用的结果[5]。接种卡介苗后,还会对结核病患者的实验室诊断产生一定的影响。鉴于上述特点,目前许多研究者都在致力于研制新型的安全的高效的结核病疫苗。
1 结核分枝杆菌H37Ra菌株抗结核作用特点
近年来,由于分子生物学技术的发展与应用,使得新型候选疫苗大量涌现,如佐剂联合疫苗、重组BCG疫苗、DNA疫苗、蛋白质亚单位疫苗等。但是结核分枝杆菌是典型的胞内寄生菌,其免疫主要依靠细胞免疫,因此全菌免疫也许优于其他候选的新型疫苗。同时,结核病免疫属于传染性免疫,选用活菌作为疫苗有其独特的作用。近年来的研究表明:活菌疫苗的免疫原性要比灭活菌疫苗的免疫原性强得多:它免疫接种量小,在体内可以长期存活生存繁殖,抗原可以持续刺激免疫系统,从而可引发持久的免疫应答。H37Ra菌株是由人型结核分枝杆菌有毒株H37Rv菌株减毒而来的无毒株, 基本上保留了有毒株的免疫原性,对人毒力极弱,对宿主相对安全, 国外有学者已经通过体外实验证实H37Ra菌株与BCG在人源性巨噬细胞内的繁殖速度远远低于结核分枝杆菌毒株H37Rv菌株,同时BCG毒力下降的同时伴随着抗原性的减弱, 缺少了RD1和RD2区域编码的ESAT6、CFP10、MPT64抗原蛋白质[6]而H37Ra含有这些缺失的编码区,这些表明了H37Ra的免疫原性好、毒力较低、用着疫苗可能比较安全有效。近年来也有学者研究表明, H37Ra菌株能充分活化巨噬细胞,因此人型结核分枝菌H37Ra菌株作为候选减毒活疫苗具有相对优势。
2 结核分枝杆菌H37Ra菌株能在宿主体内长期定植
活疫苗必备的基本条件之一是要能在宿主体内定植,且定植时间的长短应能诱导宿主发生记忆免疫。实验发现H37Ra菌株在小鼠脾脏内的生存时间超过两个月,这表明H37Ra菌株可在小鼠脾脏内长期生存。小鼠脾脏富含淋巴细胞,因此H37Ra菌株可长期刺激小鼠的免疫系统,从而引发持久的记忆免疫。与脾脏内的定植相似, H37Ra菌株可在小鼠肺脏内长期定植。但H37Ra菌株和BCG同期在脾脏中定植的细菌数超过肺脏中定植的细菌数,此结果可能与脾脏和肺脏的解剖学特点及功能相关。H37Ra菌株和BCG分别经皮内接种小鼠后,局部的巨噬细胞发挥第一线防御作用--将它们吞噬。在H37Ra菌株和BCG免疫小鼠的初期,由于体内无抗结核分枝杆菌的特异性免疫,因而巨噬细胞不能立即杀灭胞内吞噬的H37Ra菌株或BCG。这些巨噬细胞经淋巴血液循环将H37Ra菌株或BCG 播散至全身。脾脏是小鼠重要的外周免疫器官,同时它又是血细胞的“滤过器”,因而大多吞噬了H37Ra菌株或BCG的巨噬细胞会停留在脾脏中,它们通过与T淋巴细胞相互作用,从而诱发特异性的免疫应答。H37Ra菌株及BCG尚具有一定的毒力,因而可在小鼠脾脏中继续繁殖一段时间。小鼠的肺脏不是免疫器官,因此只有少量吞噬了H37Ra菌株或BCG的巨噬细胞经血循环定居于肺脏,所以肺脏中定植的H37Ra菌株或BCG较少。Williams 等[7]发现BCG免疫动物抵抗牛分枝杆菌攻击的保护效果优于抵抗结核分枝杆菌的攻击。因而对于预防大多由结核分枝杆菌感染所致的结核病来说,H37Ra菌株具有BCG不可比拟的优越性[8]。
3 结核分枝杆菌H37Ra菌株感染机体后能诱导巨噬细胞的充分活化
MTB为典型的胞内致病菌,胞内菌清除主要依赖于固有免疫和诱导保护性细胞免疫。侵入机体的MTB既可被巨噬细胞吞噬和杀灭,也可通过多种特殊受体介导的内吞途径,阻止吞噬溶酶体的形成以及抗活性氧、活性氮等途径逃避杀伤机制而在巨噬细胞中存活、繁殖。对于胞内菌特异性免疫,普遍认为CD4T细胞产生IFN-γ是激活巨噬细胞抗菌活性的主要因素。巨噬细胞另一重要功能是对MTB抗原有呈递作用。巨噬细胞加工和提呈MTB抗原给T淋巴细胞,刺激特异性CD4T细胞增殖,并可与T细胞相互刺激其功能,从而放大特异性免疫效应。由T淋巴细胞和巨噬细胞介导的细胞免疫是机体抵抗MTB的主要防御机制,其中巨噬细胞不仅在非特异性甚至在特异性防御中,都起着非常重要的作用[9]。
巨噬细胞的抗结核分枝杆菌机制可分为氧依赖性和非氧依赖性两类。非氧依赖型抗结核分枝杆菌活性包括众多因素,如低pH、阳离子酸、溶菌酶、酸性和中性水解酶等。巨噬细胞吞噬MTB后,在细胞内形成吞噬小体。激活的巨噬细胞可引起呼吸爆发,产生大量活性氧介质(如H2O2),并诱导产生NO合成酶,合成大量活性氮介质(如NO),消灭吞噬小体内的MTB,或者抑制MTB繁殖,发挥抗菌作用。NO是活化巨噬细胞杀灭MTB的重要效应分子,而氧介质与氮介质的联合作用则能明显增强巨噬细胞杀灭MTB功能[10-11]。与此同时,活化的巨噬细胞还能分泌表达一系列抗结核细胞因子,如IL-12、TNF-α等。IL—l2是一种相对分子质量(Mr)为75 000的糖蛋白,由p35和p40链共价联结而成,p40的作用强于p35,通常检测p40代表IL-12。IL-12能促使Th0细胞向Thl细胞分化,在增强Thl型细胞免疫,介导抗结核免疫中起着十分重要的作用。对MTB慢性感染鼠模型研究发现,应用IL-12DNA疫苗接种,可以显著减少MTB数目。而IL-12基因或IL-12受体基因突变患者,容易出现播散性BCG感染[12-13]。TNF-α则能显著诱导感染MTB的巨噬细胞凋亡,促进结核肉芽肿形成,从而对宿主产生有利的免疫保护应答。TNF-α仅在调节结MTB感染引起的Thl免疫反应中也有重要作用,TNF-α缺陷的小鼠在肺部感染MTB后,很快死于过度Thl免疫反应活化引起的肉瘤和肺组织结构的损害;而早期通过转基因重建TNF-α则能提高小鼠存活率[14]。因此对TNF-α表达水平的调节将影响机体的抗结核免疫反应。有研究表明结核分枝杆菌国际标准无毒株H37Ra菌株基因组DNA免疫小鼠后第30d、60d,其腹腔巨噬细胞NO、H2O2的产量、巨噬细胞IL-12、TNF-α的表达水平较未免疫组高,其差异具有统计学意义;虽然也略高于卡介苗菌组,但无统计学差异[15]。该研究结果表明结核分枝杆菌H37Ra菌株能显著诱导巨噬细胞活化并产生大量的氮氧化物等效应物质和抗结核细胞因子,从而产生有利于宿主的抗结核免疫应答,且该作用与BCG相当,同时巨噬细胞对灭活菌H37RV菌株及活菌H37Ra菌株吞噬作用相比,后者被吞噬的情况更强[16]。在体外研究中,发现感染H37Ra结核分枝杆菌后的巨噬细胞也能够产生更多的NO、H2O2同时也增加了IL-12,TNF-α的表达水平[17]。
4 结核分枝杆菌H37Ra菌株能诱导机体产生特异性细胞免疫应答
MTB作为一种胞内寄生菌,机体主要通过细胞免疫将其杀灭清除。首先抗原递呈细胞的对抗原的递呈,经过致敏阶段、反应阶段、T细胞分化为效应淋巴细胞并产生细胞因子,从而发生免疫效应。
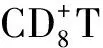
目前认为Th1型免疫应答在防止结核菌感染中起着重要作用。活化的Th1细胞以分泌IL-2、IFN-γ为主要特征,主要介导细胞免疫应答,促进细胞毒性T细胞的杀伤作用,激活巨噬细胞杀伤胞内病原体[21]。其中,IL-2是T细胞活化的关键因子,为T细胞增殖(从G0期进入S期)所必需;除此以外,T细胞从G1期进入S期还受到IL-2受体(IL-2R)的影响。可溶性IL-2受体(sIL-2R)是T细胞胞外部分P55链脱落、溶解在上清液中所为,其释放量与T淋巴细胞激活程度及膜受体表达率有关。sIL-2R的表达可形成高亲和性的IL-2结合位点,并能与较低浓度的IL-2反应,从而在抗结核免疫中发挥着重要作用[22]。研究发现[23]H37Ra菌株免疫小鼠后其脾淋巴细胞刺激指数SI与未免疫组比较具有显著性差异(P<0.05),与BCG对照组无显著性差异;脾淋巴细胞IL-2、sIL-2R表达水平与未免疫组、BCG对照组比较均有显著性差异(P<0.05),由此说明,H37Ra免疫小鼠后能增强机体的特异性抗结核细胞免疫。
5 结 语
目前使用活疫苗抗原可以提高疫苗对机体的自然保护性和敏感性,因此,确定安全、有效的结核病疫苗,可以对疫苗进行相关生物标记,测定在机体产生的生物效能和早期阶段疫苗生产的免疫稳定性[24]。为能更好地控制结核病,不仅需要快速诊断和较短时间的化疗,更重要的是需要一种优于BCG或可强化BCG的疫苗即接触前疫苗,还需要针对结核分枝杆菌潜伏感染的治疗性疫苗。因此,选用活菌H37Ra作为疫苗不仅可以长时间在体内可持续较长时间,而且能够不断刺激机体产生持久的免疫反应,诱导机体产生特异的抗结核免疫保护作用,为开发H37Ra成为新型抗结核疫苗奠定了一定基础。然而,目前的研究还只是在动物体内进行,能否通过临床实验,成为抗结核的新型疫苗,为结核的防治带来希望还需要进一步的深入研究。
参考文献:
[1]Kaufmann SH,Hussey G,Lambert PH.New vaccines for tuberculosis[J]. Lancet, 2010, 375(9731): 2110-2119. DOI: 10.1016/S0140-6736(10)60393-5
[2]Ho MM, Southern J, Kang H, et al. WHO Informal Consultation on standardization and evaluation ofBCGvaccines Geneva, Switzerland,22-23 September, 2009[J]. Vaccine, 2010, 28(43): 6945-6950.
[3]Huygen K. On the use of DNA vaccines for the prophylaxis ofMycobacterialdiseases[J]. Infect Immun, 2008, 71(4): 1613-1621. DOI: 10.1128/IAI.71.4.1613-1621.2003
[4]Sonnenberg P, Glynn JR, Fielding K, et al. How soon after infection with HIV does the risk of tuberculosis start to increase? A retrospective cohort study in South African gold miners[J]. J Infect Dis, 2005, 191(2): 150-158. DOI: 10.1086/426827
[5]Kaufmann SH, Gengenbacher M. Recombinant live vaccine candidates against tuberculosis[J]. Curr Opin Biotechnol, 2012, 23(6): 900-907. DOI: 10.1016/j.copbio.2012.03.007
[6]Kalra M, Grover A, Mehta N, et al. Supplementation with RD antigens enhances the protective efficacy ofBCGin tuberculous mice[J]. Clin Immunol, 2007, 125(2): 173-183.
[7]Williams A, Davies A, Marsh PD, et al. Comparison of the protective efficacy ofbacilliCalmette-Guerinvaccination against aerosol challenge withMycobacteriumtuberculosis andMycobacteriumbovis[J]. Clin Infect Dis, 2000, 30(S3): S299-301.
[8]He ZL, Du FW, Du XZ. The viableMycobacteriumtuberculosisH37Rastrain induces a stronger mouse macrophage response compared to the heat-inactivatedH37Rvstrain[J]. Mol Med Reports, 2013, 7(5): 1597-1602. DOI: 10.3892/mmr.2013.1363
[9]Behar SM, Martin CJ, Booty MG, et al. Apoptosis is an innate defense function of macrophages againstMycobacteriumtuberculosis[J]. Mucosal Immunol, 2011, 4(3): 279-287. DOI: 10.1038/mi.2011.3
[10]Choi HS, Rai PR, Chu HW, et al. Analysis of nitric oxide synthase and nitrotyrosine expression in human pulmonary tuberculosis[J]. Am J Respir Crit Care Med, 2002, 166(2): 178-186.
[11]Yang CS, Yuk JM, Jo EK. The role of nitric oxide inMycobacterialinfections[J]. Immune Netw, 2009, 9(2): 46-52. DOI: 10.4110/in.2009.9.2.46
[12]Robinson CM, Nau GJ. Interleukin-12 and interleukin-27 regulate macrophage control ofMycobacterlumtuberculosis[J]. J Infect Dis, 2008, 198(3): 359-366. DOI: 10.1086/589774
[13]Ottenhoff TH, Kumararatne D, Casanova JL. Novel human immunodeficiencies reveal the essential role of type-I cytokines in immunity to intracellular bacteria[J]. Immunol Today, 1998, 19(11): 491-494.
[14]Zganiacz A, Santosuosso M, Wang J, et al. TNF-alpha is a critical negative regulator of type 1 immune activation during intracellular bacterial infection[J]. J Clin Invest, 2004, 113(3): 401-413.
[15]Zhang WJ, Wu F, Wang P, et al. Pilot study on the function of anti-bacterium immunity of the genome DNA ofMycobacteriumtuberculosisH37Rastrain[J]. Chin J Pathophysiol, 2008, 24(8): 1534-1537. (in Chinese)
张万江, 吴芳,王萍,等. 结核分枝杆菌国际标准无毒株H37Ra菌株基因组DNA抗结核免疫效应的初步研究[J]. 中国病理生理杂志, 2008, 24(8): 1534-1537.
[16]He ZL, Du XZ. Infection of macrophages with viable strainH37Raand Heat-Killed H37Rv[J]. Chin J Immunol, 2011, 08(001): 675-680. DOI: 0.3969/j.issn.1000-484X (in Chinese)
何宗林,杜先智. 活菌H37Ra与灭活菌H37Rv感染小鼠腹腔巨噬细胞的实验研究[J]. 中国免疫学杂志, 2011, 08(001): 675-680. DOI: 10.3969/j.issn.1000-484X
[17]Liu LC, Wang SL, Lu XY, et al. Study on macrophages infected withMycobacteriumtuberculosisH37Rainvitro[J]. Chin J Cell Mol Immunol, 2011, 27(11): 1195-1197. (in Chinese)
刘来成,王淑玲,卢贤瑜,等.结核杆菌H37Ra感染巨噬细胞的研究[J]. 细胞与分子免疫学杂志, 2011, 27(11): 1195-1197.
[18]Liu LC, Wang SL, Fan XL, et al. Immune response induced byMycobacteriumtuberculosisH37Ra in mice[J]. Chin J Biologicals, 2008, 21(5): 391-394. (in Chinese)
刘来成, 王淑玲,范雄林,等. 结核菌H37Ra在小鼠体内诱导的免疫应答[J]. 中国生物制品学杂志, 2008, 21(5): 391-394.
[19]Glatman-Freedman A. Advances in antibody-mediated immunity againstMycobacteriumtuberculosis: implications for a novel vaccine strategy[J]. FEMS Immunol Med Microbiol, 2003, 39(1): 9-16. DOI: 10.1016/S0928-8244(03)00172-X
[20]Kozakiewicz L, Phuah J, Flynn J, et al. The role of B cells and humoral immunity inMycobacteriumtuberculosisinfection[J]. Adv Exp Med Biol, 2013, 783: 225-250. DOI: 10.1007/978-1-4614-6111-1_12
[21]Ravn P, Demissie A, Eguale T, et al. HumanTcellresponses to theESAT- 6 antigen fromMycobacteriumtuberculosis[J]. J Infect Dis, 1999, 179(3): 637-645.
[22]Lalor MK, Floyd S, Gorak-Stolinska P, et al. BCG vaccination induces different cytokine profiles following infant BCG vaccination in the UK and Malawi[J]. J Infect Dis, 2011, 204(7): 1075-1085. DOI: 10.1093/infdis/jir515
[23]Liu LC, Wang SL, Fan XL, et al. Study on the preventive effect ofMycobacteriumtuberculosisH37Raagainst tuberculosis in mice[J]. Curr Immunol, 2011, 31(4): 0311-0314. (in Chinese)
刘来成, 王淑玲, 范雄林,等. 减毒结核菌株H37Ra预防小鼠结核病的实验研究[J]. 现代免疫学, 2011, 31(4): 0311-0314.
[24]Brennan MJ, Thole J. Tuberculosis vaccines: a strategic blueprint for the next decade[J]. Tuberculosis, 2012, 92(S1): S6-13. DOI: 10.1016/S1472-9792(12)70005-7

