嗜酸性筋膜炎与系统性硬化症临床特点比较
王泉丽,张改连,张莉芸,李小峰
(山西医学科学院 山西大医院风湿免疫科,太原 030032)
嗜酸性筋膜炎(eosinophilic fasciitis,EF)又称伴嗜酸粒细胞增高性弥漫性筋膜炎,常伴外周血嗜酸粒细胞增多,是一种以筋膜发生弥漫性肿胀硬化为特征的少见疾病。临床上可表现为肢体肿胀、硬化,类似于系统性硬化症(systemic sclerosis,SSc)。关于EF的报道国内外仅限临床病例报告和小样本回顾性分析,未见其与SSc的对比研究。本文旨在回顾性分析EF患者的临床特点,并与SSc进行比较,以提高临床医务工作者对EF的认识。
资料与方法
资料来源
收集山西大医院和山西医科大学第二医院2002年5月至2013年5月EF住院患者资料,以及2011年12月至2014年8月山西大医院确诊为SSc的住院患者资料,并分别纳入EF组和SSc组。EF诊断结合典型临床表现、外周血嗜酸粒细胞增高及组织病理学检查等综合判断。SSc诊断符合1980年美国风湿病学会SSc分类标准。
脏器受累定义
全身非特异性症状:发热、乏力、体重下降等全身症状。心脏受累:心脏损害符合心绞痛、心肌梗死、左心功能不全或右心功能不全诊断标准中1项,或心电图检查显示致命性心律失常,或超声心动图检查提示心脏房室增大。肾脏受累:蛋白尿和(或)血尿和(或)肾功能异常。胃肠道受累:有持续存在或反复出现的消化道症状,或经胃镜、上消化道造影证实为食管、胃黏膜异常。肺部受累:典型临床症状和影像学证实的肺间质性改变、肺动脉高压、胸腔积液、多发性结节影。血液系统受累:出现外周血白细胞、红蛋白、血小板计数任何1项减少。神经系统受累:需要神经系统体征和肌电图支持。
发病前诱因定义
发病前有明确剧烈运动、劳累、外伤或感染史。
实验室指标异常
白细胞减少:外周血白细胞计数<4.0×109/L。贫血:男性血红蛋白<125 g/L,女性血红蛋白<115 g/L。血小板减少:血小板计数<125×109/L。嗜酸粒细胞计数升高:嗜酸粒细胞计数>0.52×109/L。红细胞沉降率(erythrocyte sedimentation rate,ESR)升高:男性>15 mm/1 h,女性>20 mm/1 h。C反应蛋白(C reactive prolein,CRP)升高:>8.0 mg/L。免疫球蛋白升高:IgA>4.53 g/L,IgG>15.6 g/L,IgM>2.74 g/L。白蛋白减少:白蛋白水平<40 g/L。抗核抗体(anti nuclear antibody,ANA)阳性>1∶100。
方法
收集EF和SS患者的一般资料、首发症状、皮肤损害、脏器受累情况、实验室指标、病理检查、治疗及预后,并进行比较。
统计学处理

结 果
一般资料
EF组共纳入12例患者,其中男9例,女3例,男女比为3∶1;SSc组共纳入24例患者,男3例,女21例,男女比为1∶7;两组性别构成相比差异有统计学意义(P<0.001),EF组男性多见而SSc组女性多见(P<0.001)。EF患者均无家族病史。
EF组平均年龄为(35.3±11.1)岁,平均发病年龄为(34.3±11.0)岁,平均病程为7.0(6.5)个月;SSc组平均年龄为(55.2±10.0)岁,平均发病年龄为(48.5±11.9)岁,平均病程为80(108)个月;两组就平均年龄、平均发病年龄和平均病程比较,差异均有统计学意义(均P<0.001)。
EF组中5例(42%)发病前有诱因,包括劳累或剧烈运动史(3例)、明确创伤史(1例)、感染史(1例),SSc组发病前均无明确诱因,差异有统计学意义(P<0.01)。
首发症状
EF组最常见首发症状为肢体肿胀/硬化伴疼痛(50%),其次为因皮肤紧绷所至关节疼痛(33%)。SSc组以雷诺现象(54%)为最常见的首发表现,其次为肢体肿胀/硬化(33%)。SSc组中以雷诺现象为首发症状者高于EF组,差异有统计学意义(P<0.05)。以肢体肿胀/硬化为首发表现者在两组中均有较高比例,但EF组多同时伴疼痛,而SSc组无明显疼痛(P<0.05)(表1)。
皮损分布和表现
分布:EF组最常见皮肤受累部位为前臂(83%),其次为下肢(75%)、手背(25%)及颈部(17%)。SSc组最常见受累部位为前臂(100%)及手背(100%),其次为手指(92%)、颜面部及下肢(33%)、躯干(29%)、颈部(21%)。EF组手背、下肢、颜面部及手指皮肤受累者低于SSc组,差异有统计学意义(P<0.05);而前臂、躯干及颈部皮肤受累者两组差异无统计学意义(P>0.05)(表2)。
表现:EF组最常见皮损表现为皮肤硬化,与皮下部组织紧贴,皮肤表面凹凸不平,可见硬化处沿浅表静脉走向所出现的凹陷性条状沟(8/12,67%);其次为弥漫性水肿(2/12,17%)。所有24例(100%)SSc组患者都出现皮肤失去弹性,与皮下组织黏连,不能提起。
脏器受累
EF组脏器受累包括全身非特异性症状(5/12,42%),表现为发热、乏力和体重下降。神经系统(2/12,17%),表现为受累肢体麻木不适,肌电图示神经源性损害。血液系统受累(2/12,17%)表现为白细胞减少。肺部受累和胃肠受累各有1例患者(8%),分别表现为肺部结节和食欲不振。未见心脏和血液系统受累、关节炎和雷诺现象。
SSc组脏器受累更为多见,最常见为肺部受累(21/24,88%),这21例患者均表现为肺间质纤维,其中4例肺动脉高压,1例出现胸腔积液。其次为胃肠道受累(14/24,58%),表现为食欲不振、腹胀、反酸、烧心等,6例胃镜检查示萎缩性胃炎。心脏受累(8/24,33%)患者中3例为心绞痛,1例为心肌梗死,4例为左心功能不全。血液系统受累(8/24,33%),表现为贫血、白细胞、血小板减少。全身非特异性症状(6/24,25%)表现为发热、乏力和体重下降。肾脏受累(4/24,17%)表现为尿蛋白阳性和肾功能异常。神经系统受累(3/24,13%)相对少见,表现为肢体麻木,肌电图示神经源性损害。其他常见临床表现包括关节炎8例(33%)和雷诺现象23例(96%)。
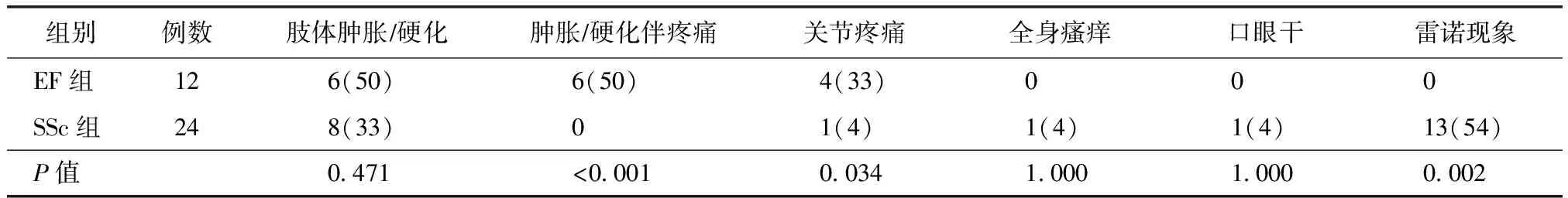
表1 EF和SSc患者首发症状比较
EF:嗜酸性筋膜炎;SSc:系统性硬化症

表2 EF和SSc患者皮损分布比较
EF:嗜酸性筋膜炎;SSc:系统性硬化症
EF组患者肺部、心脏、胃肠道、血液系统受累发生率均低于SSc组,差异有统计学意义(均P<0.05);而雷诺现象和关节炎发生率低于SSc组,差异有统计学意义(P<0.05)。两组非特异症状、神经系统和肾脏受累差异无统计学意义(P>0.05)。
实验室指标
EF组最常见实验室异常指标为嗜酸粒细胞升高(7/12,58%),而SSc组患者最常见ANA阳性(20/21,95%)。EF组嗜酸粒细胞升高发生率高于SSc组,差异有统计学意义(P<0.05);而ANA阳性发生率低于SSc组,差异有统计学意义(P<0.05)。而抗SCL-70抗体、血清白蛋白、免疫球蛋白、ESR、CRP在2组间差异无统计学意义(均P>0.05)(表3)。
病理学检查
EF组10例患者进行病变部位组织病理学检查,10例均存在不同程度胶原纤维组织增生,4例出现嗜酸粒细胞浸润,8例为非特异性炎细胞浸润。SSc组中2例患者行病变部位组织病理学检查,均表现为真皮层增厚,慢性炎细胞侵润,无纤维组织增生。
磁共振检查
EF组6例患者进行病变部位磁共振扫描,5例在T2W2抑脂图像上受累筋膜显示相对高信号;3例显示浅、深筋膜增厚,其中1例筋膜增厚10倍以上;1例未见明显异常。
治疗
EF组12例患者均使用糖皮质激素治疗(泼尼松0.5~1.0 mg·kg-1·d-1),其中11例同时加用免疫抑制剂(环磷酰胺50 mg/d或每2~3周0.2~0.6 g;来氟米特10 mg/d;青霉胺0.25 g/d;甲氨蝶呤12.5 mg/周)。随访0.5个月~1年10个月,治疗后皮肤紧硬完全缓解5例(42%),皮肤硬度、疼痛明显好转7例(58%),系统受累均回复正常。
SSc组中除1例放弃治疗外,余23例均接受药物治疗。23例患者均应用糖皮质激素(泼尼松0.5~1.0 mg·kg-1·d-1),均加用免疫抑制剂(环磷酰胺每2~3周0.2~0.4 g;来氟米特10 mg/d;青霉胺0.25 g/d;硫唑嘌呤50 mg/d;吗替麦考酚酯0.75 g/d;甲氨蝶呤10 mg/周;雷公藤20 mg,3次/d)。随访3个月~4年,经治疗后皮肤硬度、雷诺现象好转者20例(83%),无明显改善者4例(17%),未出现皮肤紧硬完全缓解患者。肺部受累临床表现改善最明显,咳嗽、咯痰和气短均明显好转,但影像学改变不明显。其次为胃肠道及血液系统,神经、肾脏受累改善最差。
讨 论
EF是一种以筋膜发生弥漫性肿胀硬化为特征,常伴嗜酸粒细胞增多,病变可延伸到真皮,出现类似系统性硬化病的表现。SSc是一种以局限性或弥漫性皮肤增厚、纤维化为特征,可致心、肺、肾和消化道等多个系统的自身免疫性疾病,是常见的结缔组织病之一。关于EF是否为一种独立性疾病及其与硬皮病的关系,目前主要有2种观点,一种认为EF与硬皮病密切相关,不是独立疾病[1];另一种认为EF无论从临床表现、病理组织变化和激素治疗效果都具有特征性,可能是一种独立疾病[2]。
表3 SSc和EF患者实验室指标比较
Table 3 Comparison of laboratory levels between patients with SSc and EF [nN(%)]

表3 SSc和EF患者实验室指标比较
组别嗜酸粒细胞升高免疫球蛋白升高CRP升高ESR升高白蛋白下降ANA阳性抗SCL⁃70抗体阳性EF组7∕12(58)4∕12(33)2∕7(29)3∕11(27)2∕8(25)2∕8(25)0∕8(0)SSc组0∕24(0)4∕18(22)4∕24(17)8∕23(35)4∕24(17)20∕21(95)5∕21(24)P值<0 0010 6780 5961 0000 625<0 0010 283
N:进行该项目检查的所有人数;EF:嗜酸性筋膜炎;SSc:系统性硬化症;CRP:C反应蛋白;ESR:红细胞沉降率;ANA:抗核抗体
本研究对EF和SSc临床特点进行比较,结果示EF患者在发病前多有一定诱因,如剧烈运动、劳累、外伤、感染等,不同于SSc。本文5例(42%)EF患者发病前有明确诱因,包括劳累或剧烈运动(3例)、创伤(1例)、感染(1例),而SSc患者一般为隐匿起病,发病前无明确诱因。有报道显示,至少66%的EF患者在发病前有过度体力活动[3- 4]。有研究发现,摄入大量L-色氨酸[5]或支原体感染[6]与EF的发病有关,提示损伤或环境因素可能在EF发病过程中起重要作用。Abeles等[7]报道了EF患者组织活检示皮损部位存在免疫球蛋白和(或)补体沉积。本研究中EF组4例患者免疫球蛋白升高,2例ANA阳性,考虑EF可能为一种自身免疫病。另有文献报道了互为姐弟的2例患者存在相同的人类白细胞抗原且均患EF[8],提示遗传因素可能参与EF发病。本研究EF患者均无家族史,未发现遗传倾向,可能与收集病例较少有关。结合本研究病例特点及相关文献,笔者认为EF可能是一种主要受损伤或环境因素影响、遗传因素参与发病的自身免疫性疾病。
本研究对EF和SSc的流行病学特点分析显示,EF患者以男性多见,平均年龄及发病年龄均偏小,最早在14岁即可发病,且起病急、病程短;SSc患者以女性多见,多在30岁后发病,多数发病年龄在50岁以上,病程相对较长。
EF和SSc患者首发症状与皮肤受累部位不尽相同。EF患者最常见的首发症状为肢体肿胀/硬化伴疼痛,而SSc患者则以雷诺现象最为常见。EF患者以前臂(83%)为最常受累部位,极少累及躯干、手指、颜面部皮肤;SSc患者除前臂及手背部皮肤受累外,包括手指、躯干及颜面部的其他部位皮肤也可累及。两种疾病皮损演变亦有较大差异,EF患者表现为水肿,继而硬化,与皮下部组织紧贴,触之坚硬,皮纹正常,当握拳或肢体上举时皮肤表面凹凸不平,可见硬化处沿浅表静脉走向所出现的凹陷性条状沟;而SSc患者一般为非凹陷性肿胀,紧绷感,后皮肤逐渐失去弹性,与皮下组织黏连,不能提起,皮肤呈蜡样光泽。因此,查体时应注意观察,以便进行鉴别诊断。
本研究还发现,EF和SSc患者的系统受累存在差异。EF患者脏器受累以全身非特异性症状最常见,其次为神经系统、血液系统、肺和胃肠道受累,但程度较轻,对症治疗预后良好。而SSc患者系统受累多侵犯重要脏器,最常见为肺,胃肠道、心脏、血液系统和全身非特异性症状次之,如不积极治疗,预后较差。以往研究显示,EF患者较少出现系统受累[9],但近年相关报道却逐年增加。Killen等[10]报道了1例EF患者同时伴有肺间质性病变及胸膜增厚。Doyle等[11]报道了EF可累及筋膜肌腱、肌肉、食管、肺、骨髓和甲状腺等脏器。因此,对于已确诊的EF患者也应进行系统评估。
本研究对EF和SSc患者实验室指标进行了比较。结果显示,SSc患者ANA阳性者(83%)更为多见,而EF组发生率仅为25%。然而,EF患者嗜酸粒细胞增高(58%)比例较高,SSc患者嗜酸粒细胞均在正常范围。文献对于EF患者外周血嗜酸粒细胞增高范围报道不同,Rodnan首次报道一般为9%~10%,最高可达95%。本研究10例进行皮损处组织病理学检查的EF患者种4例出现嗜酸粒细胞侵润,余患者主要为非特异性炎细胞浸润。这与吴婵媛等[12]得研究结果相似,12例EF患者行肌筋膜活检,仅3例见少量嗜酸粒细胞浸润。本研究SSc组仅2例患者行病理学检查,未见嗜酸粒细胞侵润。血或组织中嗜酸粒细胞增高可能为EF和SSc的鉴别诊断依据,但尚需进一步扩大病例殊异证实。
本研究6例EF患者进行病变部位磁共振检查,5例在T2W2抑脂图像上受累筋膜显示相对高信号,3例显示浅、深筋膜增厚。Moulton等[13]研究显示,EF患者磁共振检查特点为受累筋膜信号强度增强,与本文研究类似,且与疾病活动度呈正相关。而Frite和Horger[14]则认为,硬皮病患者磁共振检查特征为局限于真皮和表皮内,筋膜受累少见。推测受累筋膜信号强度增强可作为EF和SSc患者的鉴别诊断依据。
综上所述,本研究表明,EF和SSc在诱发因素、流行病学特点、首发表现、脏器受累、实验室检查和治疗反应等方面均有明显差异,可能为二种独立性疾病,了解并仔细分析这些特点有助于EF和SSc的鉴别诊断。
[1]Odhav A, Hoeltzel MF, Canty K.Pansclerotic Morphea with Features of Eosinophilic Fasciitis:Distinct Entities or Part of a Continuum?[J].Pediatr Dermatol,2014, 31:e42-e47.
[2]邵经政,张玉麟,谈善庆,等.嗜酸性筋膜炎(附两例报告)[J].临床皮肤科杂志,1981,10:122-124.
[3]Lakhanpal S, Ginsburg WW, Michet CJ, et al. Eosinophilic fasciitis:clinical spectrum and therapeutic response in 52 cases[J].Semin Arthritis Rheum, 1988, 17:221-231.
[4]Blaser KU, Steiger U, Würsch A, et al. Eosinophilic fasciitis with aplastic anemia and Hashimoto’s thyroiditis. Review of the literature and report of a typical example[J].Schweiz Med Wochenschr, 1989, 119:1899-1906.
[5]Hamilton ME,Lasota J.Eosinophilic fasciitis associated with L-tryptophan ingestion[J].Ann Rheum Dis,1991,50:55-56.
[6]Silló P, Pintér D, Ostorházi E,et al.Eosinophilic Fasciitis associated with Mycoplasma arginini infection[J].J Clin Microbiol,2012,50:1113-1117.
[7]Abeles M, Belin DC,Zurier RB.Eosinophilic fasciitis:a clinicopathologic study[J].Arch Intern Med,1979,139:586-588.
[8]Thomson GT,MacDougall B,Watson PH,et al.Eosinophihc fasciitis in a pair of siblings[J].Arthritis Rheum,1989,32:96-99.
[9]Shewmake SW, lopez DA, McGlamory JC. The Shulman syndrome[J].Arch Dermatol, 1978, 114:556-559.
[10] Killen JW, Swift GL, White RJ, et al. Eosinophilic fasciitis with pulmonary and pleural involvement[J].Postgrad Med J, 2000, 76:36-37.
[11] Doyle JA,Connolly SM,Winkelmann RK.Cutaneous and subcutaneous inflammatory sclerosis syndromes[J].Arch Dermatol,1982,11 8:886.
[12] 吴婵媛, 王迁, 钟定荣, 等. 嗜酸性筋膜炎病理及磁共振成像特征[J].中华临床免疫和变态反应杂志, 2014, 8:1673-8705.
[13] Moulton SJ, Kransdorf MJ, Ginsburg WW, et al.Eosinophilic fasciitis:spectrum of MRI findings[J].AJR Am J Roentgenol, 2005, 184:975-978.
[14] Frite J, Horger M.嗜酸性筋膜炎的CT和MR诊断[J].放射学实践,2006, 7:755-756.