黄淮麦区小麦春化基因组成的多态性分布研究
郭总总, 王 翔, 卫 丽, 白瑞英, 曹 云, 郭 创, 尹 钧
(河南农业大学国家小麦工程技术中心,河南 郑州 450002)
小麦是中国主要粮食作物之一,冬小麦必须经过春化才能正常开花结实,春化过程是一个缓慢量变积累过程且受多种因素的影响,如温度、光照、表观修饰和激素等.小麦冬春性的准确鉴定对防范自然灾害、引种及保障小麦安全生产具有重要意义.小麦对春化需求受遗传控制,目前报道的小麦春化基因有4个,即Vrn1,Vrn2 ,Vrn3和Vrn4,其中,研究较为深入且已开发出分子标记的主要是Vrn1和Vrn3.Vrn1有3个等位基因,分别命名为Vrn-A1 ,Vrn-B1 和Vrn-D1,位于小麦的 5A,5B,5D染色体上[1~5].YAN等[6]和FU等[7]根据Vrn-A1 ,Vrn-B1,Vrn-D1和Vrn-B3等4个位点的多态性,开发出8对引物作为区分冬春性基因型的分子标记.IQBAL等[8]利用上述标记分析了加拿大西部的40个春性小麦品种的Vrn-A1,Vrn-B1和Vrn-D1等3个位点,其中36个品种含有Vrn-A1基因,另外4个品种含有Vrn-B1基因.ZHANG等[9]对中国8个麦区的278个品种的春化基因显隐性分析发现,Vrn-A1基因主要分布于长城以北的春播麦区、新疆冬春麦区和西南冬麦区,北方冬麦区春化基因都为隐性,黄淮麦区是春化基因由隐性向显性的过渡地带.尹钧课题组[10,11]先后对中国9个代表性小麦品种及21个黄淮麦区小麦品种中的春化基因Vrn1的组成及其序列特征进行了初步分析.但长期以来黄淮麦区的主栽品种春化基因的组成还不清楚,该地区半冬性与弱春性品种占主导地位.本研究在已有研究的基础上,对黄淮麦区91个主栽品种Vrn1和Vrn3的显隐性组成进行分析,并利用最新分子标记分析了这些小麦品种Vrn-D1启动子区域的变异,以期为进一步开展小麦发育特性分子改良提供理论依据.
1 材料与方法
1.1供试材料
选用黄淮麦区的91个小麦品种为试验材料,其具体品种名称及冬春性等见表1.
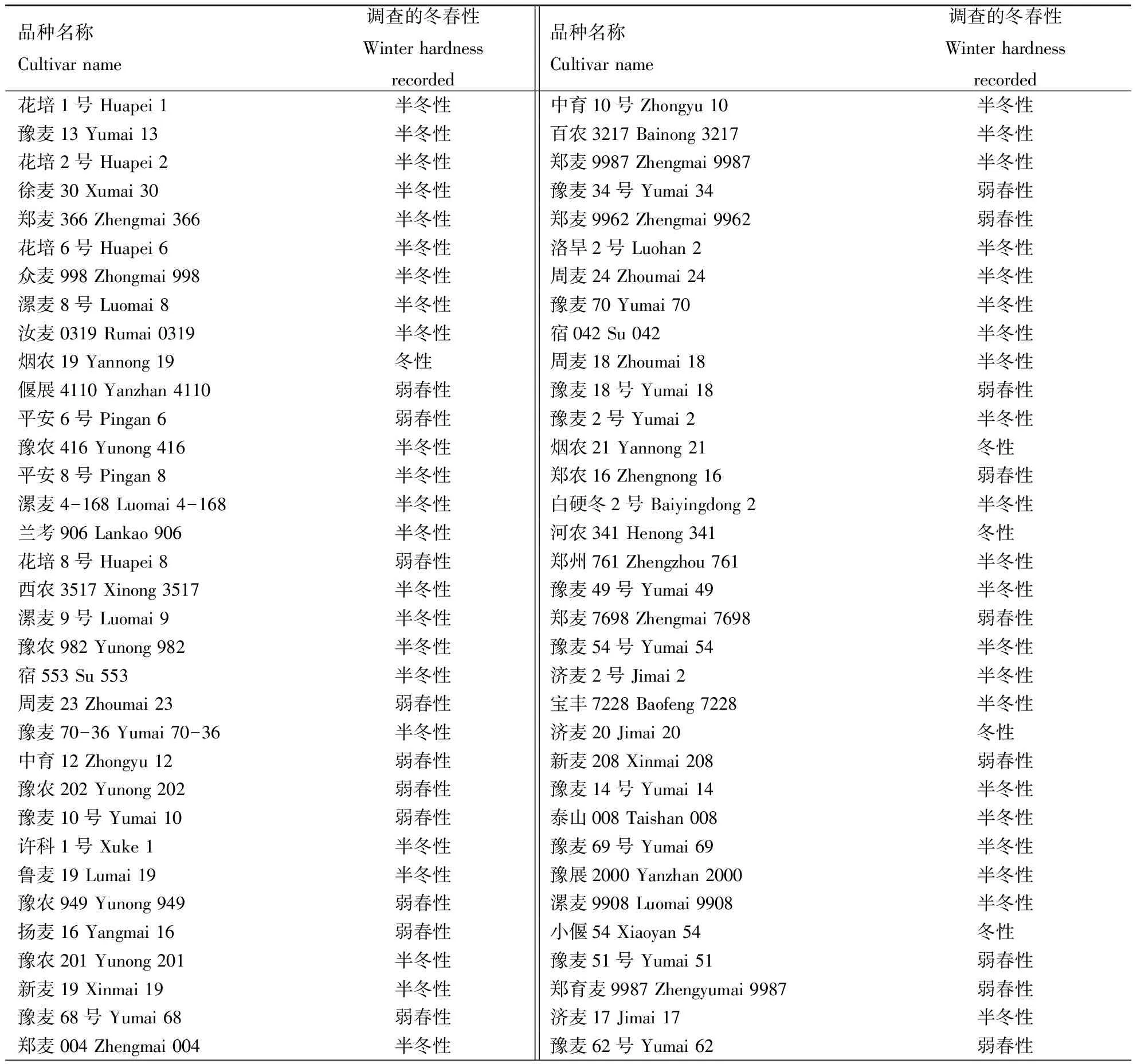
表1 91份黄淮麦区小麦品种的冬春性及基因型
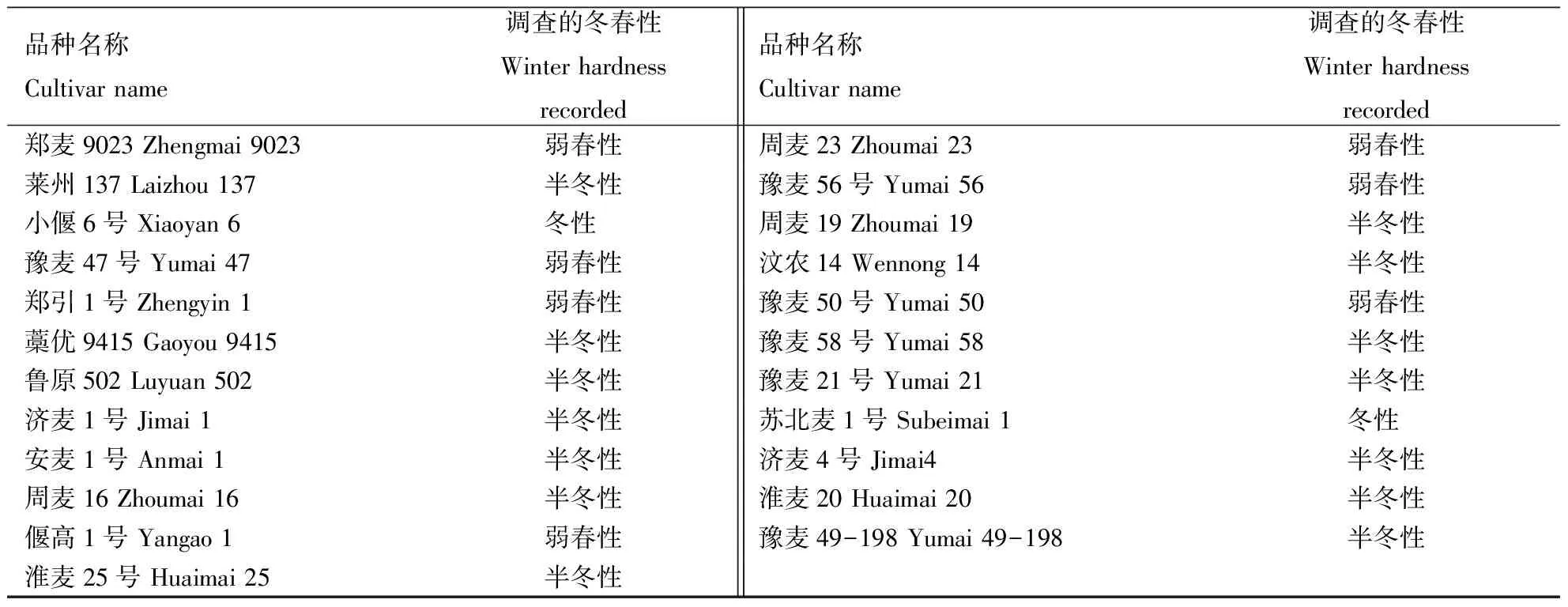
续表Continuing table
1.2试验方法
1.2.1 DNA提取 小麦品种于2011年和2012年秋播在河南农业大学科教园区(郑州),每个材料种植4行,行长2 m.采用CTAB法[12]提取小麦叶片的基因组DNA.为了确保材料正确性,每份材料取两叶一心期叶片2份,分别提取DNA,使用紫外分光光度计测定DNA质量浓度,调整质量浓度至100 mg ·L-1作为模板.同时田间观察各品种越冬前和返青期的苗相、抗寒性及抽穗期、成熟期等农艺性状.
1.2.2 春化基因Vrn-A1,Vrn-B1,Vrn-D1和Vrn-B3的分子检测 4个基因不同变异类型的引物序列、扩增片段大小见表2.PCR反应体系为: 20 μL总体积中含2 μL 10×缓冲液、1.5 μL(25 mmol·L-1)MgCl2,0.2 μL (5 U)rTaqDNA聚合酶、1.6 μL(2.5 μ mol· L-1)dNTP,每条引物1 μL(10 μmol ·L-1), DNA模板1 μL.所用PCR试剂及DNA聚合酶购自Takara公司.
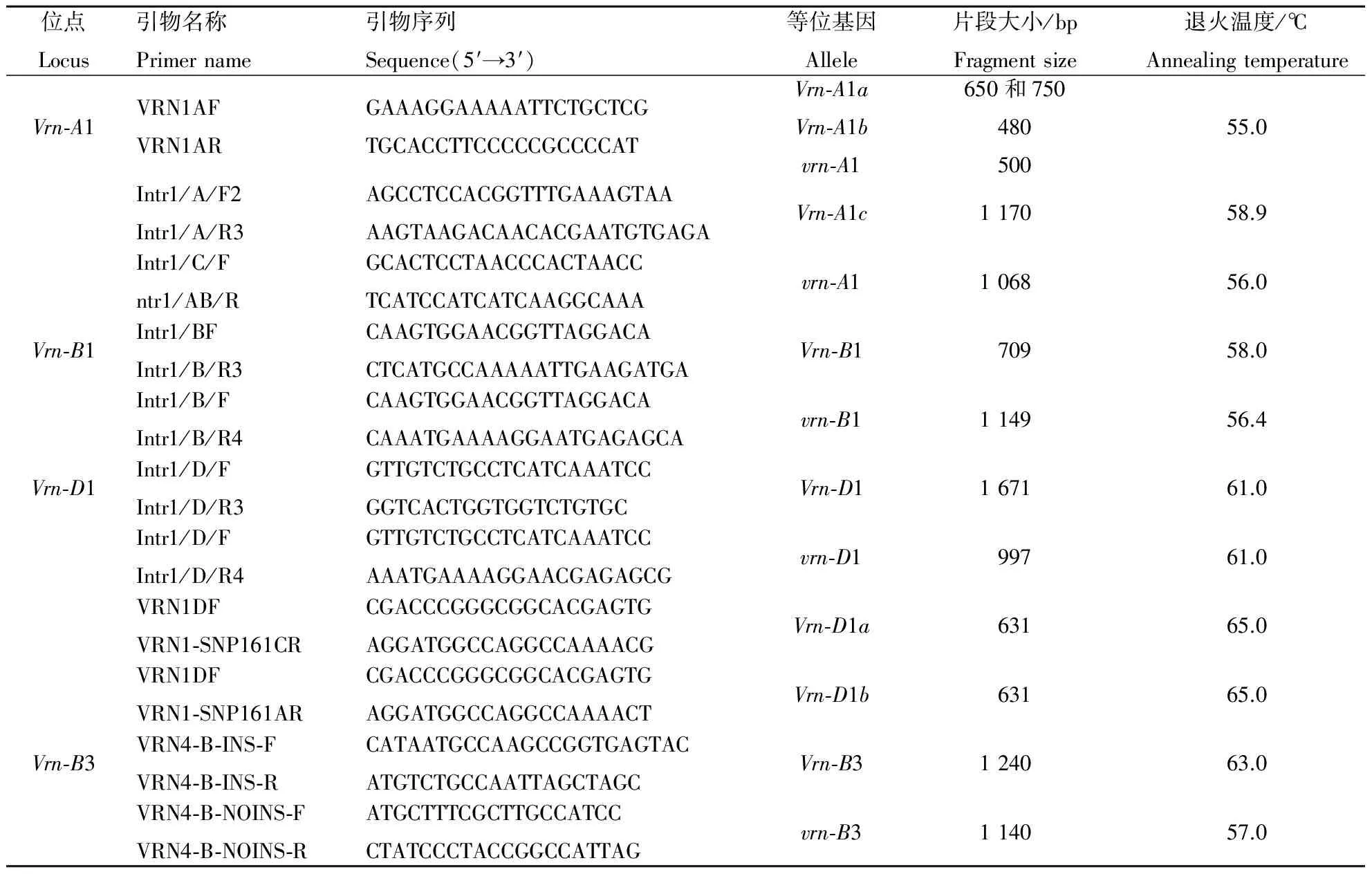
表2 用于检测小麦春化基因的PCR引物
PCR反应条件为: 94 ℃预变性5 min;94 ℃变性30 s,55~65 ℃退火30 s,72 ℃延伸0.5~1.5 s,35个循环; 72 ℃终延伸10 min.
除Vrn-A1a基因扩增产物以2.5%的琼脂糖凝胶电泳检测,80 V电压电泳2~3 h外,其余基因的扩增产物均以1.5%的琼脂糖凝胶电泳检测,缓冲体系为1×TAE溶液,150 V电压电泳30 min,经溴化乙锭染色后,用凝胶成像系统扫描成像.
1.3小麦品种春化基因型判定
引物 VRN1AF/VRN1AR 检测Vrn-A1的启动子区的变异,扩增到 650和750 bp的2个条带,基因型为Vrn-A1a,仅扩增到 480 bp的条带,基因型为Vrn-A1b;显性变异Vrn-A1c和隐性vrn-A1均可扩增到500 bp的条带.引物Intr1/A/F2和 Intr1/A/R3 检测Vrn-A1第1内含子区域的大片段缺失,扩增产物为1 170 bp,基因型为Vrn-A1c;引物Intr1/C/F和Intr1/AB/R检测Vrn-A1第1内含子区域无大片段缺失,扩增产物为1 068 bp,基因型为vrn-A1,这 2 对引物扩增结果互补.
引物Intr1/B/F和Intr1/B/R3,Intr1/B/F和Intr1/B/R4检测Vrn-B1第1内含子区域的变异,存在大片段缺失时,引物Int1r/B/F和Intr1/B/R3可扩增到 709 bp的条带,基因型为Vrn-B1;引物Intr1/B/F和Intr1/B/R4 可扩增到1 149 bp的条带,基因型为vrn-B1,这 2 对引物结果互补.
引物Intr1/D/F和Intr1/D/R3,Intr1/D/F和Intr1/D/R4用于检测Vrn-D1第1内含子区域的变异,存在大片段缺失时,引物Intr1/D/F和Intr1/D/R3可扩增出1 671 bp的条带,基因型为Vrn-D1;不存在大片段缺失时引物Intr1/D/F和Intr1/D/R4可扩增到997 bp的条带,基因型为vrn-D1,这 2 对引物的结果互补.引物Vrn1DF和引物Vrn1-SNP161CR,引物Vrn1DF和引物Vrn1-SNP161AR用于检测基因型为Vrn-D1时启动子区的单核苷酸突变,引物Vrn1DF和引物Vrn1-SNP161CR可扩增出631 bp的条带,基因型为Vrn-D1a;引物Vrn1DF和引物Vrn1-SNP161AR可扩增出631 bp的条带,基因型为Vrn-D1b.
引物Vrn4-B-Ins-F和Vrn4-B-Ins-R用于Vrn-B3位点的显性和隐性等位变异检测,扩增条带为1 200 bp时,为显性等位变异Vrn-B3;扩增条带为1 140 bp时,为隐性等位变异vrn-B3.
1.4基因分型
根据对春化基因位点的检测结果(PCR扩增的片段所对应的基因型见表2.推测各小麦品种的春化类型,即Vrn-A1为显性,小麦的发育特性为春性,Vrn-B1或Vrn-D1(Vrn-D1a)有1个为显性则为弱春性;Vrn-D1突变型(Vrn-D1b)为半冬性;若这3个基因全为隐性,小麦的发育特性为冬性.
由于本研究所选黄淮麦区91份小麦品种均为国审及省审品种,其冬春性信息由材料提供者及通过查阅《中国小麦遗传资源目录》并结合国家品种审定办法中小麦冬春性鉴定标准进行田间观察记录确定其冬春性.将由春化基因型推测的冬春性与资料记载的冬春性进行比较,计算一致性.其公式为:一致性/%=基因型判断的冬春性与资料记载的冬春性一致的品种数/品种总数×100%.
2 结果与分析
2.1黄淮麦区Vrn-A1基因的显隐性分析
采用引物Vrn1AF和Vrn1AR对黄淮麦区91个小麦品种的基因组DNA进行特异性扩增分析显示,所有品种均能扩增出500 bp的片段(图1-a),推断这些品种Vrn-A1基因的启动子区没有插入或缺失,即没有Vrn-A1a或Vrn-A1b基因类型.采用引物Intr1/A/F2和Intr1/A/R3对91个小麦品种分析显示,所有小麦品种都扩增到1 068 bp片段(图1-b),表明这91个小麦品种中Vrn1第1内含子区域没有缺失(Vrn-A1c),其Vrn-A1的基因型为隐性(vrn-A1).
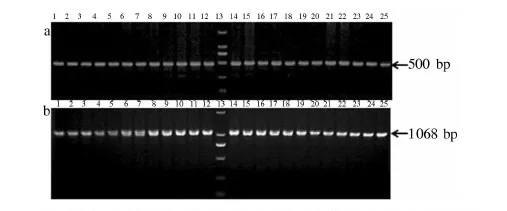
1:徐麦30; 2:花培1号;3:郑麦366;4:平安6号;5:济麦4号;6:众麦998;7:济麦1号;8: 安麦1号;9: 周麦16; 10: 偃高1号; 11: 豫麦51号;12:郑农18;13:Marker DL 2000;14: 郑麦9023;15: 豫麦62号;16: 周麦19;17: 汶农14;18: 豫麦58号;19: 豫麦21号;20: 豫麦49-198;21: 周麦18;22:豫麦18号;23: 郑麦9962;24: 花培2号;25: 淮麦7号.
2.2黄淮麦区Vrn-B1基因的显隐性检测
采用引物Intr1/B/F 和Intr1/B/R3,Intr1/B/F和Intr1/B/R4分别对91份材料进行检测,扬麦10、徐州25、郑9023等6个品种检测到显性突变Vrn-B1(图2-a),占总数的6.0%,其余品种均检测到隐性位点vrn-B1(图2-b).

1:徐麦30;2:花培1号;3:郑麦366;4:平安6号;5:济麦4号;6: 众麦998;7: 济麦1号;8: 安麦1号;9: 周麦16;10: 偃高1号;11: 豫麦51号;12: 郑农18;13:Marker DL 2000;14: 郑麦9023;15: 豫麦62号;16: 周麦19;17: 汶农14;18: 豫麦58号;19: 豫麦21号;20: 豫麦49-198;21: 周麦18号;22:豫麦18号;23: 郑麦9962;24: 花培2号;25: 淮麦7号.
2.3黄淮麦区Vrn-D1的显隐性检测
采用引物Intr1/D/F和Intr1/D/R3,Intr1/D/F和Intr1/D/R4分别对91份黄淮麦区品种进行检测,偃展4110、众麦998等38个小麦品种检测到显性突变Vrn-D1(图3-a),其余品种均检测到隐性位点vrn-D1(图3-b).采用引物Vrn1DF和Vrn1-SNP161CR,Vrn1DF和Vrn1-SNP161AR对91份材料进行检测,偃展4110、平安6号、花培8号等18个品种在Vrn-D1启动子区没有此点突变,为Vrn-D1a型(图3-c);豫麦13号、花培2号、花培6号等20个品种在显性Vrn-D1的启动子区有此突变,为Vrn-D1b型(图3-d).
2.4黄淮麦区Vrn-B3的显隐性检测
采用引物Vrn4-B-INS-F/Vrn4-B-INS-R、Vrn4-B-NOINS-F/Vrn4-B-NOINS-R对所有材料进行检测,均检测到隐性位点vrn-B3(图4),未检测到显性突变Vrn-B3,表明检测的91份黄淮麦区小麦品种都含有隐性等位变异vrn-B3.

1:豫麦51号;2: 济麦4号;3:郑州761; 4:徐麦30;5:郑麦366;6:百农3217;7:豫麦13号;8:豫麦10号;9: 漯麦8号;10: 花培6号;11: 汝麦0319;12: 豫农416;13:Marker DL 2000;14: 平安8号;15: 漯麦4-168;16: 百农160; 17: 漯麦9号;18: 豫农982; 19: 矮抗58;20: 豫农949;21:花培2号;22:中育10号;23: 郑麦9987;24:兰考906; 25:周麦24.
1: Yumai 51; 2:Jimai 4; 3: Zhengmai 761; 4: Xumai 30; 5:Zhengmai 366; 6: Bainong 3217; 7:Yumai 13; 8:Yumai 10; 9: Luomai 8; 10: Huapei 6; 11: Rumai 0319; 12: Yunong 416; 13: Marker DL 2000; 14: Pingan 8; 15: Luomai 4-168; 16: Bainong 160; 17: Luomai 9; 18: Yunong 416; 19: Aikang 58; 20:Yunong 949; 21: Huapei 2; 22:Zhongyu 10; 23:Zhengmai 9987; 24: Lankao 906; 25: Zhoumai 24.
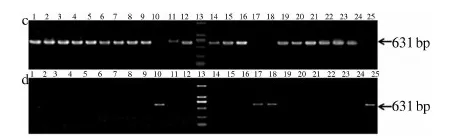
1:豫麦62号;2: 平安6号;3:周麦23 ;4:豫麦10号; 5:郑麦9962;6:豫麦18号;7:豫展2000;8:扬麦10号;9: 扬麦11;10: 花培8号;11: 徐麦30;12: 偃展4110;13:Marker DL 2000;14: 平安6号;15: 周麦23;16: 中育12;17: 花培6;18: 百农3217;19: 豫麦56号;20: 郑麦366;21:漯麦8号;22:扬麦16;23:豫农202; 24:漯麦9号;25:豫麦13号.
2.5黄淮麦区小麦品种中春化基因的分布频率
91个黄淮麦区小麦品种春化基因位点的分子检测(见表3春化基因型)表明,Vrn-A1a基因及其等位变异Vrn-A1b,Vrn-A1c基因以及Vrn-B3在所检测的黄淮麦区品种中不存在;在B1位点,6份材料检测为显性基因(6.6%),其余材料均为隐性基因;有2个品种同时含有Vrn-B1和Vrn-D1显性基因,所占比例为2.2%;在D1位点,有38份材料为显性基因(41.8%),53份为隐性基因(58.2%),因此在黄淮麦区适宜种植的小麦品种中,这4个春化基因位点均为隐性的品种(共49个)分布频率最高,为53.8%,其次为显性突变Vrn-D1(41.8%)和Vrn-B1(6.6%).
2.6Vrn-D1变异情况
对91个黄淮麦区小麦品种春化基因位点的分子检测(表3)表明,Vrn-D1位点的变异类型较多,在38份Vrn-D1显性突变中,18份为Vrn-D1a类型(47.4%),20份材料为Vrn-D1b类型(A/C点突变),占到了52.6%.
2.7黄淮麦区小麦品种春化基因基因型与冬春性的关系
在黄淮麦区小麦品种中共检测到4个春化基因显性变异的4个组合,分别为Vrn-B1,Vrn-D1,Vrn-D1,Vrn-B1/Vrn-D1a.统计资料记载及田间观察记录的小麦冬春性表现型(表3),黄淮麦区小麦品种主要有弱春性,半冬性和冬性品种3种类型,半冬性品种所占比例最大为63.7%,其次为弱春性28.6%,冬性品种为7.7%.根据分子检测到的各小麦品种春化基因的基因型预测其表现型(表3).进一步对预测的表现型与资料记载的表现型进行比较分析,结果表明,当不考虑基因型为Vrn-D1的启动子区单核苷酸突变时,由基因推测的表现型与资料记载的表现型一致性较低(27.5%),这与姜莹等[13]和赵虹等[14]的研究结果基本一致,当考虑基因型为Vrn-D1的启动子区单核苷酸突变时,一致性为51.6%,说明基因型Vrn-D1a和Vrn-D1b的细分可以显著提高小麦品种由春化基因分子检测推断其冬春性的准确性.

1:豫麦51号;2: 济麦4号;3:郑州761;4:徐麦30;5:郑麦366;6:百农3217;7:豫麦13号;8:豫麦10号;9: 漯麦8号;10: 花培6号;11: 汝麦0319;12: 豫农416;13:Marker DL 2000;14: 平安8号;15: 漯麦4-168;16: 百农160;17: 漯麦9号;18: 豫农982;19: 矮抗58;20: 豫农949;21:花培2号;22:中育10号;23: 郑麦9987;24:兰考906;25:周麦24.
1: Yumai 51; 2: Jimai 4; 3: Zhengmai 761; 4:Xumai 30; 5: Zhengmai 366; 6:Bainong 3217; 7: Yumai 13; 8: Yumai 10; 9: Luomai 8; 10: Huapei 6; 11: Rumai 0319; 12: Yunong 416; 13: Marker DL 2000; 14: Pingan 8; 15: Luomai 4-168; 16: Bainong 160; 17: Luomai 9; 18: Yunong 416; 19: Aikang 59; 20: Yunong 949; 21: Huapei 2; 22: Zhongyu 10; 23: Zhengmai 9987; 24: Lankao 906; 25: Zhoumai 24.
图4部分黄淮麦区品种Vrn-B3位点的扩增结果
Fig.4AllelicvariationsdetectedintheVrn-B3geneamongpartialcultivarsinHuang-huaiwheatregion
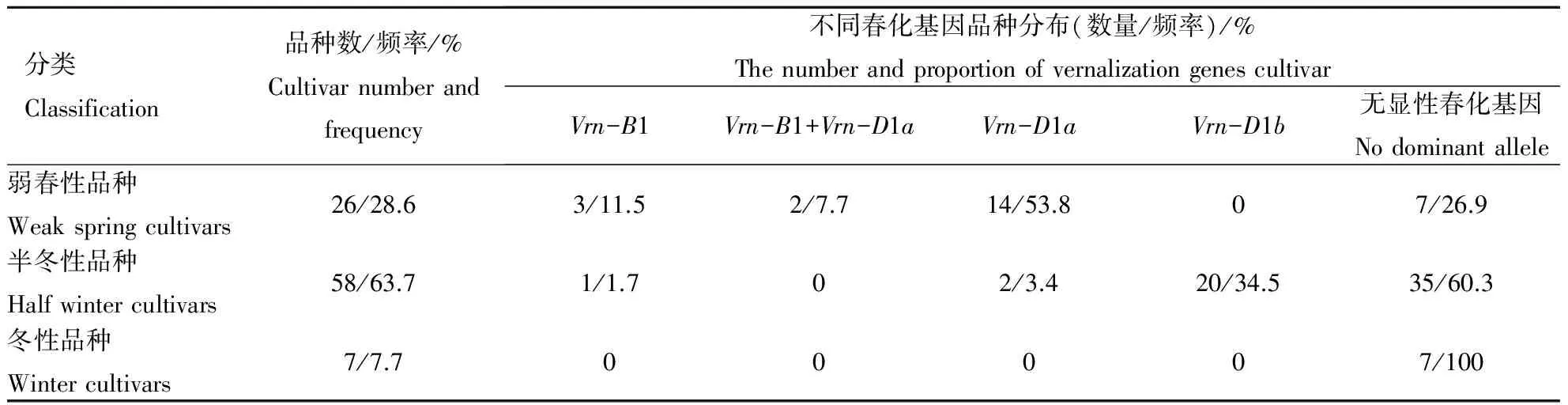
表3 不同冬春性类型品种中春化显性基因比例
3 结论与讨论
3.1黄淮麦区小麦品种春化基因型与冬春性的关系
植物春化发育过程涉及到多个基因的表达调控和相互作用,Vrn1是调控小麦由营养生长转向生殖生长的关键基因,春化基因显性位点Vrn-A1,Vrn-B1和Vrn-D1对低温春化的敏感性和要求不同.LOUKOIANOV等[15]研究发现,从效应分析,Vrn-A1,Vrn-B1,Vrn-D1作用依次减小,即包含Vrn-A1的小麦品种完全不需要春化就能正常成熟,Vrn-D1需要部分春化,Vrn-B1对春化需求则介于两者之间.
本研究检测了黄淮麦区小麦品种的4个春化基因位点(Vrn-A,Vrn-B1,Vrn-D1和Vrn-B3),由基因型推测的冬春性和资料记载及田间表现的一致性为51.6%.所有的冬性品种,各位点春化基因均为隐性;而春化基因各位点均为隐性的品种并不表现冬性,也存在弱春性品种(豫农949、郑农16等)、半冬性品种(徐麦30、郑麦366、漯麦8号等).调查的材料中半冬性品种的比例最大,为63.7%.基因型检测的91份材料中有36份材料(39.6%)的春化位点均为隐性,而资料记载及田间调查记录显示却为半匍匐的半冬性,这是导致由基因型推测的冬春性和资料记载及田间表现的一致性较低的主要原因.以上结果表明,还存在其他影响小麦春化特性的遗传或环境因素.例如,IWAKI等[16]研究发现,中国小麦中含有春化显性基因Vrn-4.另外,BARABáS等[17]发现外源细胞分裂素(KT)可以部分代替春化的作用,促进其开花.STS标记仅检测该引物所在区域的序列片段差异,也许在检测区段之外还存在新的序列变异,本试验利用的Vrn-D1启动子CArG-box区单核苷酸突变而引起的小麦品种冬春性差别便说明了这一点.
3.2Vrn-D1启动子区突变品种的基因型与冬春性表型关系
ZHANG等[9]研究表明,中国小麦品种中春化基因Vrn-D1的分布频率最高,且主要分布在作为全国小麦主产区的黄淮麦区及西南麦区,对Vrn-D1变异的检测及与其相关农艺性状研究具有重要的理论和实践意义.
启动子和内含子均属于基因的非编码区,它们在基因的转录调控中起增强或抑制作用[18].小麦春化基因Vrn1的研究表明,启动子及第1内含子区域的突变与春化特性相关[5~7].对二倍体小麦的研究表明,Vrn1基因启动子CArG-box区的突变使得一些小麦品种由冬性变为春性.SUN等[19]在小麦Vrn-D1基因启动子区的CArG-box区内获得了一处单碱基变异,并通过表达分析证明,这处A/C单碱基变异使携带Vrn-D1显性基因的小麦材料获得2种表型:春性和半冬性.ZHANG等[20]和王敏慧等[21]发现,在Vrn-D1启动子区的CArG-box区有单核苷酸突变(A/C),位于起始密码子上游161 bp的位置,在春性小麦中该突变位点为胞嘧啶C,而半冬性材料中该位点为腺嘌呤A,并将春性品种的Vrn-D1命名为Vrn-D1a,将半冬性品种的Vrn-D1命名为Vrn-D1b.
在检测的38份Vrn-D1显性变异材料中,18份为Vrn-D1a类型,资料记载及田间观察记录显示,豫展2000和莱州137为半冬性,其余16份均为弱春性,一致性为88.9%;20份为Vrn-D1b类型,资料记载及田间观察记录显示这20份材料均为半冬性,一致性达到100%.因此利用该分子标记检测品种的弱春性和半冬性性状具有较高的准确性.
近年春季气温波动频繁,给小麦生产带来一定风险.因此,冬春性的鉴定对小麦品种的审定和推广具有重要意义.黄淮麦区作为全国小麦主产区,小麦种植面积最大,半冬性品种占大部分,而对半冬性品种分子水平上春化基因组成及机理的研究较少,因此,对这一地区的小麦品种春化基因进行深入分析和研究,可有效避免倒春寒等自然灾害造成的减产,指导育种及农业生产.
参考文献:
[1]LAW C N, WORLAND A J, GIORGI B. Genetic-control of ear-emergence time by chromosomes-5A and chromosomes-5D of wheat[J]. Heredity, 1976, 36: 49-58.
[2]NELSON J C, SORRELLS M E, VAN-DEYNZE A E, et al. Molecular mapping of wheat: major genes and rearrangements in homoeologous groups 4, 5, and 7[J]. Genetics, 1995, 141(2): 721-731.
[3]BARRETT B, BAYRAM M, KIDWELL K, et al. Identifying AFLP and microsatellite markers for vernalization response geneVrn-B1 in hexaploid wheat using reciprocal mapping populations[J]. Plant Breeding, 2002, 121(5): 400-406.
[4]IWAKI K, NISHIDA J, YANAGISAWA T, et al. Genetic analysis ofVrn-B1 for vernalization requirement by using linked dCAPS markers in bread wheat (TriticumaestivumL.) [J]. Theoretical and Applied Genetics, 2002, 104(4): 571-576.
[5]YAN L, HELGUERA M, KATO K, et al. Allelic variation at theVRN-1 promoter region in polyploidy wheat[J]. Theoretical and Applied Genetics, 2004, 109: 1677-1686
[6]YAN L, LOUKOIANOV A, TRANQUILLI G, et al. Positional cloning of the wheat vernalization geneVrn1 [J]. Proceedings of the National Academy of Sciences, 2003, 100: 6263-6268.
[7]FU D L, SZÜCS P ,YAN L , et al.Large deletions within the first intron inVrn1 are associated with spring growth habit in barley and wheat[J]. Molecular Genetics and Genomics, 2005, 273: 54-65.
[8]IQBAL M, NAVABI A , YANG R C, et al. Molecular characterization of vernalization response genes in Canadian spring wheat[J]. Genome, 2007,50: 511-516.
[9]ZHANG X K, XIAO Y G, ZHANG Y, et al. Allelic variation at the vernalization genesVrn-A1,Vrn-B1,Vrn-D1 andVrn-B3 in Chinese wheat cultivars and their association with growth habit[J]. Crop Science, 2008, 48: 458- 470.
[10] 杨宗渠,尹 均,周 冉,等. 黄淮麦区不同小麦基因型的春化发育特性研究[J]. 麦类作物学报,2006,26(2):82-85.
[11] 袁秀云,李永春,孟凡荣,等. 黄淮麦区21个小麦品种中春化基因VRN1的组成分析[J].麦类作物学报, 2009, 29(5): 760-765.
[12] LAGUDAH E S, APPELS R, MCNEIL D. TheNor-D3 locus of Triticum tauschii: natural variation and genetic linkage to markers in chromosome 5[J]. Genome, 1991, 34: 387-395.
[13] 姜 莹, 黄林周, 胡银岗. 中国小麦地方品种春化基因的分布及其与冬春性的关系[J]. 中国农业科学, 2010, 43(13):2619-2632.
[14]赵 虹, 胡卫国, 詹克慧,等. 黄淮南片冬麦区主导品种春化基因及冬春性分析[J]. 西北植物学报, 2010, 30(3):495-504.
[15] LOUKOIANOV A, YAN L, BLECH A, et al. Regulation ofVrn-1 vernalization genes in normal and transgenic polyploid wheat[J]. Plant Physiol, 2005, 138(4): 2364-2373.
[16] IWAKI K, NAKAGAWA K, KUNO H, et al. Ecogeographical differentiation in east Asian wheat, revealed from the geographical variation of growth habit andVrngenotype[J]. Euphytica, 2000, 111(2): 137-143.
[17] BARABáS Z, CSEPELY I T. Shortening vernalization of winter wheat with kinetin[J]. Euphytica, 1978, 27(3): 831-835.
[18] FIUME E, CHRISTOU P, GIANì S, et al. Introns are key regulatory elements of rice tubulin expression[J]. Planta,2004,218(5):693-703.
[19] SUN Q M, ZHOU R H, GAO L F, et al. The characterization and geographical distribution of the genes responsible for vernalization requirement in Chinese bread wheat[J]. Journal of Integrative Plant Biology, 2009, 51(4): 423-432.
[20] ZHANG J, WANG Y Y, WU S W, et al. A single nucleotide polymorphism at theVrn-D1 promoter region in common wheat is associated with vernalization response [J]. Theor Appl Gene, 2012, 125(8): 1697-1704.
[21] 王敏慧. 小麦春化基因Vrn-1新等位变异发掘[D]. 北京: 中国农业科学院,2011:1-36.

