肠球菌SYBR Green I实时定量PCR检测方法的建立及应用
宋 月, 崔 敏, 王超群, 付 彤, 韩立强, 魏战勇, 王亚宾
(1.河南农业大学牧医工程学院,河南 郑州 450002;2.北京汉业先科科技有限公司,北京 101500;3.漯河出入境检验检疫局,河南 漯河 462000)
肠球菌(Enterococcus)属于D群链球菌,20世纪末从链球菌属分离出来,正式命名为肠球菌属[1].肠球菌是动物消化道、生殖道常在菌群.近年来对畜禽危害的报道较多,导致的疾病主要有:羔羊的脑炎[2],败血症[3],造成死鸡胚和弱死雏鸡[4],还可引起仔猪的关节炎[5]等疾病;肠球菌引起的食物中毒疾病也时有发生[6].目前,检测肠球菌的主要方法是活菌计数法.传统的活菌计数方法需要细菌的分离鉴定,方法繁琐费时,一般要48~72 h才能出结果,并且该方法灵敏度低,极易产生假阳性和假阴性,在实际应用过程中有很大的局限性,常常需要增菌培养,无法做到对初始样品中肠球菌数目的准确定量.PCR方法的建立为肠球菌的鉴别检测提供了新的依据和方法,已经逐步成为细菌检测的常用方法[7,8].在此基础上的荧光定量PCR方法以其灵敏度高、速度快、特异性强等优点在基因表达水平分析病原体的定性定量检测等方面得到广泛应用[9,10].用荧光定量PCR方法检测细菌,可以大大提高检测的灵敏度和特异性,扩大了样品的检测范围,实现了待检样品的定量检测.本试验根据GenBank发表的肠球菌16s rDNA序列,通过序列分析获得其高度保守的特异性序列,并根据该特异性保守序列设计了1对特异性引物.在此基础上建立了肠球菌SYBR Green I实时定量荧光PCR 检测方法,并对方法进行了评价分析,建立了肠球菌的快速检测方法.对河南部分地区及其周边地市送检的病料进行检测分析,进一步在实践中验证方法的可靠性.从而为兽医临床的诊断和治疗提供理论支持.
1 材料与方法
1.1菌种与临床样品
所用菌株:肠球菌(Enterococcus,ATCC 29212)、绿脓杆菌(Pseudomonasaeruginosa,ATCC 27853)、大肠杆菌(Escherichiacoli.,ATCC 25922)、金黄色葡萄球菌(Staphylococcusaureus,ATCC 25923)、变形杆菌(Proteusbacillusvulgaris,ATCC 12453)、产气荚膜梭菌(Clostridiumperfringens,ATCC 13124),枯草芽孢杆菌、链球菌、乳酸乳球菌为实验室保存菌种.临床样品来自河南各地市及其周边地市的养殖场.
1.2主要试剂及仪器
Roche公司Light Cycler 2.0型荧光定量PCR仪,M J Research公司PTC-200 PCR扩增仪,SYBR Green I荧光PCR试剂、pMD-18 T 载体等购自TaKaRa宝生物工程(大连)有限公司,培养基购自广东环凯生物技术公司,引物由上海生工生物工程公司合成.
1.3引物设计与合成
参考GenBank公布的肠球菌16S rDNA序列,根据其保守区间序列设计合成特异性引物,上游:5′-CCCTTATTGTTAGTTGCCATC- 3′,下游:5′-ACTCGTTGTATTTCCCATTGT-3′,引物由上海生工生物工程公司合成,扩增目的片段长度为144 bp.
1.4细菌核酸的获取
将各种细菌在合适的培养条件下培养过夜,用传统的酚-氯仿抽提法获取细菌基因组DNA,贮存于-20 ℃备用.
1.5质粒标准阳性模板的制备
以提取的肠球菌基因组DNA为模板,用实验室已有的通用引物扩增16S基因片段.PCR产物经过1%琼脂糖凝胶电泳,用胶回收试剂盒回收目的产物.将回收的目的产物片段与pMD-18 T 载体连接,转化DH5α感受态细胞,挑选白色菌落,进行菌液PCR鉴定后,用质粒提取试剂盒提取质粒,送上海生工生物公司测序.将测序正确的阳性质粒作为DNA标准品,用分光光度仪测定浓度后进行10倍系列稀释,用于构建标准曲线.并根据标准质粒的浓度进行分析,根据公式计算出每微升质粒液体中含有的质粒拷贝数.
1.6荧光定量PCR方法的优化
采用SYBR Premix Ex Taq 推荐的反应体系,以出现最高荧光值、出现最小的样本阈值循环数(Ct值)以及在融解曲线分析中不出现非特异性峰为指标,对退火温度、循环条件和循环次数等进行优化.
1.7标准曲线的绘制
在稀释好的标准质粒中选取5个适宜的稀释度,以这5个稀释度的质粒液体作为标准阳性模板进行实时荧光定量PCR扩增反应,每个稀释度做3个平行试验.对扩增结果进行分析,绘制标准曲线.
1.8敏感性、特异性和重复性的检测
1.8.1 敏感性试验 以标准质粒为模板的稀释液作为模板进行灵敏度的检测,以在35个循环是否起跳作为判断标准.若在35个循环之前起跳,即判定为阳性,即样品中可以检测出肠球菌.
1.8.2 特异性试验 用建立好的扩增方法以提取的绿脓杆菌、大肠杆菌、金黄色葡萄球菌、枯草芽孢杆菌、变形杆菌、产气荚膜梭菌、链球菌、乳酸乳球菌等菌株基因组DNA为模板进行扩增,检验引物的特异性.
1.8.3 重复性试验 使用构建好的阳性质粒模板,选取3个稀释度,分别作为模板在同等条件下进行扩增,每个稀释度做3个平行试验,计算Ct值的变异系数;同时,将上述所用样品保存,每7 d检查1次,连续检测14 d,计算不同批次间Ct值的变异系数.
1.9临床检测
对来自河南省及其周边地区的33份患乳房炎奶牛所产的牛奶和28份疑似绿脓杆菌病的剖检样品按照实验室常规方法进行处理后,分别用新建立的荧光定量PCR方法和常规的PCR方法进行检测,比较2种方法的阳性检出率和符合率,并用统计学方法进行结果分析.
2 结果与分析
2.1荧光定量PCR反应条件的优化
通过5个批次的重复试验,证明在25 μL反应体系中,扩增参数为94 ℃,5 min;循环40次:94 ℃, 5 s;59 ℃, 20 s;72 ℃,25 s.这种条件下扩增效率最高,且溶解曲线无非特异性峰.动力学扩增曲线如图1,溶解曲线如图2.溶解温度分别为86.06,86.05,86.15,86.05,86.04 ℃,平均值为86.07 ℃,标准差为 0.045,变异系数为0.000 53;统计分析结果显示,各个溶解温度之间变异极小,引物特异性强.
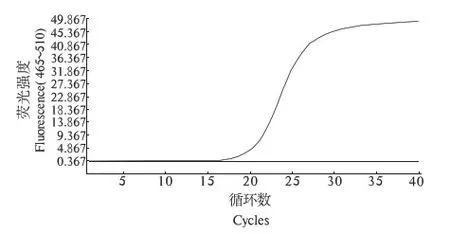
图1 荧光定量PCR扩增动力学曲线

图2 肠球菌扩增溶解曲线
2.2标准曲线的建立
经测定计算得出重组质粒拷贝数为1.74×1011拷贝·μL-1, 经10倍系列稀释后,选取1.74×107至 1.74×103的质粒作为标准品按照优化好的条件进行荧光定量PCR扩增,得到的标准曲线(图3).纵坐标为Ct值,横坐标为拷贝数的对数;建立函数关系,得到二者的线性关系,斜率为-3.83,截距为39.03,相关系数为0.992.结果显示良好的线性关系.
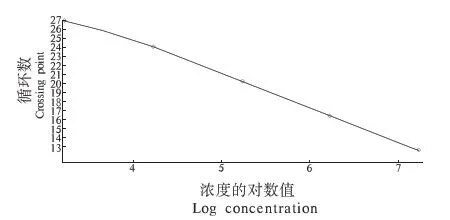
图3 肠球菌荧光定量PCR标准曲线
2.3敏感性试验
以标准质粒为模板的稀释液作为模板进行灵敏度的检测,检测结果表明,荧光定量PCR的最低检测量为17拷贝·μL-1.
2.4特异性试验
扩增结果显示(图4),只有绿脓杆菌扩增为阳性,其他常见菌株,如大肠杆菌、金黄色葡萄球菌、肠球菌、枯草芽孢杆菌、变形杆菌、产气荚膜梭菌、链球菌、乳酸乳球菌,以及阴性对照扩增结果均为阴性.由图4可知,只有大肠杆菌在优化条件下可以扩增出特异性曲线,其它细菌无扩增曲线,试验表明该方法具有较好的特异性.
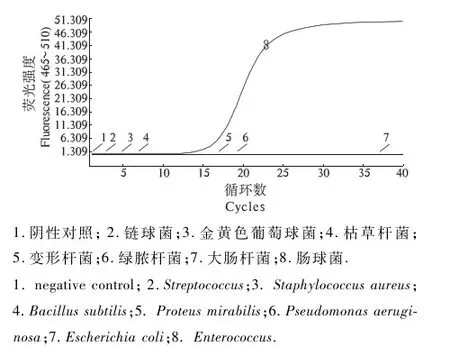
1.阴性对照; 2.链球菌;3.金黄色葡萄球菌;4.枯草杆菌;5.变形杆菌;6.绿脓杆菌;7.大肠杆菌;8.肠球菌.
1. negative control; 2.Streptococcus;3.Staphylococcusaureus;4.Bacillussubtilis;5.Proteusmirabilis;6.Pseudomonasaeruginosa;7.Escherichiacoli;8.Enterococcus.
图4特异性扩增曲线
Fig.4SpecificdetectionofReal-timePCR
2.5重复性试验
单次重复性试验结果如图5,多次重复性试验结果如表1和表2.从表1,表2可以看出,批内和批间重复性试验其变异系数均小于1%,说明建立的荧光定量PCR具有较好的重复性.
2.6临床检测结果
对总共61份样品的检测结果如表3.荧光定量法和普通PCR检测双阳性病料39份,双阴性病料14份,荧光定量法检测出单阳性病料8份.二者的符合率为86.89%,荧光定量的阳性率比普通方法高13.11%.用统计学的方法进行分析,采取配对样品T检验,得到2种方法的P值为0.01,差异显著,表明所建立的荧光定量检测方法敏感性明显高于普通方法.
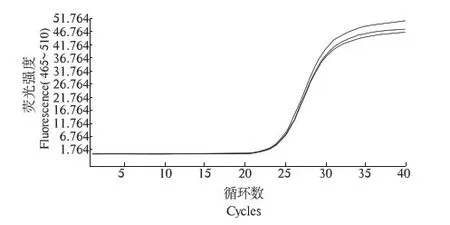
图5 重复性扩增曲线
表1同一批次样品重复性扩增结果
Table1Resultsofrepeatabilitydetectioninthesamebatch
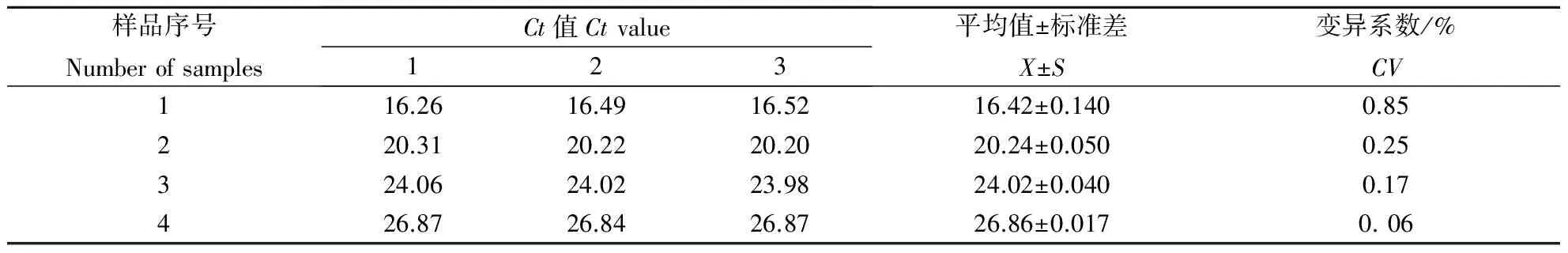
样品序号NumberofsamplesCt值Ctvalue123平均值±标准差X±S变异系数/%CV116.2616.4916.5216.42±0.1400.85220.3120.2220.2020.24±0.0500.25324.0624.0223.9824.02±0.0400.17426.8726.8426.8726.86±0.0170.06
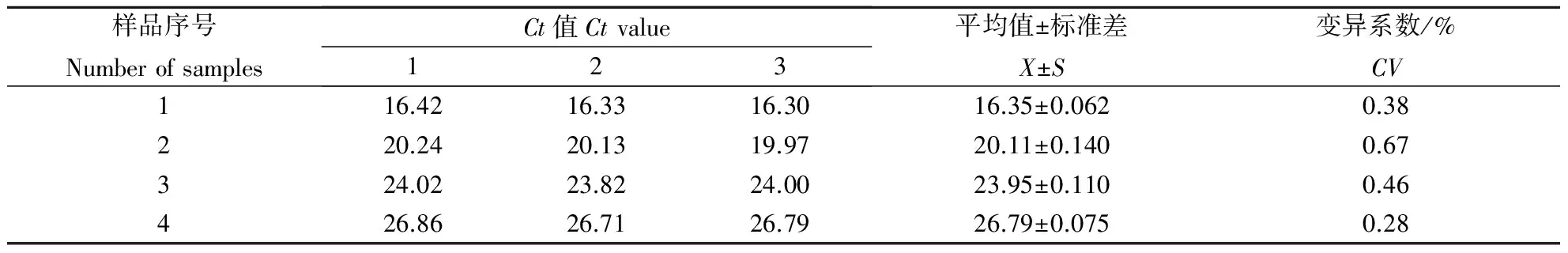
表2 所有批次样品重复性扩增结果
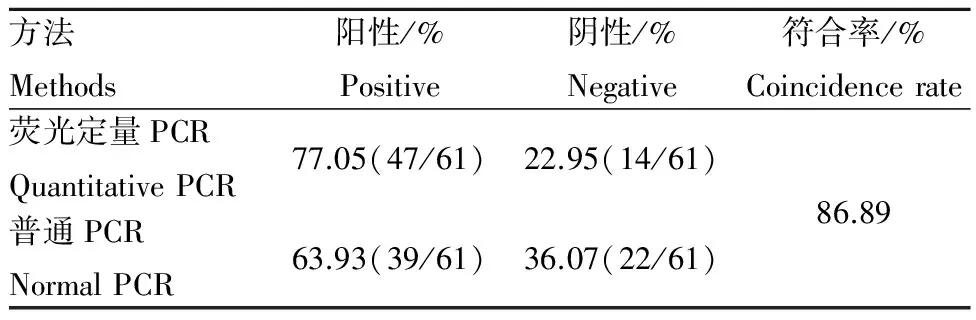
表3 临床检测结果
3 讨论
传统的细菌检测需要对细菌进行分离鉴定,耗时费力且极易造成假阴性.随着PCR技术的诞生,在一定程度上解决了这一问题.但是普通的PCR在定量研究上仍然不能尽如人意,无法准确的定量检测样品中细菌的数目,定量检测仍是一个难题.荧光定量PCR技术的应用有效的解决了这一难题,使得微生物的检测可以在保证方法便捷、结果可靠的同时做到定量检测[11].
16S rDNA是细菌的高度保守序列,其可变区在不同细菌之间存在一定程度的差异,具有细菌属或种特异性;选择可变区设计PCR 特异性引物,则可将标本中的细菌鉴定到属甚至种的水平,是细菌鉴别较为理想的靶序列[12].本试验针对肠球菌16S rDNA的特异性保守序列设计引物,建立肠球菌的SYBR Green I实时定量PCR检测方法,从而提高检测的特异性.在特异性检验中,用所建立的方法检测数十种常见的菌群,均无特异性扩增,说明该方法具有良好的特异性.
试验过程中,首先构建肠球菌16S rDNA特异性片段的重组质粒,选取5个不同的稀释度,以这5个稀释度作为模板分别进行荧光定量PCR扩增,获得不同的扩增曲线.扩增结果显示,样品的初始浓度越高,Ct值越小,经线性回归分析表明,起始模板浓度与Ct值之间呈现良好的线性回归关系.据此制作标准曲线,可根据样品扩增的Ct计算样品的初始浓度.
对所建立的方法进行重复性检验,组内和组间的变异系数小于1%,说明该方法准确率和重复性良好;其检测最低限度为17拷贝·μL-1,说明该方法良好的重复性和较高的灵敏度,可用于肠球菌的临床检测.本试验建立的荧光定量PCR检测方法可直接对临床样品的DNA进行检测,可以在12个小时内完成样品的采集、DNA提取和荧光定量PCR检测的全程;与传统方法相比,避免了细菌增菌培养和细菌分离环节,减少了工作量,具有快速、准确的优点.对临床样品的检测是该方法的初步应用,其与普通方法的符合率85.45%,阳性检出率比普通PCR方法高18.87%,该方法的建立对肠球菌的检测具有重要意义,有利于临床疾病的诊断和食品中肠球菌数目的检测,可为畜产品的安全检测提供一定的检验依据.
参考文献:
[1]蔡文成. 实用临床微生物诊断学[M].南京:东南大学出版社,1998.
[2]齐亚银, 王静梅, 张 莉, 等. 应用 16S rDNA 全序列同源性分析鉴定致羔羊脑炎性粪肠球菌[J]. 中国兽医学报, 2011, 31(5): 703-709.
[3]狄婷婷, 高 原, 聂 鑫, 等. 致鹅败血症粪肠球菌的分离鉴定[J]. 中国预防兽医学报, 2012, 34(3): 192-196.
[4]齐景文, 于长泳, 闫明媚, 等. 铅黄肠球菌引起雏鸡发病死亡的诊治报告 [J]. 中国家禽, 2006, 28(19): 88-89.
[5]王亚宾, 张 祥, 胡清林, 等. 仔猪关节炎粪肠球菌生物学特性研究[J]. 河南农业大学学报, 2011, 45(2): 183-187.
[6]朱宝玉, 廖兴广, 张秀丽, 等. 一起由鸡肠球菌引起食物中毒的调查[J]. 中国卫生检验杂志, 2004, 14(2): 241-242.
[7]王亚宾, 陈丽颖, 胡 慧, 等. 肠球菌主要毒力基因多重 PCR 方法的建立与应用[J]. 中国兽医学报, 2012, 32(12): 1815-1818.
[8]王亚宾, 陈丽颖, 胡 慧, 等. 猪源粪肠球菌和屎肠球菌多重 PCR 快速鉴定方法的建立[J]. 动物医学进展, 2010, 31(S): 127-131.
[9]胡 慧, 陈雅君, 段志刚, 等. 大肠杆菌 O157: H7 特异基因的实时荧光定量 [J]. 食品科学, 2011, 32(12):12-16.
[10] 黄世旺, 卢亦愚, 徐丹戈, 等. Taqman 荧光定量 PCR 技术快速检测霍乱弧菌方法的建立[J]. 中国卫生检验杂志, 2006, 16(8): 923-924.
[11] 欧阳松应, 杨 冬, 欧阳红生, 等. 实时荧光定量PCR技术及其应用 [J]. 生命的化学, 2004, 24(1): 74-76.
[12] SONTAKKE S, CADENAS M B, MAGGI R G, et al. Use of broad range 16S rDNA PCR in clinical microbiology[J]. Journal of Microbiological Methods, 2009, 76(3): 217-225.

