不同品种小麦与蚕豆间作对蚕豆枯萎病发生、根系分泌物和根际微生物群落功能多样性的影响
杨智仙, 汤 利, 郑 毅, 2, 董 坤, 董 艳*
(1 云南农业大学资源与环境学院,昆明 650201; 2 西南林业大学,昆明 650224;3 云南农业大学食品科技学院,昆明 650201)
连续种植某一作物,即使在正常的栽培管理条件下,也会出现作物生长发育不良、 病害发生严重、 产量和品质下降等连作障碍现象[1]。许多蔬菜[2]、 中药材[3]、 果树[4]、 大田作物[5]等单一连续种植均会导致土传病害发生而使作物减产。因此,连作障碍的形成原因及其克服与消除技术已成为国内外的研究热点[1]。尽管引起连作障碍的原因较多,但最根本的原因还是土壤微生物区系和多样性失调,病原微生物富集、 有益微生物减少,使病原菌更容易侵染植物而引发植物的各种土传病害,因此调控微生物的数量、 活性和群落结构是缓解连作障碍的关键[6]。生物多样性是植物病害流行的天然屏障,而作物间作不仅能增加地上部的生物多样性,也可增加地下部土壤微生物多样性,目前已经成为缓解作物连作障碍的安全有效措施之一[7-8]。研究表明,西瓜与旱作水稻间作增加了西瓜根际的微生物数量,减轻了西瓜枯萎病的发生并增加了西瓜产量[8]。
蚕豆连作导致土传枯萎病普遍发生,严重制约了我国的蚕豆生产,目前生产中尚无有效的化学防治措施[9]。本研究组的前期研究表明,小麦与蚕豆间作增加了蚕豆根际微生物数量并抑制了蚕豆枯萎病的发生[10-11],蚕豆根际微生物群落多样性的变化影响着蚕豆枯萎病的发生[12],在选用的3个不同品种小麦与蚕豆间作后发现,在小麦养分吸收利用、 根际速效养分及小麦白粉病的控制效果方面均存在显著的差异[13-14]。有关不同品种小麦与蚕豆间作对蚕豆枯萎病发生和根际微生物多样性变化的影响研究还未见报道。为此本试验选择不同品种小麦与蚕豆间作,研究不同品种小麦与蚕豆间作对蚕豆枯萎病发生及根际微生物多样性的影响,从微生物多样性与连作障碍关系角度阐明间作控制土传病害的作用机理,为间作系统选择种植有益的伴生作物、 进行作物品种合理搭配、 控制土传病害提供理论依据。
1 材料与方法
1.1 田间试验
田间试验在云南省安宁市禄脿镇上村进行,试验地土壤为红壤,连作蚕豆8年,土壤有机质含量14.5 g/kg,全氮1.21 g/kg,碱解氮59.8 mg/kg,速效磷 29.9 mg/kg,速效钾 52.1 mg/kg,pH值6.5。
1.1.1 试验设计 试验采用单因素随机区组设计,设蚕豆单作(B),云麦42与蚕豆间作(YM42//B),云麦47与蚕豆间作(YM47//B)及绵阳29与蚕豆间作(MY29//B) 4个处理,每个处理重复3次,共12个小区,小区面积 32.4 m2。小麦条播,行间距0.2 m; 蚕豆点播,行距0.3 m,株距0.15 m。间作小区按6行小麦2行蚕豆的方式种植,间作小区内有3个小麦种植带,4个蚕豆种植带。小麦和蚕豆于2011年10月16日同时播种,2012年5月3日收获。种子购于云南省农业科学院。
小麦施氮量为 N 112.5 kg/hm2,施磷量为 P2O5112.5 kg/hm2,施钾量为 K2O 112.5 kg/hm2,不施有机肥。氮肥50%作底肥,50%作追肥,磷肥和钾肥作基肥一次性施入。蚕豆氮肥用量为小麦的一半,即56.25 kg/hm2,磷肥和钾肥用量与小麦相同。
1.1.2 测定项目和方法
蚕豆枯萎病调查 于蚕豆鼓荚期进行调查,调查时单作小区按对角线法选5点,每点调查3株,每个小区共调查15株; 间作小区在两个蚕豆带上选取5点(第一个带选2点,第二个带选3点),每点调查3株,每个小区共调查15株。蚕豆枯萎病调查按5级分类标准进行[10]。
发病率(%)=(发病株数/调查总株数) ×100
病情指数(%)=Σ(各级病株数×相应级值)/(最高级值×调查总株数)×100
土壤样品的采集 于蚕豆鼓荚期(发病盛期)进行采样,先将蚕豆植株从土壤中整体挖出,采用抖土法抖掉与根系松散结合的土体土,然后将与根系紧密结合的土壤刷下来作为根际土壤样品。蚕豆单作处理中,每个处理的每个重复小区对角线5点取样,每点采蚕豆3株,然后将15株蚕豆的根际土壤混合为1个样品; 间作处理中,在每个处理的每个重复中选2个间作带,每个间作带内选取蚕豆7株,将2个间作带取得的14株蚕豆根际土壤混合为1个样品。
土壤微生物代谢功能多样性分析 土壤微生物代谢功能多样性采用Biolog方法进行分析。 称取10.0 g 土壤加入90 mL无菌的0.85% NaC1溶液,在摇床上振荡30 min,将土壤样品稀释至10-3,吸取150 μL稀释液至ECO板的微孔中,接种好的板置于25℃恒温培养,每隔24 h 在Biolog EmaxTM自动读盘机上用 Biolog Reader4.2软件(Biolog, Hayward, CA, USA)读取590 nm波长的光密度值,培养时间为168 h。采用培养72 h的数据进行土壤微生物碳源利用分析和主成分分析[15]。
微生物多样性指数(H)采用Shannon-Wiener指数法计算:
H=-Σ(Pi×lnPi)
式中, Pi=(C-R)/Σ(C-R)。C为每一个微孔的光密度值,R为ECO板空白微孔的光密度值。
丰富度指数(S)指微生物群落利用碳源种类的数目,即颜色变化孔数。
1.2 盆栽试验
盆栽试验土壤采自田间试验地, 土壤基本养分状况、 试验设计、 施肥量等与田间试验相同。试验设4个处理,每个处理重复4次,共计16盆。每盆装土5 kg,装土前先在盆上套上塑料袋并在塑料袋底部打孔,以便能取出根系收集根系分泌物而尽量减少根的损伤。
测定时,从冰箱取出离心管解冻、 过膜(0.25 μm)。根系分泌物中总糖含量测定采用蒽酮比色法[17]; 氨基酸的测定采用氨基酸自动分析仪(L8800); 有机酸的测定使用高效液相色谱仪,色谱条件为: 250 mm×4.6 mm C18反相柱(Altima C-18),流动相 25 mmol/L KH2PO4(pH 2.25),流速为1 mL/min,温度为31℃,测定波长214 nm,进样量为20 μL。
1.3 数据处理
采用SAS9.0软件对试验数据进行单因素方差分析和主成分分析(PCA)。
2 结果与分析
2.1 不同品种小麦与蚕豆间作对蚕豆枯萎病的影响
从图1可以看出,云麦42和云麦47与蚕豆间作均显著降低了蚕豆枯萎病的发病率和病情指数。与蚕豆单作(B)相比,YM42//B和YM47//B处理使枯萎病发病率均降低23.1%, 病情指数分别降低47.6%和33.3%,而MY29//B处理对发病率和病情指数均无显著影响。
2.2 不同品种小麦与蚕豆间作对根系分泌物含量的影响
表1表明,与蚕豆单作(B)相比,YM42//B和YM47//B处理显著增加了根系分泌中有机酸的含量,分别比B增加174.89%和162.61%,而MY29//B处理与B无显著差异。YM42//B与 B处理相比显著降低了根系分泌物中游离氨基酸的含量,降幅为31.15%,而YM47//B和MY29//B处理有降低根系分泌物中游离氨基酸含量的趋势,但与B处理无显著差异。不同品种小麦与蚕豆间作对根系分泌物中可溶性总糖含量的影响与间作对有机酸的影响相反,即与蚕豆单作(B)相比,YM42//B和YM47//B处理显著降低了根系分泌物中可溶性总糖的含量,分别比B处理降低了78.78%和72.81%,而MY29//B处理与单作处理间可溶性总糖含量无显著差异。
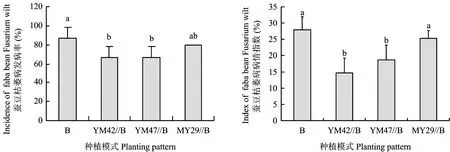
图1 不同品种小麦与蚕豆间作对蚕豆枯萎病发病率和病情指数的影响Fig.1 Effects of different wheat cultivars intercropped with faba bean on incidence and index of faba bean Fusarium wilt

表1 不同品种小麦与蚕豆间作对根系分泌物含量的影响
2.3 不同品种小麦与蚕豆间作对根际微生物碳源利用强度的影响
从图2可以看出,间作对碳源利用强度有显著影响(F=22.95,P<0.01)。YM42//B和YM47//B处理的根际微生物对碳源利用强度最高,显著高于蚕豆单作,分别比蚕豆单作高13.9%和11.7%,而MY29//B处理的根际微生物对碳源的利用强度比蚕豆单作显著降低18.6%。
蚕豆单作和间作条件下根际微生物对Biolog ECO板中利用强度较高的碳源是糖类、 氨基酸和羧酸类。间作对糖类(F=53.14,P<0.01)、 氨基酸(F=78.16,P<0.01)和羧酸类(F=56.06,P<0.01)碳源的利用均有显著影响(图3)。
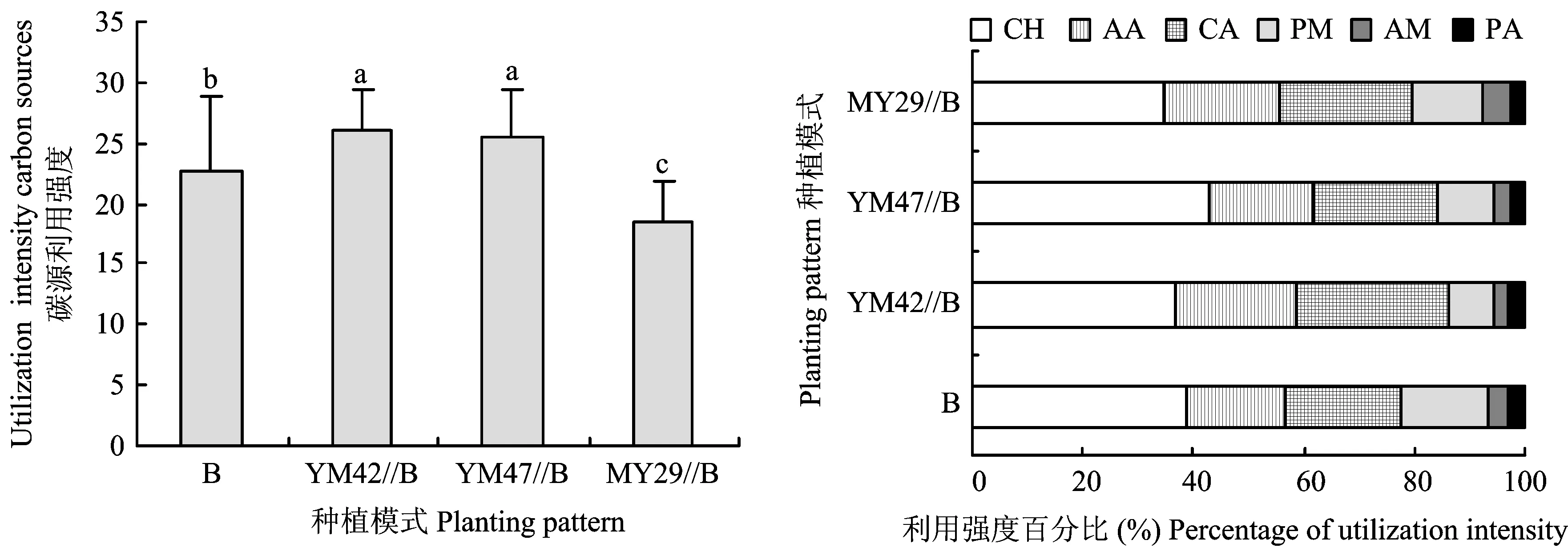
图2 不同种植模式下蚕豆根际微生物对Biolog ECO板中六类碳源的利用强度及百分比Fig.2 Percentage of intensely utilized substrates among chemically similar substrate classes of Biolog ECO plate by faba bean rhizosphere microbe in different planting patterns
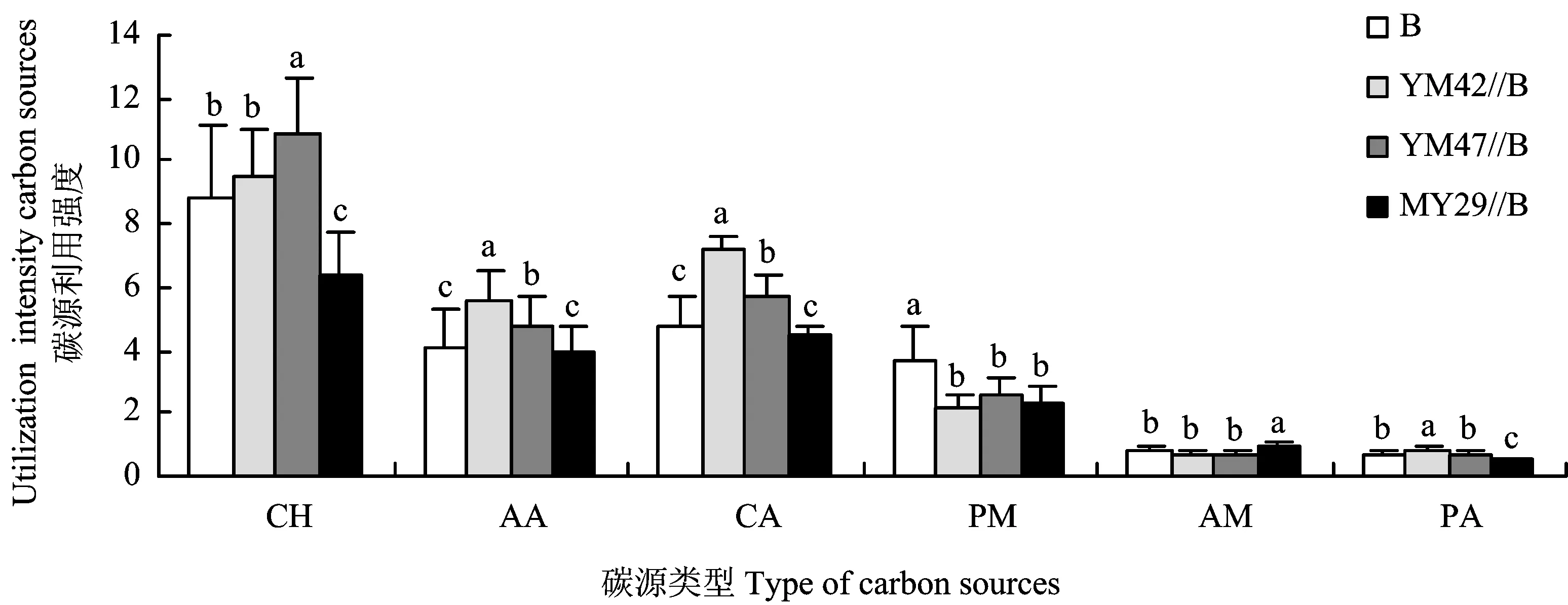
图3 间作对蚕豆根际微生物利用Biolog ECO板中六类碳源的影响Fig.3 Effect of the intercropping on the ability to utilize six types of carbon source of Biolog ECO plate by faba bean rhizosphere microbe
在不同间作处理对糖类的利用方面,与蚕豆单作相比,YM47//B处理显著提高了根际微生物对糖类的利用,提高幅度为23.9%; 而MY29//B处理显著降低了对糖类的利用,比蚕豆单作降低27.4%; YM42//B处理与蚕豆单作无显著差异。从间作对氨基酸类和羧酸类碳源的利用来看,YM42//B和YM47//B处理显著提高了根际微生物对氨基酸类和羧酸类碳源的利用,YM42//B和YM47//B处理分别使氨基酸类碳源利用提高39.2%、 18.4%,使羧酸类碳源利用分别提高50.4%和18.7%,MY29//B处理与蚕豆单作无显著差异。而间作显著降低了根际微生物对聚合物类碳源的利用(F=16.40,P<0.01)。
2.4 不同品种小麦与蚕豆间作对蚕豆根际土壤微生物多样性指数的影响
从图4可看出,云麦47与蚕豆间作显著降低了根际微生物的Shannon多样性指数,而云麦42和绵阳29与蚕豆间作对Shannon多样性指数无显著影响。与单作相比,3个品种小麦与蚕豆间作均显著提高了蚕豆根际微生物的丰富度指数,其中YM42//B处理丰富度指数提高了13.0%,YM47//B处理提高8.7%,而MY29//B处理提高了4.4%。
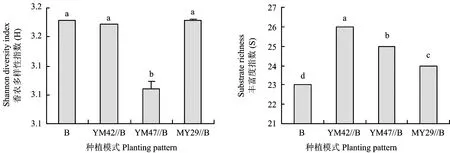
图4 间作对蚕豆根际微生物Shannon多样性指数(H)和丰富度(S)的影响Fig.4 Effect of the intercropping on Shannon diversity index (H) and richness (S) of rhizosphere microbe of faba bean
2.5 根际微生物多样性的主成分分析
应用主成分分析(PCA),从31个变量中提取2个主成分因子,第1主成分(PC1)和第2主成分(PC2)分别可以解释所有变量的44.9%和32.6%, 2个主成分累积方差贡献率达到77.5%,可认为前2个主成分能够表征原来31个变量的特征。因此,取前2个主成分(PC1和PC2)的得分作图来表征微生物群落碳源代谢特征。
从图5可看出,YM42//B和YM47//B处理与B有较好的分离,其中YM42//B与B在PC1和PC2上均有较好的分离,其中又以在PC1上的分离较大,YM47//B与B也是在PC1和PC2上有较好的分离,但以在PC2上的分离较大,而MY29//B与B的分离较小。表明YM42和YM47与蚕豆间作种植均明显改变了蚕豆根际微生物的群落功能多样性,且YM42和YM47与蚕豆间作改变蚕豆根际微生物群落结构是由根际微生物利用不同碳源的差异而引起的。YM42//B处理改变蚕豆根际微生物是由微生物利用与PC1明显相关的碳源引起的,而YM47//B处理引起蚕豆根际微生物群落结构的改变主要是由与PC2相关性较大的碳源利用差异引起的。
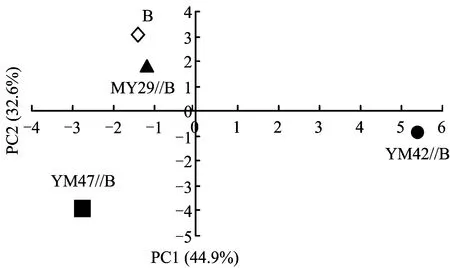
图5 单、间作处理根际微生物碳源利用特征的主成分分析Fig.5 Principal components analysis of carbon utilization profiles in wheat and faba bean rhizosphere microbial community of monocropping and intercropping treatments
为了找到对PC1和PC2影响较大的碳源种类,进一步利用PC1和PC2得分系数与31种碳源吸光度值进行相关分析得到相关系数,相关系数绝对值越大,表示该碳源对主成分的影响越大。从表2可看出,与PC1有较高相关性的碳源有12个(相关系数r>0.8),主要包括糖类(4个)、 氨基酸类(3个)、 羧酸类(3个)、 聚合物类(1个)和胺类(1个); 其中达到显著差异的碳源分别是糖类中D-半乳糖酸-γ-内酯、 N-乙酰基-D-葡萄糖胺、 D-甘露醇和D,L-α-甘油磷酸盐; 氨基酸类中的L-天冬酰胺酸; 羧酸类碳源中的α-丁酮酸和D-苹果酸; 胺类碳源中的腐胺。而与PC2具有较高相关性的碳源有7个,主要包括糖类(3个)、 羧酸类(3个)和聚合物类(1个)。以上分析表明,在PC1和PC2上相关性较高的碳源主要是糖类、 羧酸类和氨基酸类碳源,这3类碳源是区分单作和间作处理间差异的敏感碳源。
从表2还可以看出,YM42//B处理对蚕豆根际微生物群落功能多样性的改变主要是由利用糖类碳源(D-半乳糖酸-γ-内酯、 D-甘露醇、 N-乙酰基-D-葡萄糖胺、 D,L-α-甘油磷酸盐)、 氨基酸类碳源(L-天冬酰胺酸、 L-丝氨酸、 L-苏氨酸)、 羧酸类碳源(D-半乳糖醛酸、 α-丁酮酸、 D-苹果酸)、 聚合物碳源(α-环糊精)和胺类碳源(腐胺)的差异引起的。而YM47//B处理对蚕豆根际微生物群落功能多样性的改变主要是由利用糖类碳源(β-甲基-D-葡萄糖苷、 i-赤藓糖醇、 α-D-乳糖)、 羧酸类碳源(丙酮酸甲酯、 D-葡萄糖胺酸、 衣康酸)和聚合物碳源(糖原)的差异引起的。
3 讨论与结论
3.1 间作对根际微生物群落结构和根系分泌物的影响及其与枯萎病的关系
间作是利用种间互作控制病虫害发生和提高粮食产量的传统农作措施,间作控病增产现象已在多种间作体系中得到证实[18-19]。 研究表明,对作物土传病害的抑制在一定程度上是土壤微生物群体的作用,当微生物群落结构越丰富、 多样性越高时对抗病原菌的综合能力就越强[20]。通过增加系统多样性的间作栽培防治连作病害尤其是土传病害是近年来的研究热点之一[8, 10, 19]。小麦与黄瓜间作提高了黄瓜根际土壤微生物群落多样性,降低了黄瓜枯萎病的病情指数[19]。药用植物套种花生能有效调节土壤微生物区系的定向发展而缓解花生连作障碍[21]。本研究结果表明,YM42//B和YM47//B处理明显改变了蚕豆根际微生物群落,其中又以云麦42的影响大于云麦47,而MY29//B处理对蚕豆根际微生物群落影响不明显。YM42//B和YM47//B 处理均显著提高了蚕豆根际微生物的丰富度指数。从间作对蚕豆枯萎病的控制效果来看,也同样表现为YM42//B>YM47//B,而MY29//B无显著控制效果,表明小麦蚕豆间作显著增加了蚕豆根际微生物的丰富度并改变其群落结构,最终减轻了蚕豆枯萎病的发生。但间作改变根际微生物群落结构、 提高丰富度指数并控制蚕豆枯萎病的发生受小麦品种的影响,表明间作条件下非寄主作物品种的差异对间作控病效果具有重要影响。

表2 31 种碳源与PC1、 PC2 的相关系数(r)
根系分泌物通过影响根际微生物活性、 多样性而对土传病害产生影响,因为根系分泌物含有的糖类、 氨基酸和维生素等物质不仅为根际微生物的生存和繁殖提供了所需的营养和能源物质,而且间作系统中不同作物会产生不同的特异根系分泌物,并形成与之相适应的根际微生物群落,从而提高土壤微生物的整体代谢活性,促进土壤微生物群落结构多样化的形成,使土壤健康发展[22]。旱作水稻根系分泌物能改变西瓜根际土壤微生物群落结构,从而减轻西瓜枯萎病的发生[8]。不同品种小麦具有不同程度的化感潜力,品种间的化感潜力存在显著的差异[23],根系分泌是植物化感作用的重要途径之一[24]。本研究中YM42//B和YM47//B处理显著增加了根系分泌物中有机酸的含量,为根际微生物的生长提供了更多的碳源,从而促进了根际微生物的增殖,提高了对蚕豆枯萎病的抗性。根系分泌物也是影响土壤中病原菌生长繁殖的重要因素,与土传病害密切相关[25]。水稻西瓜间作较好地抑制了西瓜枯萎病的危害,原因是西瓜根系分泌物中的可溶性糖含量及游离氨基酸的含量和种类显著多于水稻根系分泌物,西瓜根系分泌物的高糖和高氨基酸供给,可以为其致病菌提供丰富的营养,利于增殖,而与西瓜间作的水稻根系分泌物的低糖和低氨基酸供给不但利于其抑菌化感作用的充分发挥,更能在一定程度上削弱西瓜对病原菌的营养刺激[26]。本研究中YM42//B和YM47//B处理显著降低了根系分泌物中可溶性总糖和游离氨基酸的含量,可能降低了对蚕豆枯萎病菌的刺激而减轻枯萎病的危害。
3.2 间作条件下根际微生物对Biolog ECO板中碳源利用强度的影响及其与枯萎病的关系
烤烟接种黑胫病菌降低了感病品种根际微生物对碳源的总体利用能力[27]。Borrero等[28]研究了不同栽培基质条件下番茄根际微生物对Biolog ECO板中碳源利用与尖孢镰刀菌侵染引起的番茄枯萎病抗性关系时发现,番茄生长于对枯萎病抗性较高的基质中时,根际微生物对羧酸类、 氨基酸类、 胺类、 酚酸类和聚合物有较高的利用率,而生长于对枯萎病抗性较低的基质中时,根际微生物几乎不能利用上述几类碳源,反映出根际微生物对Biolog ECO板碳源利用率较高时对番茄枯萎病具有较高的抗性。本研究结果表明,YM42//B和YM47//B处理均显著提高了蚕豆根际微生物对碳源的总利用强度,同时也显著提高了蚕豆根际微生物对氨基酸类碳源及羧酸类碳源的利用强度,而MY29//B处理对碳源总利用能力和糖类、 氨基酸及羧酸类碳源的利用强度均无显著影响。本研究结果还显示,YM42//B和YM47//B处理提高了蚕豆根际微生物对碳源的利用能够促进根际微生物的增殖而抑制病原菌的生长,从而控制了枯萎病的发生。这可能是小麦蚕豆间作条件下根际微生物能够利用多种碳源且利用效率较高,从而使间作系统根际微生物生长更好,最终减少了对病原菌供应可用的碳源而使病原菌不能大量增殖。
3.3 间作对根际微生物碳源利用种类的影响及其与枯萎病的关系
桑树与大豆间作系统中,Biolog ECO板中糖类、 羧酸类和聚合物类碳源是微生物利用的主要碳源,可作为区分不同种植模式下微生物碳源利用类型的依据[29]。本研究中,糖类、 羧酸类和氨基酸类碳源是区分YM42//B和B处理间的敏感碳源,而区分YM47//B和B处理间的敏感碳源是糖类和羧酸类。本研究结果表明, YM47//B和YM42//B处理控制枯萎病的效果差异与糖类、 羧酸类和氨基酸类碳源的利用有关,尤其是与氨基酸类碳源的利用有密切的关系。
氨基酸类碳源中的L-天冬酰胺酸、 L-苏氨酸在PC1上相关系数为正值,YM42//B处理位于PC1的正轴方向,表明YM42//B处理提高了根际微生物对这两种氨基酸碳源的利用。在西瓜枯萎病研究中,已经证实了天冬酰胺酸、 苏氨酸能够促进尖孢镰刀菌孢子萌发和菌丝生长[26],因此YM42//B处理控制蚕豆枯萎病发生与提高对L-天冬酰胺酸、 L-苏氨酸利用有关。糖类碳源中YM42//B处理提高了对D-半乳糖酸-γ-内酯、 D,L-α-甘油磷酸盐的利用,YM47//B处理提高了对β-甲基-D-葡萄糖苷和i-赤藓糖醇的利用。羧酸类碳源中YM42//B处理提高了对D-半乳糖醛酸、 α-丁酮酸、 D-苹果酸的利用; 而YM47//B处理提高了对D-葡萄糖胺酸、 衣康酸的利用。表明小麦与蚕豆间作通过对这些碳源的利用而提高了根际微生物的活性,减少了对病原菌供应有效的糖类和羧酸类碳源,进而抑制了镰刀菌的生长。但YM42//B和YM47//B高效利用的糖类和羧酸类碳源完全不同,同时YM42//B处理高效利用的碳源种类明显多于YM47//B处理。表明YM42//B处理和YM47//B处理根际微生物在碳源利用种类和数量上的差异导致了抗病效果的差异。
在本研究中,不同品种小麦与蚕豆间作对蚕豆枯萎病产生不同抗性的原因: 一是YM42//B和YM47//B处理增加了根系分泌物中有机酸的含量,提高了微生物活性,促进了根际微生物对根际碳源的利用而抑制了根际病原菌对碳源的竞争,最终抑制了病原菌的增殖; 二是不同品种小麦与蚕豆间作改变了根际微生物群落结构,间作改变的根际微生物通过利用不同的碳源而影响对病原菌供应不同的营养,进而对枯萎病抗性产生不同的影响; 三是不同品种小麦与蚕豆间作还对能促进土传病原菌增殖的可溶性总糖和游离氨基酸的分泌产生不同的抑制效果,最终减少了对根际病原菌供应氨基酸和可溶性糖,减轻了蚕豆枯萎病的危害。
不同品种小麦与蚕豆间作通过影响根系分泌物而对根际微生物产生不同的调控,根际微生物的改变又影响了其对根际碳源的利用而影响病原菌的生长。表明间作系统根系分泌物-根际微生物的互作对土传病害控制具有重要的影响。不同品种小麦与蚕豆间作对糖、 氨基酸和有机酸不同组分的影响及不同组分对蚕豆枯萎病菌的作用还需要进一步分析。
参考文献:
[1] Brussaard L, de Ruiter P C, Brown G G. Soil biodiversity for agricultural sustainability[J]. Agriculture, Ecosystems and Environment, 2007, 121: 233-244.
[2] Qu X H, Wang J G. Effect of amendments with different phenolic acids on soil microbial biomass, activity, and community diversity[J]. Applied Soil Ecology, 2008, 39: 172-179.
[3] 覃逸明, 聂刘旺, 黄雨清, 等. 凤丹(PaeoniaostiiT.) 自毒物质的检测及其作用机制[J]. 生态学报, 2009, 9(3): 1153-1161.
Qin Y M, Nie L W, Huang Y Qetal. Detection ofPaeoniaostiiautotoxins and their mechanism[J]. Acta Ecologica Sinica, 2009, 9 (3): 1153-1161.
[4] Louwsa F J, Rivard C L, Kubota C. Grafting fruiting vegetables to manage soilborne pathogens, foliar pathogens, arthropods and weeds[J]. Scientia Horticulturae, 2010, 127: 127-146.
[5] Nie L, Peng S, Bouman B A Metal. Alleviating soil sickness caused by aerobic monocropping: Responses of aerobic rice to nutrient supply[J]. Field Crops Research, 2008, 107: 129-136.
[6] Hamel C, Vujanovic V, Jeannotte Retal. Negative feedback on a perennial crop: Fusarium crown and root rot of asparagus is related to changes in soil microbial community structure[J]. Plant and Soil, 2005, 268: 75-87.
[7] Zhu Y Y, Chen H R, Fan J Hetal. Genetic diversity and disease control in rice[J]. Nature, 2000, 406: 718-722.
[8] Ren L X, Shi M S, Xing M Yetal. Intercropping with aerobic rice suppressed fusarium wilt in watermelon[J]. Soil Biology and Biochemistry, 2008, 40: 834-844.
[9] 俞大绂. 蚕豆病害[M]. 北京: 科学出版社, 1979.
Yu D B. Faba bean diseases[M]. Beijing: Science Press, 1979.
[10] 董艳, 汤利, 郑毅, 魏兰芳. 施氮对间作蚕豆根际微生物区系和枯萎病发生的影响[J]. 生态学报, 2010, 30(7): 1797-1805.
Dong Y, Tang L, Zheng Y, Wei L F. Effects of N application on rhizosphere microflora and fusarium wilt occurrence of intercropped faba bean[J]. Acta Ecologica Sinica, 2010, 30(7): 1797-1805.
[11] 董艳, 汤利, 郑毅, 等. 小麦-蚕豆间作条件下氮肥施用量对根际微生物区系的影响[J]. 应用生态学报, 2008, 19(7): 1559-1566.
Dong Y, Tang L, Zheng Yetal. Effects of nitrogen application rate on rhizosphere microbial community in wheat-faba bean intercropping system[J]. Chinese Journal of Applied Ecology, 2008, 19(7): 1559-1566.
[12] 董艳, 杨智仙, 董坤, 等. 施氮水平对蚕豆枯萎病和根际微生物代谢功能多样性的影响[J]. 应用生态学报, 2013, 24(4): 1101-1108.
Dong Y, Yang Z X, Dong Ketal. Effects of nitrogen application rate on faba bean fusarium wilt and rhizospheric microbial metabolic functional diversity[J]. Chinese Journal of Applied Ecology, 2013, 24(4): 1101-1108.
[13] 乔鹏, 汤利, 郑毅, 李少明. 不同抗性小麦品种与蚕豆间作条件下的养分吸收与白粉病发生特征[J]. 植物营养与肥料学报,2010, 16(5): 1086-1093.
Qiao P, Tang L, Zheng Y, Li S M. Characteristics of nutrient uptakes and powdery mildew incidence of different resistant wheat cultivars intercropping with faba bean[J]. Plant Nutrition and Fertilizer Science, 2010, 16(5): 1086-1093.
[14] 王宇蕴, 郑毅, 汤利. 不同抗性小麦品种与蚕豆间作对小麦根际速效养分含量的影响[J]. 土壤通报, 2012, 43(2): 466-471.
Wang Y Y, Zheng Y, Tang L. Effects of intercropping with different resistant wheat varieties and faba beans on available nutrient content in the rhizosphere[J]. Chinese Journal of Soil Science, 2012, 43(2): 466-471.
[15] Irikiin Y, Nishiyama M, Otsuka S, Senoo K. Rhizobacterial community-level, sole carbon source utilization pattern affects the delay in the bacterial wilt of tomato grown in rhizobacterial community model system[J]. Applied Soil Ecology, 2006, 34: 27-32.
[16] 王志军. 氮磷供应对羽扇豆排根形成与有机酸分泌的影响[D]. 北京: 中国农业大学博士论文, 2006.
Wang Z J. Effects of nitrogen and phosphorus supply on cluster root formation and carboxylate exudation of differentLupinusspecies[D]. Beijing: PhD dissertation of China Agricultural University, 2006.
[17] 李合生. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2000.
Li H S. Experimental principle and technology for plant physiology and biochemistry[M]. Beijing: High Education Press, 2000.
[18] Li L, Sun J H, Zhou L Letal. Diversity enhances agricultural productivity via rhizosphere phosphorus facilitation on phosphorus-deficient soils[J]. PNAS, 2007, 104: 11192-11196.
[19] 吴凤芝,周新刚.不同作物间作对黄瓜病害及土壤微生物群落多样性的影响[J].土壤学报,2009, 46(5): 899-906.
Wu F Z, Zhou X G. Effect of intercropping of cucumber with different crops on cucumber diseases and soil microbial community diversity[J]. Acta Pedologica Sinica, 2009, 46(5): 899-906.
[20] Janvier C, Villeneuve F, Alabouvette Cetal. Soil health through soil disease suppression: which strategy from descriptors to indicators?[J]. Soil Biology & Biochemistry, 2007, 39: 1-23.
[21] Dai C C, Xie H, Wang X Xetal. Intercropping peanut with traditional Chinese medicinal plants improves soil microcosm environment and peanut production in subtropical China[J]. African Journal of Biotechnology, 2009, 8 (16): 3739-3746.
[22] Dennis P G, Miller A J, Hirsch P R. Are root exudates more important than other sources of rhizodeposits in structuring rhizosphere bacterial communities?[J]. FEMS Microbiology Ecology, 2010, 72: 313-327.
[23] Kravchenko L V, Shapozhnikov A I, Makarova N Metal. Exometabolites of bread wheat and tomato affecting the plant-microbe interactions in the rhizosphere[J]. Russian Journal of Plant Physiology, 2011, 58(5): 936-940.
[24] Broeckling C D, Broz A K, Bergelson Jetal. Root exudates regulate soil fungal community composition and diversity[J]. Applied and Environment Microbiology, 2008: 738-744.
[25] Hao W Y, Ren L X, Ran W, Shen Q R. Allelopathic effects of root exudates from watermelon and rice plants onFusariumoxysporumf. sp.niveum[J]. Plant and Soil, 2010, 336: 485-497.
[26] 郝文雅, 沈其荣, 冉炜, 等. 西瓜和水稻根系分泌物中糖和氨基酸对西瓜枯萎病病原菌生长的影响[J]. 南京农业大学学报, 2011, 34(3): 77-82.
Hao W Y, Shen Q R, Ran Wetal. The effects of sugars and amino acids in watermelon and rice root exudates on the growth ofFusariumoxysporumf. sp.Niveum[J]. Journal of Nanjing Agricultural University, 2011, 34(3): 77-82.
[27] 王戈, 杨焕文, 赵正雄, 等. 不同抗性烤烟品种根际微生物数量及多样性差异研究[J]. 植物营养与肥料学报, 2012, 18(2): 451-458.
Wang G, Yang H W, Zhao Z Xetal. Microbe quantity and functional diversity in rhizospheres of different cultivars of flue-cured tobacco[J]. Plant Nutrition and Fertilizer Science, 2012, 18 (2): 451-458.
[28] Borrero C, Ordova′s J, Trillasb M I, Avile′ s M. Tomato Fusarium wilt suppressiveness. The relationship between the organic plant growth media and their microbial communities as characterised by Biolog[J].Soil Biology & Biochemistry, 2006, 38: 1631-1637.
[29] 李鑫, 张会慧, 岳冰冰, 等. 桑树-大豆间作对盐碱土碳代谢微生物多样性的影响[J]. 应用生态学报, 2012, 23(7): 1825-1831.
Li X, Zhang H H, Yue B Betal. Effects of mulberry-soybean intercropping on carbon-metabolic microbial diversity in saline-alkaline soil[J]. Chinese Journal of Applied Ecology, 2012, 23(7): 1825-1831.

