镍变应性接触性皮炎豚鼠动物模型的构建
赵显莉,刁 颖,贺银丽,徐艳峰,郭 珣,李 挚,孙劲旅,高 虹
(中国医学科学院医学实验动物研究所,北京协和医学院比较医学中心,北京 100021)
金属是一组常见的接触性变应原,可导致变应性接触性皮炎(allergic contact dermatitis,ACD)和移植物失败。镍是最容易导致ACD的金属物质[1],并广泛存在于日常生活环境中[2-4]。ACD患者接触部位皮肤可出现边缘鲜明的损害,轻者可表现为红斑和丘疹,较重者可能出现水疱和渗液,慢性者还可出现苔藓样变、皲裂、脱屑[5]等皮肤病变。ACD确切的发病机制至今尚不清楚。动物模型是研究疾病发病机制、评价治疗药物有效性必不可少的实验工具,建立与临床发病过程及病理表现相一致的动物模型能促进其相关机制研究。本研究利用不同浓度硫酸镍(NiSO4)为变应原,建立2种方案的豚鼠ACD模型,并考察不同接触时间和接触皮肤微环境对模型建立的影响。
材料和方法
试剂和仪器
六水合硫酸镍(分析纯,西陇化工股份有限公司,批号:1209191);2,4-二硝基氯苯(分析纯,批号:970318);丙酮(分析纯,北京化工厂,批号:20100128);葡萄糖,氯化钠,氯化铵,尿素,醋酸,乳酸,氢氧化钠等。豚鼠白介素(interleukin,IL)-2、干扰素(interferon,IFN)-γ酶联免疫吸附试剂盒(CUSABIO,96T)。酶标仪(Thermo Scientific,Multiskan Mk3);高速低速离心机(BECKMAN COULTER,ALLEGRA-64R)。
实验动物
SPF级Hartley豚鼠86只,雌雄各半,体重240~270 g,购自中国食品药品检定研究院(实验动物许可证号:SCXK(京)2009-0017)。豚鼠饲养于SPF级环境中,动物设施许可证号SYXK(京)2008-0012。
动物分组及致敏方法
根据预实验结果将豚鼠分为14组,组别命名格式:NiSO4浓度-激发时间-SP干扰-封闭接触时间。第0天、第7天、第14天致敏且第28天激发的8组,即20%Ni-28d-6h、10%Ni-28d-6h、20%Ni-28d-SP-6h、10%Ni-28d-SP-6h、20%Ni-28d-24h、10%Ni-28d-24h、20%Ni-28d-SP-24h、10%Ni-28d-SP-24h,每组5只;第0天、第1天、第2天连续3天致敏且第9天激发的6组,即20%Ni-9d-6h、20%Ni-9d-24h、20%Ni-9d-SP-6h、20%Ni-9d-SP-24h、阳性对照组(positive control,PC)、阴性对照组(negative control,NC),前4组每组9只,2个对照组每组5只。在实验第0天,豚鼠左侧腹部固定部位(3 cm×3 cm)剃毛后(注意勿损伤表皮),清水充分擦洗;实验第0天、第7天和第14天(或第0天、第1天和第2天)按照不同变应原和封闭接触时间(6 h或24 h)连续3次致敏;实验第28天(或第9天)于同一固定部位以5% NiSO4单次激发。同时设2,4-二硝基氯苯(2,4-dinitrochlorobenzene,DNCB)为PC,生理盐水(normal saline,NS)为NC,并按实验组第9天激发的方法致敏。人工汗液(synthetic perspiration, SP)根据文献[6]配制,氯化钠0.1 g/10 ml,氯化铵0.05 g/10 ml,尿素0.05 g/10 ml,醋酸0.025 g/10 ml,乳酸0.05 g/10 ml,再加入氢氧化钠调节pH=5.5。
皮肤动态分级
分别于激发后6、12、24、48和72 h观察豚鼠激发部位皮肤反应,并根据激发部位红斑和(或)水肿严重程度分为5级[7]:无可见红斑和(或)水肿为0级,轻度散在红斑和(或)勉强可见水肿为1级,中度红斑和(或)边缘清晰中度水肿为2级,重度红斑和(或)皮肤隆起约1 mm的水肿为3级,紫红色红斑到轻度焦痂形成和(或)皮肤隆起超过1 mm的重度水肿为4级。
皮损组织IL-2,IFN-γ测定
分别采集第9天激发的6组(20%Ni-9d-6h、20%Ni-9d-SP-6h、20%Ni-9d-24h、20%Ni-9d-SP-24h、PC、NC)豚鼠激发后24、48、72 h皮损部位的皮肤组织,用PBS溶液洗去血污,滤纸拭干,剔除附属的结缔组织,称取500 mg组织块,剪成小块后放入匀浆管中,加入5 ml PBS溶液中制成匀浆。组织处理过程均在冰上进行。匀浆置于-20℃过夜,经多次反复冻融处理后,将组织匀浆于4℃ 9 000 r/min离心10 min取上清备用。采用酶联免疫吸附试剂盒说明书要求测定,并使用专业软件Curve Expert1.3制作标准曲线,按标准曲线换算样品中待测细胞因子浓度。
组织病理检测
豚鼠激发后72 h,剪取激发部位皮肤,10%中性福尔马林固定,进行组织修块及再固定,制作石蜡切片,HE染色,于光学显微镜下观察皮肤的形态学变化。
统计学处理
结 果
激发部位皮肤反应
5%NiSO4激发后,各组豚鼠激发部位皮肤均出现不同程度红斑水肿,红斑反应在20%Ni-28d-SP-24h、20%Ni-9d-SP-6h、20%Ni-9d-SP-24h、20%Ni-9d-24h等组中最为明显(表1、图1),与PC相比,各组豚鼠皮肤水肿均不明显。
第0天、第7天、第14天激发的各组中(表1、图2、3),激发后48 h豚鼠皮肤平均红斑反应分值最大,其后逐渐下降;封闭接触时间为24 h的豚鼠皮肤红斑平均分值大于封闭接触时间为6 h的红斑平均值。第0天、第1天、第2天激发的各组(图4、5),皮肤红斑反应则在激发后24 h最大;与第0天、第7天、第14天激发的各组相比,第0、第1天、第2天激发的各组皮肤红斑程度更严重。
在致敏过程中,随着NiSO4浓度增加及封闭接触时间延长,其红斑程度增强;NiSO4浓度和封闭接触时间相同时,加入SP可使红斑程度明显增强,20%Ni-28d-SP-24h组红斑比20%Ni-28d-24h组明显,且组中多个豚鼠激发部位皮肤出现瘙痒抓痕。
激发后72 h皮肤病理变化
5%NiSO4激发后72 h,各组豚鼠激发部位皮肤表面出现不同程度的结痂,表皮增厚,角化过度伴角化不全,真皮毛细血管扩张充血,真皮及表皮内炎症细胞浸润(图6)。其中第0天、第1天、第2天连续3 d致敏且第9天激发的各组,炎性细胞浸润明显多于第0天、第7天、第14天致敏且第28天激发的各组,能得到较为严重的镍ACD模型;20%Ni-9d-SP-24h出现真皮乳头水肿,20%Ni-9d-24h皮突延长明显,炎性细胞浸润严重。
皮损组织IL-2和IFN-γ变化
豚鼠激发后72 h内,皮损部位皮肤组织IL-2、IFN-γ的水平随着变态反应的进程而变化。在每个时间点上,4个NiSO4组中细胞因子的差异均无统计学意义(P>0.05);而从整体上看,在24、48、72 h这3个时间点间,IL-2、IFN-γ差异有统计学意义(P<0.05);激发后48 h IL-2水平达到峰值(533.53±41.51) pgml并持续到72 h;激发后48 h IFN-γ达到峰值(1 235.63±76.85) pgml并能持续到72 h(表2)。
表1 硫酸镍激发后豚鼠激发部位皮肤反应(红斑水肿)Table 1 The grouping of laboratory guinea-pigs and skin reactions (erythemaswelling) of each group after challenge
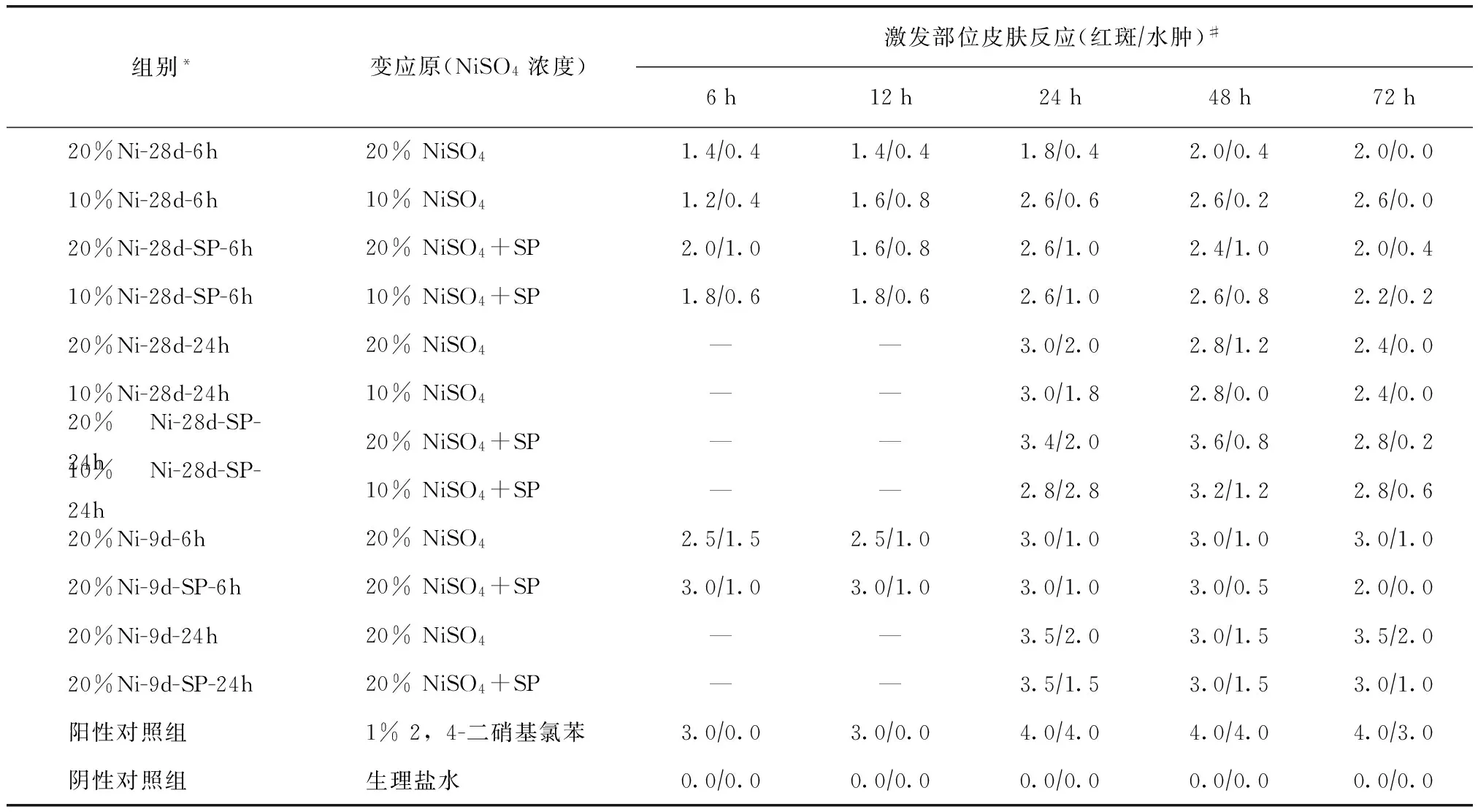
表1 硫酸镍激发后豚鼠激发部位皮肤反应(红斑水肿)Table 1 The grouping of laboratory guinea-pigs and skin reactions (erythemaswelling) of each group after challenge
组别*变应原(NiSO4浓度)激发部位皮肤反应(红斑∕水肿)#6h12h24h48h72h20%Ni-28d-6h20%NiSO41.4∕0.41.4∕0.41.8∕0.42.0∕0.42.0∕0.010%Ni-28d-6h10%NiSO41.2∕0.41.6∕0.82.6∕0.62.6∕0.22.6∕0.020%Ni-28d-SP-6h20%NiSO4+SP2.0∕1.01.6∕0.82.6∕1.02.4∕1.02.0∕0.410%Ni-28d-SP-6h10%NiSO4+SP1.8∕0.61.8∕0.62.6∕1.02.6∕0.82.2∕0.220%Ni-28d-24h20%NiSO4——3.0∕2.02.8∕1.22.4∕0.010%Ni-28d-24h10%NiSO4——3.0∕1.82.8∕0.02.4∕0.020%Ni-28d-SP-24h20%NiSO4+SP——3.4∕2.03.6∕0.82.8∕0.210%Ni-28d-SP-24h10%NiSO4+SP——2.8∕2.83.2∕1.22.8∕0.620%Ni-9d-6h20%NiSO42.5∕1.52.5∕1.03.0∕1.03.0∕1.03.0∕1.020%Ni-9d-SP-6h20%NiSO4+SP3.0∕1.03.0∕1.03.0∕1.03.0∕0.52.0∕0.020%Ni-9d-24h20%NiSO4——3.5∕2.03.0∕1.53.5∕2.020%Ni-9d-SP-24h20%NiSO4+SP——3.5∕1.53.0∕1.53.0∕1.0阳性对照组1%2,4-二硝基氯苯3.0∕0.03.0∕0.04.0∕4.04.0∕4.04.0∕3.0阴性对照组生理盐水0.0∕0.00.0∕0.00.0∕0.00.0∕0.00.0∕0.0
NiSO4:硫酸镍;SP:人工汗液;—:封闭时间24 h评分值不可读;*组别命名格式:NiSO4浓度-激发时间-SP干扰-封闭接触时间;#动态反应评分标准所得豚鼠红斑/水肿平均值

表2 5%硫酸镍第9天激发后24、48、72 h豚鼠皮损组织中白介素-2和干扰素-γ水平Table 2 The level of interleukin-2 and interferon-γ in the skin of guinea-pigs after challenge with 5%
与48、72 h比较,*P<0.05
讨 论
镍ACD是临床皮肤科常见病,是由含镍的金属合金或电镀物品引起的变应性皮肤疾病。有关镍ACD发病机制存在多种说法[8-10],目前公认观点是镍过敏是一种T淋巴细胞参与的Ⅳ型迟发型变态反应,可分为诱导致敏和激发发病2个阶段。与ACD表现类似,镍ACD患者也会在接触部位发生边缘鲜明损害,轻者为红斑、丘疹,较重者有水疱、渗液,慢性者还有苔藓样变、皲裂、脱屑等临床表现[11]。为了进一步研究镍ACD的发病机制,建立与临床ACD发病过程一致的动物模型是研究基础,也是临床前药物评价的必备工具。豚鼠迟发型超敏反应与人最为相似,是最普遍使用的检测化学物变应性动物模型[12]。本研究采用与人类接触变应原相同的途径进行涂抹致敏和激发,建立豚鼠镍ACD动物模型。
在临床上,合金饰品、手机外壳等含镍物品一般需在汗液等体液的参与下,缓慢释放形成二价的镍离子才能引发镍ACD,且只有在镍敏感个体皮肤长期接触的情况下才可能发生[6]。进入接触部位皮肤的镍离子浓度也是激发镍ACD必不可少的重要因素[13]。国内也有文献报道镍皮炎患者多发于湿热的环境中[14],更证明了镍ACD易在湿热环境中因长期接触含镍物品,且在体液或汗液作用下激活金属离子而导致缓慢发病。本研究在组别设置时增加了不同浓度的SP组,模拟人类致敏的发病条件,结果显示,皮肤出现边缘鲜明的红斑反应,同时伴有皲裂、脱屑等临床表现。20%Ni-9d-SP-6h、20%Ni-9d-SP-24h等SP组的红斑反应比不加SP组(20%Ni-9d-6h、20%Ni-9d-24h)明显增强。同时,激发后24和48h皮肤红斑反应达到高峰,随后逐渐减弱,这与皮损组织中细胞因子变化一致。此研究结果提示,在研究药物对镍ACD的干预作用时,终止实验的时间点应选择在激发后72h之前,以避免观察时间过长,致使在实验终止前炎症已恢复正常,影响实验结果的准确性。
Artik等[15]研究显示,在镍ACD致敏过程中,机体在感染时产生的活性氧离子(reactive oxygen species,ROS)能将二价的镍离子(Ni2+)氧化为高价态的三价(Ni3+)和四价(Ni4+)的镍离子,而在已损伤的皮肤中更易引起镍ACD。这一结果说明镍的化学价态和微环境可制约镍ACD的发病机制。本研究结果显示,在第0天、第1天、第2天连续3天致敏的各组中,由于致敏阶段封闭接触部位皮肤皮损较严重,应激产生ROS[15],其变态反应强于第0天、第7天、第14天连续3次致敏的各组。在实验过程中,封闭接触时间对模型的建立至关重要。相同的条件下,若由于固定不好或豚鼠自身撕咬等原因造成封闭接触时间不足,会严重影响模型的皮炎反应程度。
镍ACD患者皮损组织病理表现主要为炎细胞浸润,表皮角化不全、棘层肥厚、皮突延长,真皮乳头血管轻度扩张及其周围组织水肿等;在国内外研究报告中,通过腹腔注射致敏皮下注射激发的各种小鼠和豚鼠镍ACD模型,主要表现为真皮浅层水肿及炎细胞浸润,不能很好地模拟临床镍ACD皮损现象中的红斑、皲裂、脱皮、表皮角化不全、棘层肥厚、皮突延长等的真实发病过程[16-17]。本研究20%Ni-9d-24h组皮炎的各项表现,能较好地模拟临床镍ACD皮损组织的病理组织形态学特点[18],提供了与临床镍皮炎患者病理表现极为相似的动物模型。
镍ACD是由变应原特异性T细胞介导的皮肤迟发型超敏反应,并且主要为辅助性T细胞1,通过释放IL-2,IFN-γ,肿瘤坏死因子-β等细胞因子,产生以单核细胞及淋巴细胞浸润为主的免疫损伤效应,少量浸润的CD8+细胞主要通过释放穿孔素和颗粒酶或者诱导凋亡途径参与组织损伤。IL-2,IFN-γ等细胞因子在镍ACD皮肤反应中的重要性在动物实验中得到了证实[19],是镍ACD发生的重要指标。在本研究中,IL-2和IFN-γ在激发后48h明显增高,以确定镍ACD的免疫反应。
本文根据OECD经典的致敏过程并稍加修改制定建模方案[20],通过改变致敏条件,可建立不同严重程度的豚鼠镍ACD模型,为研究镍ACD提供最能模拟临床致病过程的动物模型。本研究中豚鼠皮肤变态反应无水疱样改变。人类皮肤由多层上皮细胞组成,结构强健致密;而啮齿类动物表皮只有数层角质细胞覆盖,表皮与真皮连接面平坦,真皮结构相对松散,血管系统不发达,无法形成细胞间水肿导致的湿疹和皮肤水疱样改变[12]。
(本文图1、3见插页Ⅰ,图2、4~6见插页Ⅱ)
[1]Basketter DA, Briatico-Vangosa G, Kaestner W, et al. Nickel, cobalt and chromium in consumer products: a role in allergic contact dermatitis?[J].Contact Dermatitis, 1993, 28:15-25.
[2]Luo J, Bercovitch L. Cell phone contact dermatitis with nickel allergy[J].CMAJ, 2008, 178:23-24.
[3]Mehta V, Vasanth V, Balachandran C. Nickel contact dermatitis from hypodermic needles[J].Indian J Dermatol, 2011, 56:237-238.
[4]Ozkaya E, Kavlak Bozkurt P. Allergic contact dermatitis caused by self-adhesive electrocardiography electrodes: a rare case with concomitant roles of nickel and acrylates[J].Contact Dermatitis, 2014, 20:121-130.
[5]Usatine RP, Riojas M. Diagnosis and management of contact dermatitis[J].Am Fam Physician. 2010, 82:249-255.
[6]FLINT GN. A metallurgical approach to metal contact dermatitis[J].Contact Dermatitis, 1998, 39:213-221.
[7]Magnusson B, Kligman AM. The identification of contact allergens by animal assay: The guinea pig maximization test[J].J Invest Dermatol, 1969, 52(3):268-276.
[8]Roediger B, Weninger W. How nickel turns on innate immune cells[J].Immunol Cell Biol, 2011, 89:1-2.
[9]Novak N,Baurecht H, Schäfer T, et al. Loss-of-Function mutations in the filaggrin gene and allergic contact sensitization to nickel[J].J Invest Dermatol, 2008, 128:1430-1435.
[10] Cavani A. Breaking tolerance to nickel[J].Toxicology, 2005, 209:119-121.
[11] Thyssen JP, Linneberg A, Menné T, et al. The epidemiology of contact allergy in the general population-prevalence and main findings[J].Contact Dermatitis, 2007, 57:287-299.
[12] 董海燕,郑玉新,戴宇飞,等. 化学物致迟发型变态反应性皮炎动物模型研究进展[J].卫生研究,2011,40:263-266.
[13] Menné T, Calvin G. Concentration thresholds of non-occluded nickel exposure in nickel sensitive individuals and controls with and without surfactants[J].Contact Dermatitis, 1993, 29:180-184.
[14] 陆东庆,王晓鸿,高兴华,等. 镍接触性皮炎的斑贴试验及其组织病理学特征[J].中国工业医学杂志, 2005, 18:11-13.
[15] Artik S, von Vultéé C, Gleichmann E, et al. Nickel allergy in mice: enhanced sensitization capacity of nickel at higher oxidation states[J].J Immunol, 1999, 163:1143-1152.
[16] Watanabe M, Ishimaru N, Ashrin MN, et al. A novel DC therapy with manipulation of MKK6 gene on nickel allergy in mice[J].PLoS ONE, 2011, 6:e19017.
[17] Karsak M, Gaffal E, Date R, et al. Attenuation of allergic contact dermatitis through the endocannabinoid system[J].Science, 2007, 316:1494-1497.
[18] Artur Zembowicz MD, Sean Klepper MD. Allergic contact dermatitis[EBOL].[2014-02-22].http:www.dermpedia.orgdermpedia-textbookallergic-contact- dermatitis.
[19] Sosroseno W. The immunology of nickel-induced allergic contact dermatitis[J].Asian Pac J Allergy Immunol, 1955, 13:173-181.
[20] Organization for Economic Cooperation and Development. Guide lines for Testing of Chemicals. Skin Sensitisation[M].Paris:OECD,1992:406.

