妊娠相关蛋白A联合子宫动脉PI检测对早发型子痫前期的预测价值
史丽 赵喜娃 赵艳玲 王彦莉 李青梅 尹洁
早发型子痫前期(early onset preeclampsia)是指妊娠34周之前发病的子痫前期,临床工作中发现,子痫前期发病越早,病情演变愈快、愈重,围产儿预后愈差,治疗过程存在尖锐的母婴利益冲突。尽管如此,早发型子痫前期的预测目前尚无有效、可靠、经济的方法。近年来国内外学者发现,妊娠相关蛋白A(pregnancyassociate plasma protein A,PAPP-A)水平与子痫前期发生发展有关[1,2],但尚无孕期 PAPP-A 动态变化的报道。本研究通过监测孕早、中、晚期PAPP-A水平变化,评估其与早发型子痫前期发病的关系及对该病的诊断价值。有研究认为把PAPP-A水平分组切点定为13.00 U/L对早发型子痫前期预测价值较高[1],故本研究前瞻性实验部分将以孕早期PAPP-A≤13.00 U/L为分组切点进一步评价PAPP-A对早发型子痫前期的预测价值。既往研究表明,早发型子痫前期子宫动脉血流变化从孕早期即可表现出来,如出现子宫动脉舒张早期切记等,但对早发型子痫前期的价值还有待研究,目前广泛认为妊娠中期子宫动脉搏动指数(PI)>95 th%预测子痫前期敏感度较高[3]。本研究通过孕早期检测PAPP-A水平变化、孕中期检测子宫动脉PI,评估孕早期PAPP-A水平联合孕中期子宫动脉PI检测对早发型子痫前期发病的预测价值。
1 资料与方法
1.1 一般资料
1.1.1 回顾性研究部分:选择2011年12月至2012年10月在河北医科大学第四医院规律进行产前检查并随访至分娩的早发型子痫前期产妇96例,同期分娩的健康孕妇96例,早发型子痫前期诊断标准参照《妇产科学》第8版[3]。所有孕妇于孕12周、24周、≥28周行PAPP-A检测。入组患者均为初产且已排除目前已明确的早发型子痫前期其他高危因素,如:多胎妊娠、肾病、糖尿病、高血压既往史及家族史。早发型子痫前期孕妇平均年龄为(29.2±3.1)岁,健康孕妇平均年龄为(28.2±2.8)岁,2组年龄差异无统计学意义(t=1.57,P=0.14);初次产检时早发型子痫前期孕妇体重指数为(27.19±1.95)kg/m2,健康组体重指数(26.32 ±2.17)kg/m2,2 组体重指数无统计学意义(t=1.27,P=0.21)。入选孕妇均知情同意并且病历资料完整。
1.1.2 前瞻性研究部分:随机选择2012年11月至2013年7月在河北医科大学第四医院规律进行产前检查孕妇1 042例。入组条件同回顾性研究部分。追踪孕妇产科及围生结局,剔除其后发生妊娠期糖尿病、前置胎盘、合并子宫肌瘤等并发症的孕妇26例,失访21例,入选孕妇共995例。对所有孕妇于孕早期行PAPP-A检测并于孕中期进行子宫动脉 PI检测,将PAPP-A >13.0 U/L 且子宫动脉 PI<1.01(妊娠中期正常孕妇子宫动脉PI 95th%)的孕妇分为A组,PAPPA≤13.0 U/L而 PI<1.01的孕妇分为 B组,将 PI>1.01而 PAPP-A >13.0 U/L的孕妇分为 C 组,将PAPP-A≤13.0 U/L且 PI>1.01的孕妇分为 D 组,比较4组孕妇早发型子痫前期发病率。
1.2 方法
1.2.1 PAPP-A水平检测:对所选孕妇空腹取周围静脉血6 ml置于不抗凝的玻璃试管中,待其自然凝固30 min后,3 500 r/min离心10 min,分离血清后置于-80℃冰箱保存,待孕中晚期确诊为早发型子痫前期或健康孕妇后进行检测。应用PAPP-A ELISA试剂盒检测,操作均由同一人在同一实验室进行。
1.2.2 子宫动脉血流的检测:所选孕妇于孕中期取仰卧位或侧卧位,用彩色超声获取连续3个稳定的、形态一致的子宫动脉血流频谱。彩色超声机器为日本产型号为ALOKA-a-10机型。子宫动脉定位的标准:先于两侧肌层和盆壁之间找到骼内动脉,进而找到两侧子宫动脉主干,取样容积2 mm,声束与血流方向间角度<60°。记录孕妇左右两侧子宫动脉的PI检测数据并取均值。
1.3 统计学分析 应用SPSS 12.0统计软件,计量资料以±s表示,采用t检验,计数资料采用χ2检验及Fisher精确概率法,P<0.05为差异有统计学意义。
2 结果
2.1 健康组及早发型子痫前期组孕妇孕早期、中期、晚期PAPP-A水平变化及比较 孕早期,与健康组比较,早发型子痫组PAPP-A水平明显减低,差异有统计学意义;孕中、晚期,健康组与早发型子痫前期组PAPP-A水平均增高,2组中、晚期PAPP-A水平与孕早期之间差异有统计学意义(P<0.05),但中、晚期水平之间及组别之间差异无统计学意义(P>0.05)。见表1。
表1 孕期健康组及早发型子痫前期组PAPP-A水平比较n=96,U/L,±s
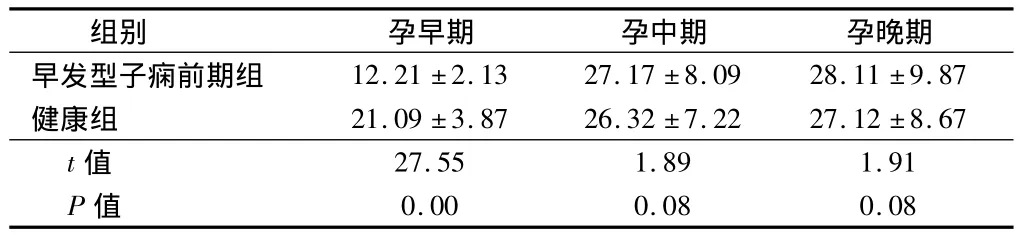
表1 孕期健康组及早发型子痫前期组PAPP-A水平比较n=96,U/L,±s
组别 孕早期 孕中期 孕晚期早发型子痫前期组12.21 ±2.13 27.17 ±8.09 28.11 ±9.87健康组 21.09 ±3.87 26.32 ±7.22 27.12 ±8.67 t值27.55 1.89 1.91 P值0.00 0.08 0.08
2.2 4组子痫发生率比较 入选孕妇共995例,发病共87例,早发型子痫前期发病率约为8.7%。B、C组发病率明显高于A组,但2组间差异无统计学意义(P>0.05)。D组发病率明显高于其他3组,差异有统计学意义(P<0.05)。见表2。

表2 4组早发型子痫前期发病率比较 例(%)
3 讨论
3.1 PAPP-A水平变化与早发型子痫前期发病的关系PAPP-A是一种在妊娠期间母体血浆中大分子糖蛋白的化合物,分子质量为500~800 kD,由胎盘合体滋养层和蜕膜产生。近年来,PAPP-A被认为与孕早期胎儿先天缺陷、胎儿生长受限、早产、异位妊娠、滋养叶细胞肿瘤、双胎妊娠等病理情况密切相关[4,5]。本实验重点研究其在早发型子痫前期疾病预测方面的价值。结果表明,孕早期,早发型子痫前期患者PAPP-A水平明显低于健康组、有统计学意义,这与 Spencer等[2]研究结果一致,可能作为孕早期筛查早发型子痫前期的指标。PAPP-A在妊娠期高血压疾病发病机制中的作用可能通过以下几个方面体现:(1)与ProMBP复合蛋白的特异性交叉反应。从嗜曙红颗粒中分离出的MBP在寄生虫和哺乳动物细胞中有细胞毒性作用。MBP在初分泌时为无毒性的ProMBP形式,PAPP-A与ProMBP结合可阻止其裂解为MBP,从而避免母体器官损害[6]。故孕早期低水平PAPP-A可能与早发型子痫前期发病及器官损害有关。(2)PAPP-A对IGFs系统的影响IGFs能促进滋养细胞增殖与分化,有研究表明低水平PAPP-A与高水平IGFBP相关从而导致IGFs减少,进而使孕早期滋养层侵入不良[7],胎盘的浅着床目前被认为是子痫前期发病机制之一。随着妊娠的进展,PAPP-A水平在早发型子痫前期组及正常妊娠组均逐渐升高,与胎盘合体细胞及蜕膜继续增长有关,但本研究表明,孕中晚期PAPP-A水平在早发型子痫前期组与健康组无明显差异。有研究认为把PAPP-A水平分组切点定为13.00 U/L对早发型子痫前期预测价值较高[1],故本研究前瞻性实验部分将以孕早期PAPP-A≤13.00 U/L为分组切点进一步评价该指标诊断早发型子痫前期的临床价值。
3.2 子宫动脉血流变化与子痫前期的发病关系 研究表明,早发型子痫前期患者滋养细胞对螺旋小动脉浸润能力明显下降,螺旋小动脉重铸的数量减少,且重铸的深度主要限于蜕膜段,从而子宫动脉血流阻力增加、胎盘灌注减少,进而导致持续的子宫及胎盘血流高抵抗,因此早发型子痫前期子宫动脉彩超频谱可能会显示为舒张期血流速度明显减小,呈高阻力、低舒张期血流改变的特征,从而使超声测得RI、PI及S/D升高,这些病理波形应与螺旋小动脉血管重铸高峰时间一致,即可能发生于孕中期并于临床症状出现前出现并达到最高值[8]。虽有部分研究表明,子痫前期患者于孕早期即显示双侧子宫动脉平均RI、PI增高及子宫动脉舒张早期a切迹等血流动力学改变[9],但本研究预实验结果未发现早发型子痫前期与健康组孕妇在孕早期子宫动脉血流有显著差别,这与国内部分学者研究结果相一致[10]。目前广泛认为妊娠中期子宫动脉PI﹥正常妊娠孕妇95 th%预测子痫前期敏感度较高,本研究预实验测量了200例正常妊娠孕中期子宫动脉PI值,参考范围为 0.97 ±0.09,与文献报道[10]相近,PI 95 th%为1.01,本研究将分组切点定为 PI>1.01,观察不同组别早发型子痫前期的发病率,评估孕中期子宫动脉PI的检测对早发型子痫前期的预测价值。
3.3 孕早期PAPP-A水平检测联合孕中期子宫动脉PI检测对早发型子痫前期发病的预测价值 国外文献报道子痫前期的发病率为4% ~8%[11],本研究结果显示,早发型子痫前期自然发病率约为8.7%,可能与单中心研究有关。结果显示:B、C组发病率明显高于A组发病率,表明单一PAPP-A水平与单一子宫动脉PI检测对早发型子痫前期的预测均有一定价值,但B、C组发病率比较无明显差异,说明两者的的预测价值相当。而同时满足孕早期PAPP-A≤14.34 U/L及孕中期子宫动脉PI>1.01的D组患者早发型子痫前期发病率为64.77%,明显高于其他3组发病率,可见孕早期PAPP-A检测联合孕中期子宫动脉PI检测对早发型子痫前期的发病有较高预测价值,给临床子痫前期早期干预提供了理论依据。
1 陈宏霞,曹伍兰.妊娠期高血压疾病妊娠相关蛋白A与胎盘病理改变的关系.中国实用妇科与产科,2011,27:63-65.
2 Spencer K,Yu CK,Commans NJ,et al.Prediction of pregnancy complication by first-trimester maternal serum PAPP-A and free beta-hCG and with second-trimester uterine artery Dopper.Prenat Diagn,2005,25:949-953.
3 谢幸,苟文丽主编.妇产科学.第8版.北京:人民卫生出版社,2013.64-71.
4 Smith GC,Stenhouse EJ,Crossley JA,et al.Early pregnancy levels of pregnancy-associated plasma protein A and the risk of intrauterine growth restriction,premature birth,preeelampsia,and stillbirth.Clin Endocrinol Metab,2002,87:1762-1767.
5 Dugoff L,Hobbins JC,Malone FD,et al.Firat trimester maternalism PAPP-A and freebeta subunit human chorionicgonadotropin concentratioes and nuchaltranslucency are associated with obstetriccomplications:Apopulation-basedscreening study(The FASTER%a1).AmJ Obstetr Gynecol,2004,191:1446-1451.
6 Oxvig C,Haaning J,Kristensen L,et al.Identisfication of angiotensinogen and complement C3dg as novel proteins binding the proform of eosinophil major basic protein in human pregnancy surun and plasma.J Biol Chem,1995,270:13645-13651.
7 Jennie L,Tina S,Sophie P,et al.Reduction of the disintegrin and metallophotease ADAM12 in preeelampsia.Obstet Gynecol,2005,106:144-149.
8 林建华,梁阿娟,林其德,等.正常妊娠和妊娠期高血压疾病孕妇子宫动脉及其胎儿脐动脉血流动态变化规律的多中心研究.中华妇产科杂志,2010,45:583-587.
9 谢亦农,江岚,张华.妊娠11-14周子痫前期彩色多普勒超声的表现特征.广东医学,2012,33:3406-3408.
10 段宝山,荆淑云,郝耀斌,等.妊娠期高血压疾病子宫动脉、脐动脉血流对胎儿生长发育的影响.中西医结合心脑血管病杂志,2010,8:1516-1518.
11 Villar J,Abdel Aleem H,Merialdi M,et al.World Health Organization randomized trial of calcium supplementation among low calcium intake pregnant women.Am J Obstet Gynecol,2006,94:639-649.

