辅酶Q10通过抑制机体炎性反应缓解直肠癌患者术后疲劳综合征
宋宁 郭艳 梁志兵
直肠癌是我国常见的消化道恶性肿瘤,发病年龄中位数在45岁左右。近年来发病率逐年增加,尤其是青年人发病率有升高的趋势。有报道直肠癌的发病率位列第三位,并将继续上升[1]。目前手术是治疗直肠癌的最重要的手段。但由于直肠癌手术创伤较大,患者易发生术后疲劳综合征(postoperative fatigue syndrome,POFS)。POFS多见于大手术后围手术期,通常表现为疲乏、嗜睡、无力、行为及思维缺乏主动性、注意力不集中等[2,3]。POFS的出现使得患者手术后的生活质量下降、住院时间延长,是术后常见并发症。直肠癌患者POFS的发生率很高,但如何缓解POFS目前尚无定论。有研究发现辅酶Q10具有促进细胞能量释放、抗氧化及改善机体应激状态的作用[4,5],但辅酶Q10对直肠癌POFS的效果及对炎症反应的作用报道少见。故本研究选取于我科进行手术治疗的直肠癌患者应用辅酶Q10进行治疗,观察了该药对POFS患者的炎性反应的作用。
1 资料与方法
1.1 一般资料 2008年1月至2013年12月在我科行直肠癌手术的患者215例为研究对象,男107例,女108例;年龄25~71岁,平均年龄(49.2±9.6)岁。所有入选病例术前均有临床、病理活检及影像学检查。排除有严重的心脑血管疾病、重度肝硬化、肾功能不全、急性炎症期患者,术前均未行放化疗。病例随机分为治疗组115例,对照组100例。患者均签署知情同意书。
1.2 治疗方法 治疗组于患者麻醉后及术后1~3 d给予辅酶Q10(北京双鹤药业)10 mg溶于0.9%氯化钠注射液250 ml中静脉滴注,对照组给予0.9%氯化钠注射液250 ml静脉滴注。2组患者术后均给予止血、抗感染、肠内肠外营养支持治疗,2组方案相同。
1.3 临床观察指标
1.3.1 应用视觉模拟疲劳尺(VAS)观察 POFS情况[6]:由经过同一组研究人员在术前1d、术后第1、3、5、9天对患者的疲劳程度做出评估并计分。
1.3.2 体质指数(body mass index,BMI)的检测:于术前1 d、术后第3、9天检测患者的BMI水平。计算公式:BMI= 体重(kg)/身高(m)2。
1.3.3 疼痛水平的检测[7]:将疼痛程度按轻重分为0~10,由同一组研究人员在术前1 d、术后1、3、5、9 d对患者的疼痛程度进行评估。
1.4 血清转铁蛋白(transferrin,TRF)测定 所有患者在术前1 d、术后1、5、9 d 晨起空腹抽取静脉血4 ml,以日立7600全自动生化分析仪检测血清中TRF水平。
1.5 血清炎性因子水平测定 所有患者在术前1d、术后1、3、5、9 d 抽取空腹静脉血 4 ml,酶联免疫吸附法(ELISA)检测白介素-2(interleukin-2,IL-2)、IL-6、IL-8、IL-10、IL-17、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)的水平。ELISA试剂盒为美国 RB公司产品。全自动特定蛋白分析仪BNⅡ检测同时点血清C反应蛋白(C reactive protein,CRP)水平。
1.6 统计学分析 应用SPSS 19.0统计软件,计量资料以±s表示,采用t检验,计数资料以率或百分比表示,采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 2组临床检测指标的比较 对照组和治疗组术前反映疲劳程度的VAS评分无明显差异(P>0.05);2组术后第4次 VAS评分均较术前明显提高,术后第3、5、9 d治疗组分值低于对照组(P<0.05)。治疗组与对照组术前BMI无统计学差异(P>0.05),2组术后第3 d、9 d BMI均较术前明显降低,尤其是以术后第3天最低,且对照组BMI降低的程度甚于治疗组(P<0.05)。2组疼痛评分术前无明显差异(P>0.05),术后均较术前增高,治疗组术后 1、3、5 d 低于对照组(P<0.05)。见表1-3。
表1 2组疲劳评分(VAS评分)比较 ±s
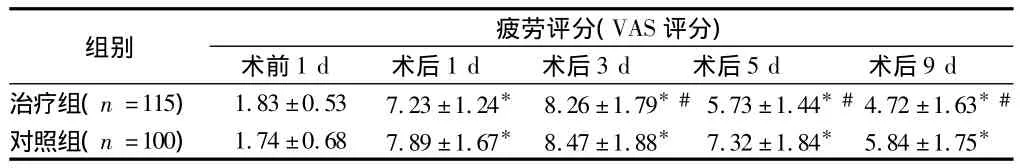
表1 2组疲劳评分(VAS评分)比较 ±s
注:与同组术前比较,*P <0.05;与对照组术后相同时间比较,#P <0.05
组别 疲劳评分(VAS评分)术前1 d 术后1 d 术后3 d 术后5 d 术后9 d治疗组(n=115) 1.83 ±0.53 7.23 ±1.24* 8.26 ±1.79*#5.73 ±1.44*#4.72 ±1.63*#对照组(n=100) 1.74 ±0.68 7.89 ±1.67* 8.47 ±1.88* 7.32 ±1.84* 5.84 ±1.75*
表2 2组BMI比较 ±s

表2 2组BMI比较 ±s
注:与同组术前比较,*P<0.05;与对照组术后相同时间比较,#P<0.05
组别BMI术前1 d 术后3 d 术后9 d治疗组(n=115) 25.14 ±3.02* 23.76 ±2.34*# 24.37 ±2.08*#对照组(n=100) 25.04 ±2.48* 22.19 ±2.51* 23.46 ±2.47*
表3 2组疼痛评分比较 ±s
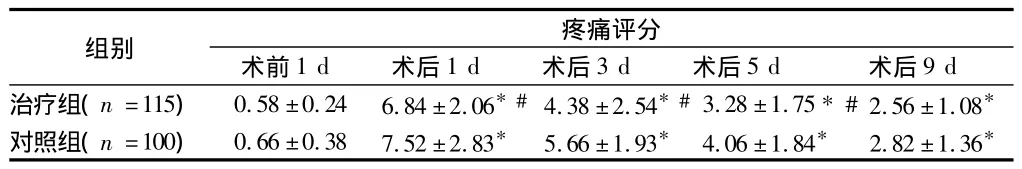
表3 2组疼痛评分比较 ±s
注:与同组术前比较,*P <0.05;与对照组术后相同时间比较,#P<0.05
组别 疼痛评分术前1 d 术后1 d 术后3 d 术后5 d 术后9 d治疗组(n=115) 0.58 ±0.24 6.84 ±2.06*#4.38 ±2.54*#3.28 ±1.75*#2.56 ±1.08*对照组(n=100) 0.66 ±0.38 7.52 ±2.83* 5.66 ±1.93* 4.06 ±1.84* 2.82 ±1.36*
2.2 2组TRF水平比较 2组TRF水平在手术前无明显差异(P>0.05);手术后TRF均明显下降,对照组明显低于治疗组(P<0.05);术后9 d时治疗组TRF已恢复至与术前无明显差异(P>0.05),但对照组仍明显低于术前(P<0.05)。见表4。
表4 2组TRF水平比较g/L,±s

表4 2组TRF水平比较g/L,±s
注:与同组术前比较,*P <0.05;与对照组术后相同时间比较,#P<0.05
组别 术前1 d 术后1 d 术后5 d 术后9 d治疗组(n=115) 2.08 ±0.76 1.64 ±0.84*# 1.78 ±0.94*# 1.94 ±0.84#对照组(n=100) 2.12 ±0.93 1.31 ±0.62* 1.46 ±0.66* 1.54 ±0.58*
2.3 治疗组与对照组炎症因子水平比较 术前2组患者炎症因子水平无明显差异(P>0.05)。治疗组和对照组手术后血清 IL-2、IL-6、IL-8、IL-17、TNF-α 水平均显著升高,IL-10水平明显下降;术后治疗组IL-2、IL-6、IL-8、IL-17、TNF-α 水平多低于对照组(P<0.05),而 IL-10水平高于对照组(P<0.05)。2组CRP水平在手术前无明显差异;手术后2组血清中CRP均明显升高,对照组明显高于治疗组(P<0.05)。见表5。
3 讨论
随着生活水平提高,我国直肠癌的发病率迅速上升至恶性肿瘤第3位[1]。直肠癌治疗以手术为主,手术创伤大、时间长。几乎所有患者在术后均出现不同程度的疲劳、嗜睡、乏力、精力不集中、行为及思维主动性差等症状,即术后疲劳综合征(postoperative fatigue syndrome,POFS)。POFS的发生主要与手术创伤、肌肉组织体积和功能的丧失、术后胃肠道功能紊乱及营养不良、心血管系统适应能力的降低有关[8],手术创伤诱发的全身炎症反应在POFS的发生进展中发挥了重要作用。
表5 治疗组和对照组炎症因子水平比较 ±s
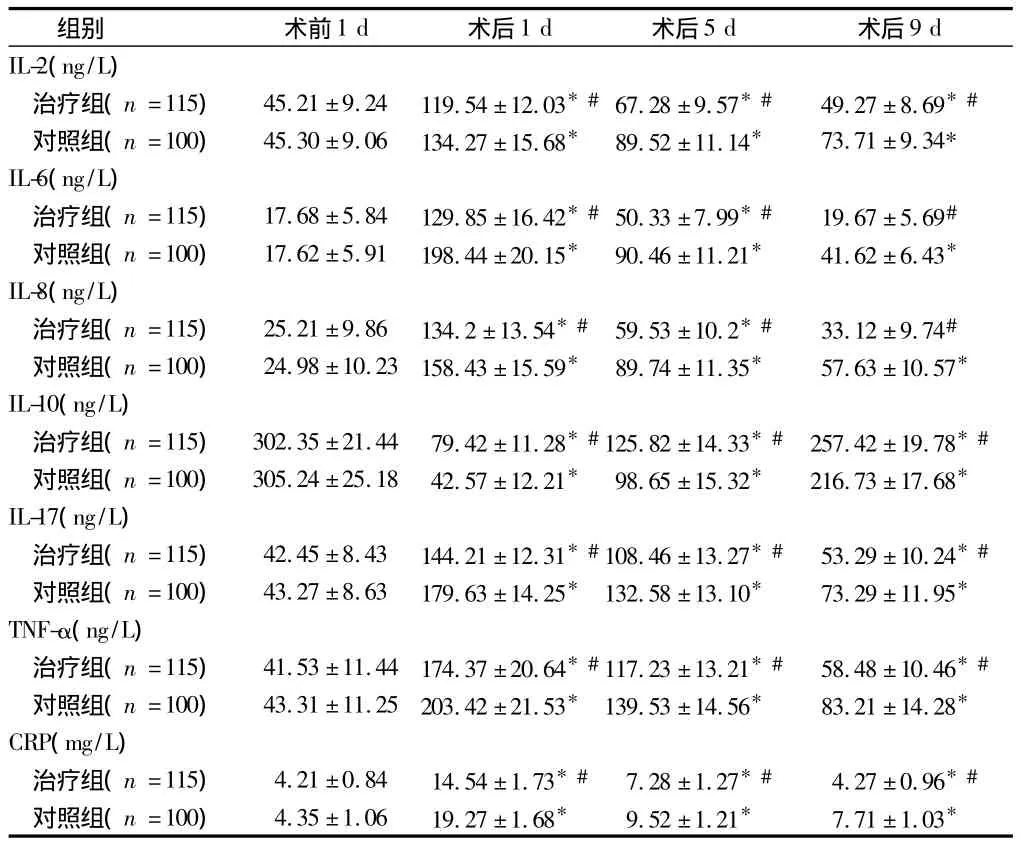
表5 治疗组和对照组炎症因子水平比较 ±s
注:与术前1 d 比较,*P <0.05;与对照组比较,#P <0.05
组别 术前1 d 术后1 d 术后5 d 术后9 d IL-2(ng/L)治疗组(n=115) 45.21 ±9.24 119.54 ±12.03*#67.28 ±9.57*# 49.27 ±8.69*#对照组(n=100) 45.30 ±9.06 134.27 ±15.68* 89.52 ±11.14* 73.71 ±9.34*IL-6(ng/L)治疗组(n=115) 17.68 ±5.84 129.85 ±16.42*#50.33 ±7.99*# 19.67 ±5.69#对照组(n=100) 17.62 ±5.91 198.44 ±20.15* 90.46 ±11.21* 41.62 ±6.43*IL-8(ng/L)治疗组(n=115) 25.21 ±9.86 134.2 ±13.54*# 59.53 ±10.2*# 33.12 ±9.74#对照组(n=100) 24.98 ±10.23 158.43 ±15.59* 89.74 ±11.35* 57.63 ±10.57*IL-10(ng/L)治疗组(n=115) 302.35 ±21.44 79.42 ±11.28*#125.82 ±14.33*# 257.42 ±19.78*#对照组(n=100) 305.24 ±25.18 42.57 ±12.21* 98.65 ±15.32* 216.73 ±17.68*IL-17(ng/L)治疗组(n=115) 42.45 ±8.43 144.21 ±12.31*#108.46 ±13.27*# 53.29 ±10.24*#对照组(n=100) 43.27 ±8.63 179.63 ±14.25* 132.58 ±13.10* 73.29 ±11.95*TNF-α(ng/L)治疗组(n=115) 41.53 ±11.44 174.37 ±20.64*#117.23 ±13.21*# 58.48 ±10.46*#对照组(n=100) 43.31 ±11.25 203.42 ±21.53* 139.53 ±14.56* 83.21 ±14.28*CRP(mg/L)治疗组(n=115) 4.21 ±0.84 14.54 ±1.73*# 7.28 ±1.27*# 4.27 ±0.96*#对照组(n=100) 4.35 ±1.06 19.27 ±1.68* 9.52 ±1.21* 7.71 ±1.03*
辅酶Q10是一种脂溶性抗氧化剂,能激活人体细胞和细胞能量的营养,具有提高人体免疫力、抗氧化、减轻炎症反应、增强细胞活力等功能[4,5,9]。临床广泛用于心血管系统疾病,但应用辅酶Q10是否可以预防或缓解患者POFS报道少见。因此我们在直肠癌术后应用辅酶Q10治疗,结果发现,辅酶Q10可以有效缓解患者的POFS,还可以减轻术后疼痛,并对促进BMI恢复有明显效果。
本研究进一步分析了辅酶Q10对血清炎性因子的作用。由于直肠癌术后存在全身炎性反应,血清多种炎性因子水平都发生变化。IL-2可介导全身炎性反应,在手术后明显升高[10]。IL-6是多效性细胞因子[11],IL-8 可以趋化并激活中性粒细胞[12],IL-17 也是一个重要的促炎症因子[13]。IL-10则是一种保护性因子,有抑制单核巨噬细胞释放炎性因子的作用[14]。TNF-α可以促进T细胞产生各种炎性因子,进而促进炎性反应的发生[15]。本研究治疗组和对照组手术后血清 IL-2、IL-6、IL-8、IL-17、TNF-α 水平均显著升高,IL-10水平明显下降,以术后第一天最明显。术后第5天开始下降,但至术后第9天治疗组IL-2、IL-10、IL-17、TNF-α尚未恢复到术前水平;而对照组 IL-2、IL-6、IL-8、IL-17、TNF-α 水平仍明显高于术前,IL-10 水平低于术前。术后第 9天治疗组 IL-2、IL-6、IL-8、IL-17、TNF-α水平低于对照组,IL-10水平高于对照组。CRP作为急性时相蛋白,其水平变化与手术创伤程度有关[16]。本研究发现术后第1天2组血清CRP的水平比术前均明显升高,且对照组高于治疗组;其后逐渐下降,术后第9天治疗组降至正常水平,而对照组仍明显增高。这些结果说明辅酶Q10可通过调节炎性因子水平,对机体炎性反应有明显抑制作用。
本研究发现直肠癌患者术后有明显POFS表现,应用辅酶Q10可以有效缓解POFS并减轻术后全身的炎性反应,对患者术后的康复有积极的作用,值得临床推广。
1 陈琼,刘志才,程兰平,等.2003~2007年中国结直肠癌发病与死亡分析.中国肿瘤,2012,21:179-182
2 Tan S,Zhou F,Li N,et al.Anti-fatigue effect of ginsenoside Rb1 on postoperative fatigue syndrome induced by major small intestinal resection in rat.Biol Pharm Bull,2013,36:1634-1639.
3 Holzheimer RG.After post-operative pain now the post-operative fatigue syndrome:wash my fur but do not wet me?World J Surg,2009,33:746-747.
4 Korkm E,Gokce EH,Ozer O.Development and evaluation of coenzyme Q10 loaded solid lipid nanoparticle hydrogel for enhanced dermal delivery.Acta Pharm,2013,63:517-529.
5 Kolahdouz Mohammadi R,Hosseinzadeh-Attar MJ,Eshraghian MR,et al.The effect of coenzyme Q10 supplementation on metabolic status of type 2 diabetic patients.Minerva Gastroenterol Dietol,2013,59:231-236.
6 董千铜,章晓东,余震,等.胃癌患者术后疲劳综合征的中西医结合治疗研究.中国中西医结合杂志,2010,30:1036-1040.
7 张飞,李奇,林荔军,等.联合多模式镇痛在全髋关节置换术后的早期疗效.中华关节外科杂志,2013,7:329-332.
8 Pomazkin VI.Syndrome of"postoperative fatigue".Vestn Khir Im I I Grek,2010,169:117-119.
9 Potgieter M,Pretorius E,Oberholzer HM.Qualitative electron microscopic analysis of cultured chick embryonic cardiac and skeletal muscle cells:the cellular effect of coenzyme q10 after exposure to triton x-100.Ultrastruct Pathol,2009,33:93-101.
10 Chen QQ,Yan L,Wang CZ,et al.Mesenchymal stem cells alleviate TNBS-induced colitis by modulating inflammatory and autoimmune responses.World J Gastroenterol,2013,19:4702-4717.
11 Waldner MJ,Neurath MF.Master regulator of intestinal disease:IL-6 in chronic inflammation and cancer development.Semin Immunol,2014,26:75-79.
12 Ghasemi H,Ghazanfari T,Yaraee R,et al.Roles of IL-8 in ocular inflammations:a review.Ocul Immunol Inflamm,2011,19:401-412.
13 Song X,Qian Y.IL-17 family cytokines mediated signaling in the pathogenesis of inflammatory diseases.Cell Signal,2013,25:2335-2347.
14 Hutchins AP,Diez D,Miranda-Saavedra D.The IL-10/STAT3-mediated anti-inflammatory response:recent developments and future challenges.Brief Funct Genomics,2013,12:489-498.
15 He J,Wang S,Zeng Y,et al.Binding of CD14 to Mycoplasma genitalium-Derived Lipid-Associated Membrane Proteins Upregulates TNF-α.Inflammation,2014,37:322-330.
16 Li C,Guo R,Lou J,et al.The transcription levels of ABCA1,ABCG1 and SR-BI are negatively associated with plasma CRP in Chinese populations with various risk factors for atherosclerosis.Inflammation,2012,35:1641-1648.

