脑微血管病变致缺血性卒中的危险因素、临床表现的相关分析
陈娜 陆连生 宋巧 康梅 卢海丽 杨香敏 张斌 李虹 李婧 王聪杰 吕晓培 史万英
脑小血管病(cerebral small- vessel disease,SVD)又叫脑微小血管疾病,主要包括毛细血管、小静脉、微动脉、小动脉等脑内小血管病变导致的疾病。目前广泛认为脑小血管疾病是指脑小动脉及微动脉血管病[1]。此病可分为微出血和缺血两类。缺血性脑小血管病(small vessel disease,SVD)占所有缺血性卒中的10%~30%,其病变主要累及供应脑深部白质、灰质核团和脑干的穿支小动脉,影像学表现主要为腔隙性脑梗死(lacunar infarction,LI)和脑白质疏松(Leukoaraiosis,LA)是脑血管病的一个重要亚型[2,3]。腔隙性脑梗死的病理特征主要是微动脉粥样硬化、小穿通动脉脂质玻璃样变、纤维素样坏死、脑白质病变、微出血。随着神经影像学检查的普及,老年人群中SVD检出率日益增高。研究表明,SVD是导致老年人认知功能下降、血管性痴呆(VaD)和功能残疾的重要原因之一[4]。近年来,研究微小血管病变导致的VaD发病的危险因素及早期进行预防治疗成为目前国本研究的热点。本研究对石家庄市第一医院中心院区神经内科2011年6月至2013年12月收治的缺血性SVD病例进行了回顾性分析,对脑小血管病的相关危险因素及临床表现进行分析,以便早期识别危险因素,并对其可控性危险因素进行积极干预,有助于预防缺血性卒中的发生,避免脑小血管病变导致的认知功能障碍和血管性痴呆进一步发展,以提高患者的生活质量。
1 资料与方法
1.1 一般资料 2011年6月至2013年12月本院神经内科确诊的114例缺血性SVD患者为观察组,收集同时期其他原因导致的脑梗死患者114例作为对照组。观察组114例患者,其中男63例,女51例;年龄39~76岁,平均(54.3±4.2)岁。所有病例均给予头颅CT或颅脑MRI检查:结果显示观察组病例均伴有多发腔隙性脑梗死或脑白质疏松;所有病例符合1995年全国第四届脑血管会议上提出的脑小血管病诊断标准[5]。对照组114例患者,其中男62例,女52例;年龄38~78岁,平均(53.8±4.5)岁;均经头颅 CT或MRI明确为非脑小血管疾病脑梗死;2组间性别比、年龄比较,差异无统计学意义(P>0.05)。
1.2 排除标准 (1)伴有抑郁和焦虑;(2)存在颅脑外伤、神经系统肿瘤、神经系统感染性疾病 ;(3)患有帕金森病、多发性硬化等影响认知功能的神经变性疾病;(4)大面积脑梗死、脑出血、大动脉粥样硬化性卒中或脑微出血;(5)患有影响认知功能的中毒、代谢、内分泌、药物滥用或全身系统性疾病;(6)既往有痴呆病史。
1.3 方法及观察指标 详细询问观察组和对照组所有病例的病史,有无吸烟饮酒史,有无高血压、糖尿病病史,监测血压;抽取患者晨起空腹血样标本,由日本生产的日立7180全自动生化分析仪测定血清总胆固醇、三酰甘油、血同型半胱氨酸(Hcy)、血糖各指标。本研究采用简易智能精神状态检查量表(mini-mental stateexamination,MMSE)和蒙特利尔认知评估量表(montreal cognitive assessment,MoCA)中文版作为认知功能障碍的筛查工具,回顾性分析SVD患者血管性认知功能障碍的危险因素和临床特征。
1.4 统计学分析 应用SPSS 17.0统计软件,计量资料以±s表示,采用t检验,计数资料采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 2组相关危险因素比较 观察组伴发高血压、糖尿病、冠心病、高脂血症、高Hcy血症、吸烟、酗酒等危险因素均高于对照组(P<0.05)。见表1。
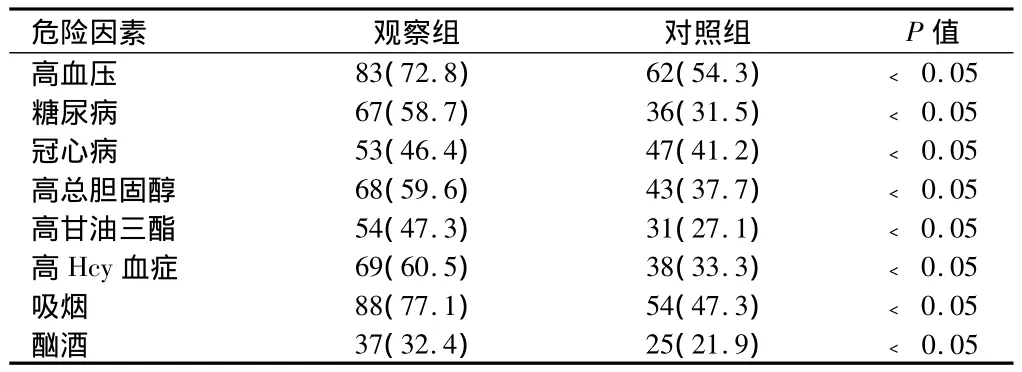
表1 2组相关危险因素比较 n=114,例(%)
2.2 2组MMSE评分及MoCA总分、各亚项得分比较观察组MoCA总分及定向力、视空间能力、执行功能、语言和记忆力的得分均低于对照组,差异均有统计学意义(P<0.05)。见表2。
2.3 2组临床症状比较 观察组临床症状轻微,其中伴有认知功能障碍72例,伴轻偏瘫17例,伴构音障碍-手笨拙综合征9例,伴轻度感觉障碍10例,无症状9例,影像学主要表现为多发腔隙性梗死及白质疏松症;114例非脑小血管病的脑梗死临床症状重,其中偏瘫患者71例,伴有失语者11例,伴有认知功能障碍者58例,伴有大小便失禁者11例;其中8例CT或MRI证实为大面积脑梗死,6例为脑干梗死,影像学资料显示梗死病灶范围大,病灶较孤立。2组比较观察组表现认知功能障碍患者明显多于对照组(P<0.05)。
表2 2组各类型认知功能的比较n=114,分,±s

表2 2组各类型认知功能的比较n=114,分,±s
组别 MMSE 定向力 语言 记忆力 视空间能力 执行能力 总分观察组 24.6 ±3.65 5.41 ±0.57 2.10 ±0.21 1.32 ±1.09 2.36 ±1.78 2.41 ±0.51 16.51 ±0.26对照组 20.1 ±2.83 6.76 ±0.48 2.71 ±0.37 3.21 ±1.59 4.15 ±0.85 4.58 ±0.27 23.45 ±1.37 t值5.66 4.65 1.20 0.78 4.98 6.78 4.132 P值 <0.01 <0.05 <0.01 <0.05 <0.01 <0.01 0.017
3 讨论
SVD临床上多指颅内小动脉、微动脉小血管病变引起的疾病。其病变小动脉的直径多在100~400 μm左右,直接起源于大的脑动脉,没有侧支吻合,是解剖终末支,其供血区域在脑深部白质及脑干[6]。SVD的病理学表现包括纤维素样变性、淀粉样变性、出血、闭塞等改变,而不是动脉粥样硬化[7]。微小血管病变在病理上称为腔隙性改变,在影像学磁共振成像(MRI)上腔隙性脑梗死表现为边界清晰、直径在2~15 mm、T1呈明显低信号、T2呈高信号的病灶。以往微血管病变引起的缺血性脑卒中不被重视,事实上脑微小血管壁的损害发生率很高,发生时间也较大血管壁早。随着MRI技术的发展和广泛应用,SVD发病的相关危险因素和临床表现越来越受到重视。
SVD的危险因素主要有高龄、吸烟、酗酒、高血压、糖尿病、高脂血症、高同型半胱氨酸血症等。高血压可导致心、脑、肾等多个靶器官损害,是老年人认知功能下降的重要危险因素[8]。长期高血压可使小血管壁胶原增生,增厚的血管壁缺血发生透明样变性,造成管腔狭窄,从而导致腔隙性脑梗死,造成局部脑组织缺血缺氧,致使神经元丢失而发生痴呆。有效控制高血压可延缓LA进展。与大血管病变相比,糖尿病更是SVD的重要危险因素。与没有糖尿病的患者相比,糖尿病患者的颅内和颅外动脉粥样硬化更为明显。小血管病变是糖尿病的重要并发症之一,血糖升高可通过一系列神经毒性和氧化应激反应导致脑部结构组织病变,影响了脑部的血液流变学,局部脑组织出现缺血或缺氧,发生神经细胞变性,从而影响认知功能,进而引发痴呆。所以本研究得出结论:糖尿病是认知功能下降的独立危险因素。高脂血症与动脉粥样硬化密切相关,高胆固醇血症与老年认知功能下降呈正相关。Khan等[9]的研究显示,高胆固醇血症可增高LI风险,其机制为高胆固醇血症促进动脉粥样硬化,使脑白质深部穿支动脉发生急性闭塞而导致LI。本研究还显示,吸烟是SVD患者认知功能障碍的独立危险因素。吸烟与动脉粥样硬化密切相关,是众多心脑血管疾病的危险因素。研究发现,吸烟可促进脑白质病变,并随着年龄的增长而加重。烟草中的尼古丁等有害物质吸入后会刺激自主神经,使血管痉挛,血压升高,并直接损害血管内皮,激活凝血因子,升高纤维蛋白原,发生脑缺血性损害。大量饮酒可影响患者的认知功能,酒精是亲脂性物质,易通过血脑屏障,可直接损害大脑皮质和皮质下区,使脑细胞脱水、变性、坏死,造成神经细胞胞体萎缩和引起脑毛细血管阻力增加,血流量下降,深部小动脉闭塞,大脑在长期缺血缺氧状态下产生功能及形态改变,导致了弥漫性大脑萎缩和VaD。有研究证实,高同型半胱氨酸血症是认知功能障碍的独立危险因素。杨帆等[10]研究发现,VaD与阿尔茨海默病患者血浆同型半胱氨酸平均水平的差异有显著性,VaD患者血浆HcY平均水平明显高于阿尔茨海默病患者以及正常对照组,高HcY导致认知功能障碍的机制可能与两方面因素有关,一种是血浆维生素B12或叶酸浓度低直接或间接引起认知功能下降;另一种原因可能是高HcY通过血管性或神经毒性病理作用直接损伤认知。在本研究中还发现,高龄、冠心病也是认知功能降低的危险因素。
腔隙性脑梗死的临床表现除可能导致纯运动性轻偏瘫、纯感觉障碍、构音障碍-手笨拙等局灶性神经功能损害外,还可能引起认知功能障碍,可表现在执行功能缺乏、反应迟钝、思维迟缓、主动性差及抽象思维受损等方面,其中以执行功能及信息处理速度受损为主。Jokinen等[11]对387例患者进行了3年的随访,发现腔隙性脑梗死与执行功能受损和精神运动速度减慢相关,腔隙性脑梗死被认为是认知功能受损的独立危险因素。
所以,SVD是神经科临床医师应该重视的疾病,微血管病变导致的VaD是多种因素共同作用的结果。在临床工作中,早期发现脑小血管病的影像学表现,也就是腔隙性脑梗死,要高度重视,积极完善各项相关检查,对有高血压、高血脂、糖尿病、冠心病、高同型半胱氨酸血症及吸烟酗酒的患者,应早期予以干预,包括控制血压、降低血糖、调整血脂、应用维生素B6、维生素B12及叶酸降低血清总同型半胱氨酸,采取低盐低脂糖尿病饮食、戒烟限酒、适度体力活动等好的生活方式,以消除或控制 VaD发生的危险因素,同时积极治疗脑卒中,改善脑功能,避免更严重的脑血管病事件、血管性痴呆的发生。减少脑卒中复发次数,对VaD的发生、发展及治疗起到重要的作用,还能减轻患者家庭和社会经济压力和负担。
1 李伟,李桂林,王拥军.脑小血管病.中华内科杂志,2010,49:163.
2 Pantoni L.Cerebral small vessel disease:from patho aesis and clinical characteristies to therapeutic challenges.Lancet Neurol,2010,9:689-701.
3 Patel B,Markus HS.Magnetic resonance imaging in cerebral small vessel disease and its use as a surrogate disease marker.Int J Stroke,2011,6:47-59.
4 Nasreddine ZS,Phillips NA,Bedirian V.The Montreal Conitive Assessment(MoCA):A Brief Sereening Tool For Mild Cognitive Impairment.J Am Geriatr Soe,2005,53:695-699.
5 陈清棠.各类脑血管病疾病诊断要点.中华神科科杂志,1996,29:379-30.
6 Arboix A,Martí- Vilalta JL.Lacunar stroke.Expert Rev Neurother,2009,9:179-196.
7 张微微.脑小血管病的新进展.中华脑血管病杂志:电子版,2008,2:210-213.
8 Reitz C ,Tang MX,Manly J,et al.Hypertension and the risk of mild cognitive impairment.Arch Neurol,2007,64:1734-1740.
9 Khan U,Porteous L,Hassan A,et al.Risk factor pro file of cerebral Small vessel disease and its subtypes.J Neurol Neurosurg Psychiatry,2007,78:702-706.
10 杨帆,徐书雯,黄越冬,等,阿尔茨海默病和血管性痴呆患者血浆同型半胱氨酸水平的差异.实用医学杂志,2009,25:3228-3230.
11 Jokinen H,Gouw AA,Madureira S,et al.Incident lacunes influence cognitive decline.Neurology,2011,76:1872-1878.

