3种快速检测生肉中单核增生李斯特菌的方法研究
郭 惠,杨晋川,王路梅,许静静,张 雷
单核细胞增生李斯特菌(Listeriamonocytogenes,L.m)是一种能引起人兽共患病和食源性疾病的致病菌,广泛分布于环境中并通过污染食品引起人类李斯特菌病。 据近年来食源性致病菌调查结果显示,L.m在生肉中污染率最高[1-2],国内相关研究较少,经过初步比较[3-4],选择荧光定量PCR技术和磁免疫分离技术(immunomagnetic separation, IMS)结合,建立生肉制品中L.m的快速确认方法。
1 材料与方法
1.1试验菌株 (本试验所用菌株分为2组。目标菌株:实验用L.m54003 购自中国药品生物制品检定所,其余5株L.m菌株为扬州疾病预防控制中心惠赠,分属于5 种不同血清型(1/2a、1/2b、1/2c、3a 和b)。干扰菌株:以下所用16株标准菌株购自中国药品生物制品检定所:溶藻弧菌(ATCC17749)、拟态弧菌(ATCC33653)、嗜水气单胞菌(CMCC11801)、肠炎沙门(CMCC50041)、弗氏枸橼酸杆菌(CMCC11732)、普通变形杆菌(CMCC49101)、肺炎克雷伯菌(CMCC46114)、金黄色葡萄球菌(ATCC25923)、腊样芽孢杆菌(ATCC 11077),产毒性大肠埃希菌(44823),肠致病性大肠杆菌(44814)、宋内氏志贺菌 (ATCC 51334)、福氏志贺菌(ATCC 51302)、鼠伤寒沙门菌(ATCC51003),大肠埃希菌(ATCC 25922、8099)。本实验室分离自食源性疾病标本,经API系统鉴定并保存的9株菌有:绵羊李斯特氏菌、牛链球菌、副溶血弧菌、肠炎沙门菌、O157∶H7 大肠杆菌、金黄色葡萄球菌、屎肠球菌、小肠结肠耶尔森菌O∶3血清型、抗坏血酸克吕瓦菌。
1.2主要仪器及试剂 Invitrogen Bead Retriever TM自动捕获系统及L.m免疫磁珠为挪威Dynal公司产品,hlyO基因荧光定量PCR[5]使用引物及 TaqMan探针由上海生工公司合成。Premix Ex Taq 产品。通过ABI 7500 Fast Realtime PCR系统检测,显色培养基为法国卡玛嘉公司产品。引物及探针序列见表1。
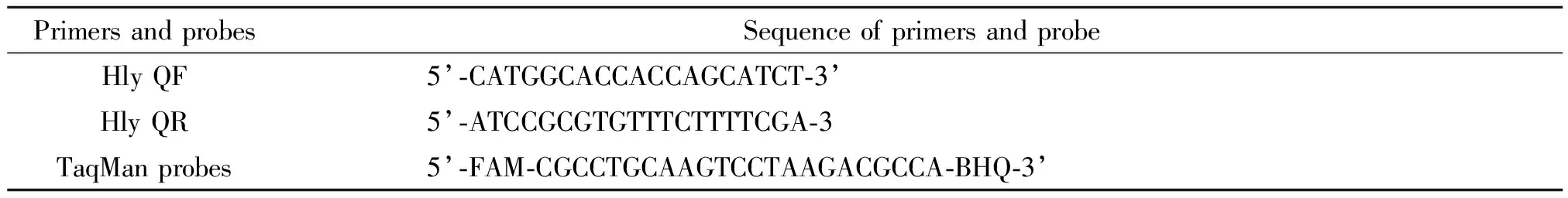
表1 引物及探针序列
1.3样品来源 2007-2012年间,在农贸市场采集污染率较高的423份生肉,进行L.m的检测,阴检样品作为模拟样品进行模拟实验。
1.4方法
1.4.1样品增菌 选择Frasher 肉汤进行样品增菌18 h,用改进的化学抽提方法提取DNA[5],抽提得到的沉淀用生理盐水洗2次,溶于20 μL去离子水,加热煮沸10 min,离心取上清用于扩增。 用荧光定量PCR快速检测L.mhlyO基因,为Realtime-PCR方法,阳性者,按照说明进行免疫磁珠的捕获,将10 μL捕获产物用于显色培养基分离,可疑菌用荧光定量PCR快速确认,为PCR-IMS法。将样品增菌液直接用IMS捕获后用显色培养基分离,检测结果作为评价的标准,同时用GB 4789.30-2010国标方法进行比对检测。
1.4.2Real-time PCR反应体系 Premix (2×) 10 μL;PCR引物 (10μmol/L)各0.4 μL; 探针 (10 μmol/L)0.2 μL;DNA模板 2.0 μL;去离子水 7.0 μL,总体系 20 μL。反应条件采用两步法PCR扩标准程序:第1步,预变性,95 ℃10 s 1 个循环;第2步,PCR反应95 ℃5 s,60 ℃20 s,40 个循环。
1.4.3特异性试验 将干扰菌和目标菌的新鲜培养液分别稀释为101-102cfu/mL和102-103cfu/mL加入100 mL样品增菌液中,再将干扰菌新鲜培养液稀释为102-103cfu/mL分别加入不同实验管中,进行上述检测,重复3 次。用平板计数法来计算试验用菌液浓度。
1.4.4灵敏性试验 先将上述的背景菌和干扰菌加入100 mL样品增菌液中,再将目标菌的标准株分别稀释为不同的浓度加入不同实验管中,以2种方法对同一浓度样品重复试验5~20次,观察方法的灵敏度,固定主要操作者。
1.5实际检测效果评价 对采集的生肉制品同时用国标方法和PCR-IMS法进行L.m检测效果比对。
2 结 果
2.1特异性试验 Real-time PCR 反应中只有L.m有出现阳性结果,对5种血清类型的目的菌亦有较好的特异性,其他干扰菌均没有荧光信号。
2.2敏感性试验结果 经过预试验,国标方法检出低限为500 cfu/10 g,不增菌PCR-IMS方法能检出目标菌含量≥50 cfu/10 g 的样品,因此选择该浓度为上限进行敏感性检测,详见表2。
2.3实际检测效果评价 在423份样品的检测中,PCR-IMS法的尤等指数显著高其他两种方法(见表3)。
表2两种方法检测模拟样品的敏感性(平行管数20)
Tab.2Resultofsensitivitybytwomethodsinsimulatedsamples

Final concentration of Listeria monocy(cfu/10 g)Positive frequency and ratePCR-IMSReal-time PCRBefore enrichment 30-5020/10020/100 10-2019/9520/100 1-1018/9018/90After enrichment 10-2020/10020/100 1-1018/9020/100
Note: Ct value≤35 as the positive standard.
3 讨 论
L.m在我国食品中的污染较为严重,同时动物也有带菌现象,因而具有引起暴发感染的危险性[1-2]。目前的国标方法,耗时较长(至少需要 3~5 d)并且容易受到细菌本身状态和多种外界因素影响。PCR-IMS方法应用于L.m的快速确证检测,灵敏度较国标方法提高了近百倍,将检测时限缩短在48 h以内,敏感度和特异度均>95%,具有很好的诊断价值,可望能作为突发应急事件中病原菌快速筛选和确认方法。

表3 3种方法检测实际样品效果比较
从上述方法学的评价来看,real-time PCR结合改进的化学抽提法用于初筛,有效去除生肉中的脂类和蛋白质的干扰,对模拟样品和实际样品的检测均有较高的特异性和敏感度。而PCR-IMS方法能结合免疫磁珠的特异性吸附浓缩作用,又进一步提高了快速确证方法的敏感度。PCR-IMS方法用于2007-2011年徐州地区食源性样品单增李斯特氏菌的检测,发现生肉污染率为5.96%,高于江苏省内的平均水平(4.71%)。
参考文献:
[1]Schwartz B, Hexter D, Broome CV, et al. Investigation of an outbreak ofListeriosis: new hypotheses for the etiology of epidemic Listeria monocytogenes infections[J]. J Infect Dis, 1989, 159(4): 680-685. DOI:10.1093/infdis/159.4.680
[2]Zhang SH. The situation ofListeriamonocytogenescontamination in foods[J]. Chin J Public Health, 2000, 16 (6): 564-565. (in Chinese)
张顺合.单核细胞增生李斯特氏菌在食品中的污染[J]. 中国公共卫生, 2000,16 (6): 564-565.
[3]Guo H, Yang JC, Zhang L, et al. Rapid detection of three new emerging pathogens by new methods based on the immunomagnetic separation technique[J]. Dis Surveill, 2011, 26(4): 329-331. (in Chinese)
郭惠,杨晋川,张雷, 等. 应用磁免疫技术快速检测三种新发病原菌[J]. 疾病监测,2011,26(4):329-331.
[4]Arakaki A, Nakazawa H, Nemoto M, et al. Formation of magnetic by bacteria and its application[J]. J R Soc Interface, 2008, 5(26): 977-999. DOI:10.1098/rsif.2008.0170
[5]Oravcova K, Kuchta T, Kaclikova E. A novel real-time PCR-based method for the detection ofListeriamonocytogenesin food[J]. Lett Appl Microbiol, 2007, 45(5): 568-573. DOI:10.1111/j.1472-765X.2007.02234.x

