追施氮肥量对菘蓝根的外形品质、 干物质积累及活性成分含量的影响
肖云华, 吕婷婷, 唐晓清, 王康才, 瞿光航, 朱毅斌, 李月鹏
(南京农业大学园艺学院,南京 210095)
常用中药板蓝根与大青叶分别来自于十字花科(Cruciferae)菘蓝属二年生草本植物菘蓝IsatisindigoticaFort的干燥根与叶,其中板蓝根是应用广泛的大宗药材,性苦、 寒,归心、 胃经,具有清热解毒、 凉血利咽的功效[1]。大青叶性苦、 寒,归心、 肺、 胃经,具有凉血消斑、 清肝泻火、 定惊的功效[2]。板蓝根在临床配方中应用较多,还与其它中药组成复方如板蓝根颗粒、 板蓝根软胶囊、 板蓝根片等,广泛用于治疗多种疾病如流感、 腮腺炎、 乙脑、 肝炎,是公认的有较好抗病毒效果的中药之一。近年又发现其有抗血小板聚集、 增强机体免疫功能及抗内毒素等作用。板蓝根主要化学成分包括生物碱类、 黄酮类、 腺苷、 有机含硫化合物、 有机酸类等,其中生物碱类、 多糖类、 黄酮类等专属性较强,是近年来研究较多的成分[3]。
氮素营养是影响植物生长和次生代谢过程的重要环境因子之一[4-5],氮素的吸收和同化与植物的很多生理过程、 产量和品质关系密切[6]。植物的生长发育与氮肥密切相关,生产上除了基肥之外常常会追施氮肥,调节植物在生长期间的营养。目前关于菘蓝的研究主要集中在化学成分、 药理活性、 制剂工艺、 临床应用等方面,而关于氮肥施用量对菘蓝的生长、 光合参数及活性成分积累的影响尚未见报道。为此,通过田间试验,研究追施不同氮肥施用量对菘蓝植株的生长、 光合参数及药材品质的影响,以期提高氮肥利用率,为菘蓝合理施氮提供理论基础。
1 材料与方法
1.1 试验设计
试验所用种子为选择的优质山西菘蓝种子,试验地设在南京农业大学江浦农场园艺站实验基地。供试土壤为棕壤,0—30 cm土层有机质0.907 g/kg、 全氮0.15%、 碱解氮136 mg/kg、 有效磷19.5 mg/kg、 速效钾0.16 mg/kg、 土壤pH 6.35,该土壤有机质和全氮含量较低。
试验通过田间小区进行,小区间距40 cm,沟深30 cm,四周设1 m宽保护行。每个小区面积为6 m2(2 m×3 m),于2012年5月5日进行条播,行株距25 cm×7 cm。试验设5个施氮水平,氮肥用量分别为225 kg/hm2、 450 kg/hm2、 675 kg/hm2、 900 kg/hm2、 1125 kg/hm2,处理正常施P、 K肥,以N225、 N450、 N675、 N900、 N1125表示,每个处理3个重复小区,分两次追施,每次用量相同;对照不施氮肥,只施P、 K肥,对照3组,以NCK表示。随机区组排列,进行常规田间管理。第一次追肥在6月上旬,第二次追肥于8月下旬,在行间挖浅沟浇入,然后覆土。各处理磷、 钾肥用量相同,按KH2PO4150 kg/hm2水平施用。氮肥品种为尿素(含N 46%),磷钾肥品种为磷酸二氢钾(含K 16.4%、 P 26.7%)。(R,S)-告依春(购置于中国药品生物制品检定所,批号111753-201103,含量分析纯,纯度>98%),甲醇为色谱纯,其余试剂为分析纯。
1.2 测定项目及方法
生物量测定: 12月7号(栽后215 d)采收,每个小区随机采取15株,清洗干净,按地上部(大青叶)、 地下部(板蓝根)两个部位分开,准确称量重量,105℃杀青15 min后60℃烘至恒重,准确称量干重,粉碎过60目筛备用。
主根长、 主根直径、 侧根数的测量: 为保证菘蓝根的完整性,以单株菘蓝根所在为中心,向下深挖30 cm,挖出菘蓝根,将根周围的土壤小心除去,洗净擦干。选取小区内长势一致的菘蓝植株20株,用直尺量取主根长;于菘蓝根根上部1/4处用游标卡尺测量主根直径;对直径超过(包括)5 mm的侧根进行读数。
根中(R,S)-告依春的测定方法参照《中国药典》(2010版)高效液相色谱法测定根中(R,S)-告依春的含量[1]。Waters 2695高效液相色谱仪色谱条件: 四元泵,在线脱气,自动进样器,Waters 2998 DAD检测器,Empower 2色谱工作站;柱温箱柱温40℃;以甲醇-0.02%磷酸溶液(7 ∶93)为流动相;检测波长245 nm。
根中多糖的测定方法: 参考《植物生理生化实验原理和技术》(第2版)苯酚-浓硫酸法测定多糖含量[7]。
1.3 数据统计分析
采用Excel和SPSS17.0统计软件对实验数据进行分析,数据间比较采用Duncan氏新复极差法。
2 结果与分析
2.1 不同氮肥施用量对菘蓝根生长指标的影响
随着施氮量的增加菘蓝主根直径逐渐增加,N225、 N450、 N675、 N900、 N1125分别比NCK增大了15.98%、 14.85%、 23.90%、 30.69%、 31.97%;各处理与对照差异显著(P<0.05)(表1);两个低氮处理N225、 N450差异不显著,在高氮处理N1125下达到最大,N900、 N1125差异不显著(P>0.05),根直径增加幅度变小,可以看出N900之后继续增加氮肥用量对菘蓝植株的壮根效应不明显。主根长与施氮量呈正相关,N225、 N450、 N675、 N900、 N1125分别比NCK增长了4.49%、 18.52%、 23.90%、 28.95%、 25.53%,追施氮肥能显著促进主根根长;各处理与对照差异显著;处理N675、 N900、 N1125差异不显著,这与施氮量对主根直径的影响一致。
施氮量增加菘蓝根的侧根数,除了处理N450,其他各处理与对照差异显著(P<0.05),且处理间差异显著(P<0.05);低氮量N225和高氮量N900、 N1125下菘蓝根侧根数都显著高于对照,而中等氮用量N450、 N675菘蓝根侧根数增幅不明显;说明低氮和高氮水平会显著增加菘蓝根侧根数,但在一定程度上影响了药材的外形。值得注意的是,对照的侧根数最少,可能是因为本实验选取5 mm以上的侧根,而无氮条件下植株的根倾向于变细变长;也可能是因为对照不施氮不能满足植株正常的生长发育需求,所以植株减少不必要的消耗以至侧根数较少。综合分析认为菘蓝植株总鲜重随着氮肥施用量的增加而增加,各处理间差异显著;过量施用氮肥N1125总鲜重反而降低(表1)。说明适量追施氮肥可以促进菘蓝生长,但是过量施氮不利于植株总鲜重的积累。
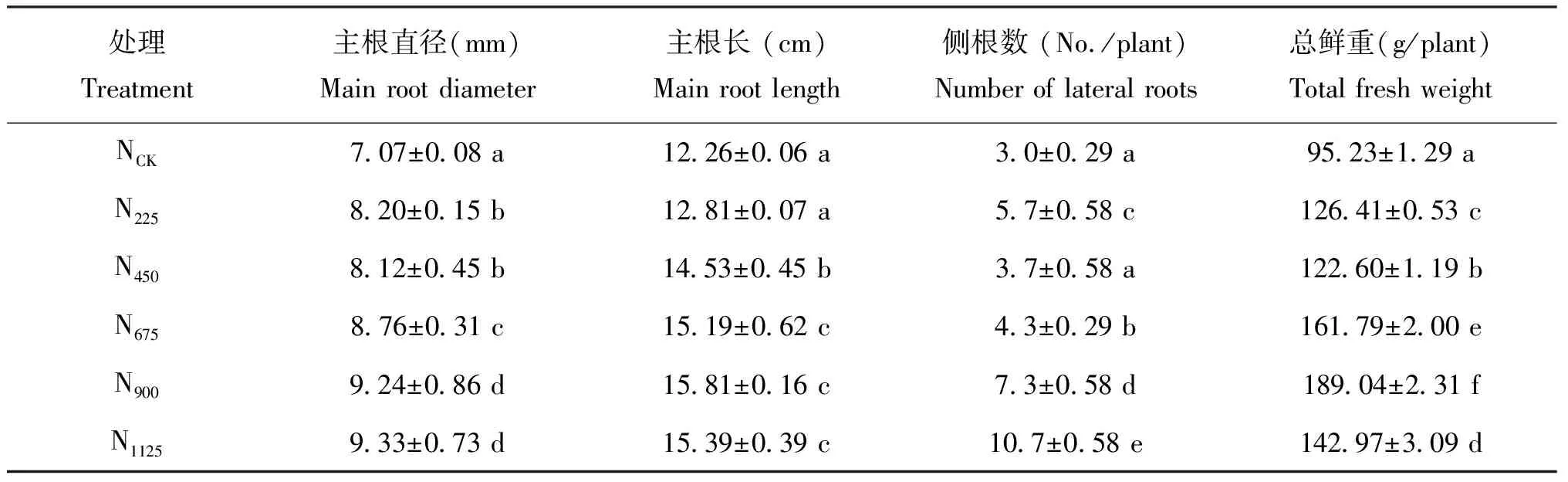
表1 不同施氮量对菘蓝根生长指标的影响Table 1 Effect of different nitrogen fertilizer rates on the growth of roots of Isatis indigotica Fort.
注(Note): 同列数值后不同字母表示处理间差异达到5%显著水平 Values followed by different letters in a column mean significant differences between treatments at the 5% level.
2.2 不同氮肥施用量对菘蓝干物质的积累和根冠比的影响
随着氮肥施用量的增加,菘蓝根冠比呈降低的趋势,在高氮处理N1125下陡然增大为0.922,但小于0.966(N675)大于0.745(N900);不施氮处理的根冠比大于施氮处理,且各施氮处理之间差异显著。说明施氮对对菘蓝地上部分的增加效应更明显,对地下部的促进作用小于对地上部的促进作用。
注(Note): 同列数值后不同字母表示处理间差异达到5%显著水平 Values followed by different letters in a column mean significant differences between treatments at the 5% level.
2.3 不同施氮量对菘蓝光合相关参数的影响
随着氮肥施用量的增加,菘蓝叶片净光合速率、 气孔导度、 蒸腾速率、 胞间CO2浓度都表现出相似的变化规律,呈先增加后下降后增大的趋势(图1);各处理都显著高于对照,说明增施氮肥有利于提高菘蓝净光合速率等相关光合指标;各处理都在N225时最小,净光合速率(Pn)为CO27.293 μmol/(m2·s)、 气孔导度(Gs)为H2O 0.054 mol/(m2·s)、 蒸腾速率(Tr)为H2O 0.723 mmol/(m2·s)、 胞间CO2浓度(Ci)为CO2153.68 μmol/(m2·s);在处理N1125时最大,分别为CO29.667 μmol/(m2·s)、 H2O 0.083 mol/(m2·s)、 H2O 1.158 mmol/(m2·s)、 CO2178.984 μmol/(m2·s);净光合速率和蒸腾速率在N900处理下比处理N675低,而气孔导度和胞间CO2浓度在N900处理下比处理N675高,说明施氮量对菘蓝叶片非气孔因素和气孔因素的影响是有差异的。结合施氮量对干物质的影响来看,最大光合参数下的施氮量和最大产量下的施氮量是不一致的,其原因有待进一步研究。
2.4 不同施氮量对菘蓝根中活性成分含量的影响



表3 不同施氮量下菘蓝根中的多糖和(R,S)-告依春含量Table 3 The contents of polysaccharide and (R,S)-epigoitrin in Isatis indigotica roots with different N fertilizer rates
注(Note): 同列数值后不同字母表示处理间差异达到5%显著水平 Values followed by different letters in a column mean significant differences between treatments at the 5% level.
3 讨论和结论
3.1 不同施氮量对菘蓝根外形品质和菘蓝光合参数的影响
由于不同施氮量对作物生长基础营养供给不同,因而对作物整体及根系的生长发育、 地上部和地下部产量、 根冠比等影响也不同。有研究发现适量的氮素供应能促进作物根、 蘖、 茎、 叶等营养器官生长发育和协调群体发展[8-10]。实验结果表明: 1)施氮量与菘蓝根的生长呈正相关,随着施氮量的增加,菘蓝根呈主根直径增加、 主根长增加、 侧根数增加的趋势,说明适量的追施氮肥可以起到壮根的作用,这与于立忠[11]等对日本落叶松根的研究结果一致。2)菘蓝植株的总鲜重随着施氮量的提高而增加,但超过900 kg/hm2后就不再增加,这与腊贵晓等[12]的研究结果一致。高氮处理1125 kg/hm2植株总重反而下降,初步推测原因可能是氮肥对地上部的促进作用更显著,虽然地上部的旺盛生长可以通过反馈作用促进根系对氮素的吸收,但过量的氮肥供应造成地上部叶片奢侈增长,增氮引起的壮根速度跟不上地上部对营养需求的速度,根系过多的输出又反过来影响了植株整体的生长状况,使植株总重下降。3)低氮用量N225和高氮用量N900、 N1125下菘蓝根侧根数都显著增多,原因是在低氮水平下,植物生长发育的正常氮素需求不能被满足,为吸收更多的氮素,植物扩大根系数量,因而低氮下侧根数较多。而在高氮条件下,植物氮需求受植株地上部生物量调节,植株地上部长势快、 生物量大,不断产生新的组织,对氮的需求量大。氮需求就是植株从土壤中吸收氮用于满足植物生长和同化合成化学成分或新组织所需求的氮量。本实验中追施氮肥造成植株地上部生长(包括生物量、 叶光合能力等)过快,植株整体对氮需求增大,为促进对植株氮的吸收作出相应的调节,增多侧根数以提高根系活力,所以高氮量下侧根数显著增加。这与Robinson[13]的研究结果相一致。四,追施氮肥有利于提高菘蓝植株净光合速率、 蒸腾速率、 气孔导度、 胞间 CO2浓度;如果净光合速率和气孔导度与胞间 CO2浓度的趋势一致,说明净光合速率下降是受气孔因素限制,如果净光合速率和气孔导度变化与胞间 CO2浓度变化的趋势相反,则说明净光合速率下降是受非气孔因素限制[14-15]。结合施氮量对生物量的影响,最大光合参数下的施氮量和最大产量下的施氮量是不一致的,晏枫霞等[16]研究菘蓝形态对光合参数的影响,其结果表明使光合参数最大和产量最大的铵硝配比是不一致的,可见菘蓝光合参数与产量关系并不呈正相关,具体的机理有待进一步研究。
3.2 不同施氮量对菘蓝地上部和地下部干物质积累和相互转移的影响
植物根系与地上部在对营养物质需求上相互依赖、 相互制约;另一方面,由于具有不同的生长环境和生理功能,因而对环境因子反应有着不同的表现[17]。根系是植物吸收水分和养分的重要器官,根系与地上部相互作用的研究受到越来越多的重视[18-21]。植物地下部竞争往往形式多样,过程较为复杂[22]。在养分充足的环境中,植株生长旺盛,根系在氮磷供应充足的土壤中可以刺激侧根的发生和养分的流入[19];在土壤比较贫瘠的环境中,大部分植物倾向于使根系变细变长,增加根系与土壤的接触面积,形成庞大的根系,占据更大的空间优势[24-25],大的根系可以对供氮不足起到补偿作用;有的则提高单位根系的吸收功能[13]。但存在种间竞争的条件下,根系增长使根长密度和氮素吸收有很高的相关性[26-27]。根系形态参数如根长密度和根表面积对主要借扩散到达根表的那些养分有效性具有决定性作用。
本试验中,氮肥施用量与菘蓝产量呈正相关,与菘蓝植株根冠比呈负相关,说明增加氮肥用量可明显促进大青叶和菘蓝根产量的积累,且施氮量对菘蓝地上部产量比地下部产量的增加有更加显著的效应。施氮量对地上部和地下部干物质积累的变化规律是相似的,菘蓝地上部、 地下部干物质积累随着氮肥用量的提高而增加,但超过一定量之后就不再增加,氮肥供应过多容易造成植物奢侈吸收,增产幅度与效益下降。菘蓝地上部干物质在900 kg/hm2处达到最大,地下部干物质在675 kg/hm2达到最大,可以推断出菘蓝总重在增加的同时其干物质的积累存在一定的转移。施氮量到675 kg/hm2之后增施氮肥(即在900 kg/hm2时)根系将更多的养分向上输送满足地上部的生长,此时地上部干物质积累最大,导致根系本身发育营养减少,根系干物质积累减少,又反馈到地上部使其干物质积累减少,所以根冠比在处理N1125时增大。考虑到药材菘蓝根的外形品质,使菘蓝根和大青叶产量达到最大的追施氮肥量分别是675 kg/hm2和900 kg/hm2。
3.3 不同施氮量根中主要次生代谢产物与多糖的关系
植物初生代谢(primary metabolism)是指所有植物的共同的代谢途径,合成糖类、 氨基酸类、 普通的脂肪酸类、 核酸类以及由它们形成的聚合物,用以维持植物的生存和健康。而植物次生代谢(secondary metabolism)具有不同于初生代谢的特点,植物次生代谢产物不直接参与植物生长和发育过程,但影响植物与环境的相互关系[28]。植物的初生代谢和次生代谢之间并没有清晰的界限。初生代谢提供了许多小分子物质作为次生代谢途径的前体,而很多情况下次生代谢产物的前体同样也用于初生代谢产物的合成,如蛋白质、 脂肪酸类的生物合成。植物初生代谢和次生代谢存在一定的矛盾,大量研究表明: 有利于初生代谢的环境条件不利于次生代谢,不利于初生代谢的条件反而增强次生代谢。例如枸杞等药用植物人工栽培时其产量取决于初生代谢产物的积累,而其质量则取决于次生代谢产物的积累,保证其药材质量及有效性的基础是植物的次生代谢[29-34]。
康建宏等[35]对枸杞研究认为,随着施氮量的增加,多糖含量不断减少,甜菜碱和黄酮含量(枸杞中主要次生代谢产物)有增加的趋势;多糖含量和甜菜碱、 黄酮呈负相关。而本实验研究结果与其结果并不完全一致,实验结果表明随着追施氮肥用量的增加,多糖含量先增加后下降,在处理N675达到最高,为158.383 μg/g,和干物质的积累有相似的变化规律;而菘蓝根中(R,S)-告依春的含量与氮肥施用量的关系不太明显,说明(R,S)-告依春与氮素营养相关性较小,可能受其他环境影响较大。因为植物次生代谢产物不仅有明显的种属特异性,而且限制于一些特定的细胞、 组织、 器官或是特定的发育时期。非生物因子如温度、 水分、 光照、 大气、 盐分、 养分等都会对植物的生长产生各种各样的影响甚至胁迫。而次生代谢产物是植物适应这种胁迫的基础物质之一。

参考文献:
[1] 国家药典委员会. 中华人民共和国药典·一部[S].北京: 中国医药科技出版社, 2010. 20-21.
Chinese Pharmacopoeia Commission. Pharmacopoeia of People’s Republic of China. One edition [S]. Beijing: China Medical Science Press, 2010. 20- 21.
[2] 国家药典委员会. 中华人民共和国药典·一部[S]. 北京: 中国医药科技出版社, 2010. 191- 192.
Chinese Pharmacopoeia Commission. Pharmacopoeia of People's Republic of China. One edition [S]. Beijing: China Medical Science Press, 2010. 191- 192.
[3] 彭少平, 顾振纶.板蓝根化学成分、 药理作用研究进展[J]. 中国野生植物资源, 2005, 24(5): 4-7.
Peng S P, Gu Z L. Research progress on chemical constituents and pharmacological activities ofRadixisatidis[J]. Chin. Wild Plant Res., 2005, 24(5): 4-7.
[4] 阎秀峰. 植物次生代谢生态学[J]. 植物生态学报, 2001, 25: 639-640.
Xian X F. Ecology of plant secondary metabolism[J]. J. Plant Ecol., 2001, 25: 639-640.
[5] Almeida-Cortez J A, Shipley B, Arnason J T. Effects of nutrient availability on the production of pentaynene, a secondary compound related to defense, inRudbeckiahirta[J]. Plant Spec. Biol., 2003, 18: 85-96.
[6] 刘秀杰, 宫占元. 植物氮素吸收利用研究进展[J]. 现代化农业, 2012, (8): 20.
Liu X J, Gong Z Y. Plant nitrogen uptake and utilization research progress[J]. J. Agric. Modern., 2012, (8): 20-21.
[7] 王学奎. 植物生理生化实验原理和技术(第2版)[M].北京: 高等教育出版社, 2006. 205-206.
Wang X K. The principle and technology of plant physiology and biochemistry experiment (Second Edition)[M]. Beijing: Higher Education Press, 2006. 205-206.
[8] Longnecker N, Kirby E J M, Robson A. Leaf emergence, tiller growth and apical development of nitrogen deficient spring wheat[J]. Crop Sci., 1993, 33: 154-160.
[9] Karrou M, Maranville J W. Response of wheat cultivars to different soil nitrogen and moisture regimes.I: Dry matter partitioning and root growth[J]. J. Plant Nutr., 1994, 17: 724-744.
[10] 张凤翔, 周明耀, 徐华平, 郭凯泉. 水肥耦合对冬小麦生长和产量的影响[J]. 水利与建筑工程学报, 2005, 3(2): 22-24.
Zhang F X, Zhou M Y, Xu H P, Guo K Q . Effects of water and fertilizer coupling on growing and yield of winter wheat[J]. J. Water Res. Arch. Eng., 2005, 3(2): 22-24.
[11] 于立忠, 丁国泉, 史建伟, 等. 施肥对日本落叶松人工林细根直径、 根长和比根长的影响[J]. 应用生态学报, 2007, 18(5): 957-962.
Yu L Z, Ding G Q, Shi J Wetal. Effects of fertilization on fine root diameter, root length and specific root length in Larix kaempferi plantation[J]. Chin. J. Appl. Ecol., 2007, 18(5): 957-962.
[12] 腊贵晓, 方萍, 滕一波, 等.氮素水平对芥蓝生长及芥子油苷含量的影响[J]. 植物营养与肥料学报, 2009, 15(2): 429-434.
La G X, Fang P, Teng Y Betal. Effect of nitrogen level on growth and glucosinolates content of Chinese kale[J]. Plant Nutr. Fert. Sci., 2009, 15(2): 429-434.
[13] Robinson D. The responses of plants to non-uniform supplies of nutrient[J]. New Phytol., 1994, 127(4): 635-674.
[14] Winter K, Schramm M J. Analysis of stomatal and non-stomatal components in the environmental control of CO2exchanges in leaves ofWelwitschiamirabilis[J]. Plant Physiol., 1986, 82: 173-178.
[15] Farquhar G D, Sharkey T D. Stomatal conductance and photosynthesis[J]. Ann. Rev. Plant Physiol., 1982, 33: 317-345.
[16] 晏枫霞, 王康才, 罗庆云, 罗春红. 氮素形态对菘蓝氮代谢、 光合作用及生长的影响[J]. 中国中药杂志, 2009, 34(16): 2039-2042.

[17] 沈玉芳, 李世清, 邵明安. 水肥空间组合对冬小麦生物学性状及生物量的影响[J]. 中国农业科学, 2007, 40(8): 1822-1829.
Sheng Y F, Li S Q, Shao M A. Effects of water and fertilizer spatial coupling on biological characteristics and biomass of winter wheat[J]. Sci. Agric. Sin., 2007, 40(8): 1822-1829.
[18] Dai J Y, E Y J, Gu W L. Studies on the relationship between root growth and yield in maize Ⅱ. The interaction of root system and leaves of maize and its relation with yield[J]. Acta Agron. Sin., 1988, 14(4): 310-314.
[19] 张恩和, 胡华. 小麦玉米常用根系竞争和补偿效应研究[J]. 甘肃农业大学学报, 1997, 32(4): 295- 299.
Zhang E H, Hu H. Studies on competition and compensation of the roots between spring wheat and spring corn under intercropping[J]. J. Gansu Agric. Univ., 1997, 32(4): 295- 299.
[20] Shinano T, Osaki M, Yamada S, Tadano T. Comparison of root growth and nitrogen absorbing ability between gramineae and leguminosae during the vegetative stage[J]. Soil Sci. Plant Nutr., 1994, 40(3): 485-495.
[21] Varndermeer J. The Ecology of Intercropping[M]. Cambridge: Cambridge University Press, 1989.
[22] Casper B B, Jackson R B. Plant competition underground[J]. Ann. Rev. Ecol. Syst., 1997, 28: 545-570.
[23] Schenk H J. Root competition: beyond resource depletion[J]. J. Ecol., 2006, 94(4): 725-739.
[24] Craine J M. Competition for nutrients and optimal root allocation[J]. Plant Soil, 2006, 285(1/2): 171-185.
[25] Fransen B, Blijjenberg J, De Kroon H. Root morphological and physiological plasticity of perennial grass species and the exploitation of spatial and temporal heterogeneous nutrient patches[J]. Plant Soil, 1999, 211(2): 179-189.
[26] Robinson D. Resource capture by localized root proliferation: why do plants bother[J]. Annals of Botany, 1996, 77(2): 179- 185.
[27] Robinson D, Hodge A, Griffiths B Setal. Plant root proliferation in nitrogen-rich patches confers competitive advantage[M]. Proc.Royal Soc.Series: Biol. Sci., 1999, 266(1418): 431-435.
[28] 闫秀峰, 王洋, 李一蒙.植物次生代谢及其与环境的关系[J].生态学报, 2007, 27(6): 2554-2561.
Yan X F, Wang Y, Li Y M. Plant secondary metabolism and its response to environment[J]. Acta Ecol. Sin., 2007, 27(6): 2554-2561.
[29] 张永清, 商庆新. 药用植物次生代谢与中药材GAP[J]. 世界科学技术-中医药现代化, 2005, 7(2): 57-61.
Zhang Y Q, Shang Q X. Secondary metabolism of medicinal plants and GAP of Chinese medicinal crops[J]. Modern. Trad. Chin. Medic. Mater. Med., 2005, 7(2): 57-61.
[30] 杜丽娜, 张存莉, 朱玮, 张高宏. 植物次生代谢合成途径及生物学意义[J].西北林学院学报, 2005, 20(3): 150-155.
Du L N, Zhang C L, Zhu W, Zhang G H. The synthetic way and biological significance of plant secondary metabolism[J]. J. Northwest For. Univ., 2005, 20(3): 150-155.
[31] 高丽君, 崔建华, 刘风云, 尹迎青.植物次生代谢物的应用和开发[J]. 生物学通报, 2004, 39(7): 15-17.
Gao L J, Cui J H, Liu F Y, Yi Y C. Application and development of plant secondary metabolites[J]. Bull. Biol., 2004, 39(7): 15-17.
[32] 张永乐, 付桂芹. 药用植物次生代谢工程与中草药的生产[J].中国林副特产, 2005(6): 69-70.
Zhang Y L, Fu G J. Secondary metabolic engineering of medicinal plants and herbal medicine production[J]. Quart. Forest By-prod. Spec. Chin., 2005(6): 69-70.
[33] 苏文华, 张光飞, 李秀华, 欧晓昆. 植物药材次生代谢产物的积累与环境的关系[J]. 中草药, 2005, 36(9): 1415-1418.
Su W H, Zhang G F, Li X H, Ou X K. Relationship between accumulation of secondary metabolism in medicinal plant and environmental condition[J]. Chin. Trad. Herb. Drugs, 2005, 36(9): 1415-1418.
[34] 段传人, 王伯初, 徐世荣.环境应力对植物次生代谢产物形成的作用[J]. 重庆大学学报, 2003, 26(10): 67-71.
Duan C R, Wang B C, Xu S R. The effects of the environment stress on the plant secondary metabolites[J]. J. Chongqing Univ., 2003, 26(10): 67-71.
[35] 康建宏, 吴宏亮, 杨涓, 杨剑涛. 不同施氮水平下枸杞主要次生代谢产物与多糖的关系研究[J]. 安徽农业科学, 2008, 36(36): 16008-16010.
Kang J H, Wu H L, Yang J, Yang J T. Study on the relationship between the main secondary metabolites and polysaccharide in fruits ofLyciumbarbarumat different application amounts of nitrogen[J]. J. Anhui Agric. Sci., 2008, 36(36): 16009-16010.

