MnO2-FeS2-H2SO4 浸出体系下H+和Fe3+对MnO2 浸出的影响
冯雅丽,张旭,李浩然,蔡震雷
(1. 北京科技大学 土木与环境工程学院,北京,100083;2. 中国科学院过程工程研究所 生化工程国家重点实验室,北京,100190)
锰是一种重要的金属元素,广泛应用于钢铁、各种合金、电子材料、农牧和其他化工产品。随着锰金属需求的快速上升,大量的优质锰矿资源被快速消耗,从低品位氧化锰矿和尾矿渣中回收锰金属,越来越受到人们的广泛关注[1-2]。近年来,锰矿资源的湿法浸出,尤其是低品位氧化锰矿浸出工艺进行了深入的研究和开发[3-4]。硫酸锰是一种重要的基础锰盐,世界上大部分锰产品都可以利用硫酸锰或通过硫酸锰溶液生产出来,采用氧化锰矿制备硫酸锰是锰加工的重要内容[5-6]。MnO2是一种氧化剂,是氧化锰矿的主要成分,必须在存在还原剂的条件下,才能够溶解于硫酸,生成硫酸锰。研究表明,草酸、甲醇、二氧化硫、硫酸亚铁和有机物都可以作为浸出MnO2的还原剂[7-13]。采用黄铁矿作为还原剂浸出软锰矿具有工艺简单易行,生产成本低的特点,受到许多研究者的重视。MnO2-FeS2-H2SO4的浸出过程是个复杂的固液反应过程,过程中涉及到黄铁矿氧化与软锰矿还原浸出的关系,黄铁矿的氧化机理、软锰矿浸出机理,溶液中离子产生与变化等。同时实际生产时黄铁矿与硫酸的用量与理论研究相差很大,因此加强对黄铁矿-软锰矿浸出过程的理论研究具有重要的现实意义[4]。谭柱中等[5-6]曾对MnO2-FeS2-H2SO4的浸出过程进行过系统的研究,研究表明:浸出过程中FeS2的硫元素转化方式与MnO2浸出效率和FeS2利用率密切相关,对浸出过程中减少黄铁矿用量,提高黄铁矿利用率具有重要意义[4]。黄铁矿表面反应是MnO2-FeS2-H2SO4浸出过程重要因素,同时溶液中H+和Fe3+对黄铁矿表面反应存在重要影响。因此,本文作者对MnO2-FeS2-H2SO4的反应系统进行了研究,通过反应热力学、电化学与动力学[14]分析阐述了该系统反应过程中H+和Fe3+对MnO2浸出的影响,对黄铁矿-软锰矿浸出制备硫酸锰生产实践有一定的指导意义。
1 反应热力学研究
MnO2-FeS2-H2SO4的浸出过程反应机理一般以溶液中FeS2-H2O 与MnO2-H2O 的Eh-pH 图为理论基础,反应中溶液主要有MnO2,FeS2,Fe3+,Fe2+,H+等。图1 所示为FeS2-H2O 与MnO2-H2O 的Eh-pH 图的叠加图(其中c(Fe)=0.01 mol/L;c(Mn)=0.1 mol/L;c(S)=0.1 mol/L)。MnO2-FeS2-H2SO4反应过程中主要总反应有:
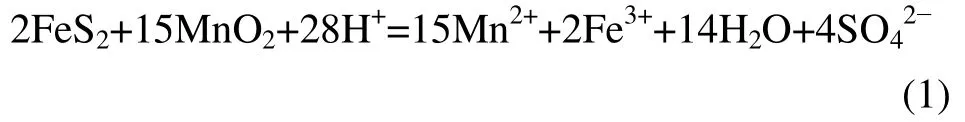
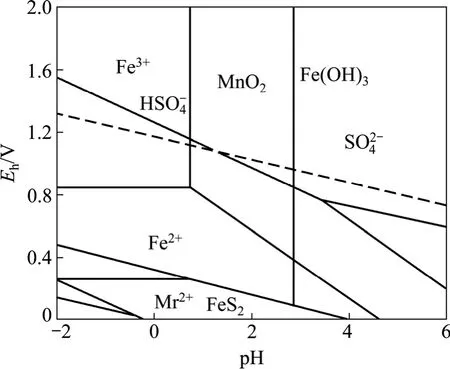
图1 FeS2-H2O 与MnO2-H2O 的Eh-pH 图Fig.1 Eh-pH diagram of FeS2-H2O and MnO2-H2O
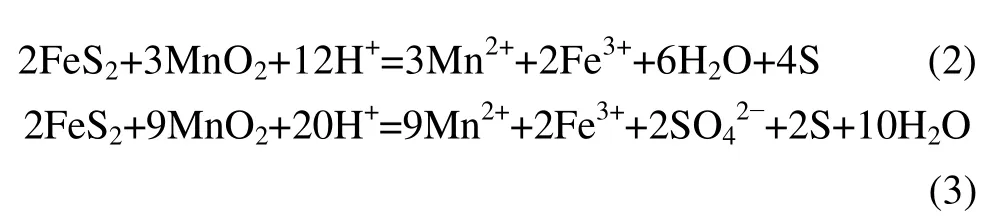
同时,过程中还存在一些分步反应:
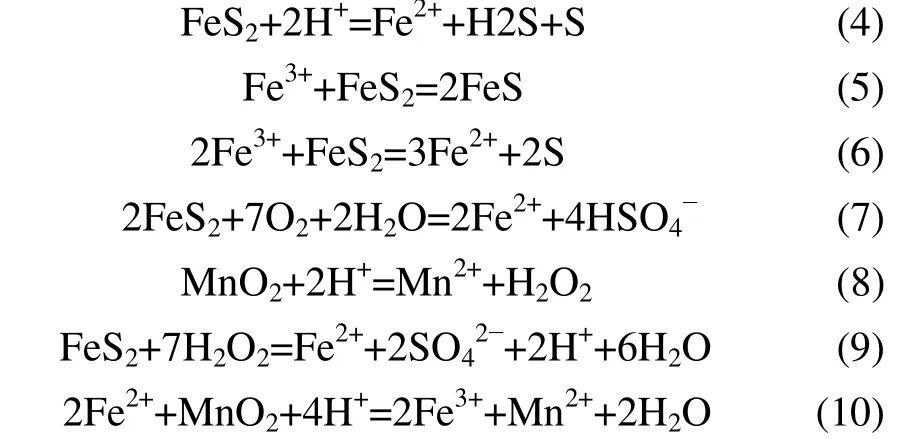
在MnO2-FeS2-H2SO4反应过程中,Fe2+与MnO2的反应十分迅速,文献[15-16]指出:常温硫酸溶液中只需15~30 min,MnO2可以浸出90%以上,所以反应中FeS2表面反应浸出Fe2+和转化过程中元素硫的转化是整个反应过程的控制步骤。同时使FeS2中元素硫尽可能生物转化成SO42-,可以提高FeS2对MnO2浸出的利用效率。针对MnO2-FeS2-H2SO4反应体系中,FeS2的反应方程(4),(6),(7)和(9)及FeS2-H2O 与MnO2-H2O的Eh-pH 叠加图,考察H+与Fe3+的作用,对MnO2-FeS2在硫酸溶液中浸出MnO2的反应过程具有重要意义。
2 结果与讨论
2.1 H+对MnO2-FeS2-H2SO4 反应过程的影响
试验过程中,采用电解MnO2(Mn 品位62.02%),分析纯浓硫酸,黄铁矿精矿(Fe40.14%,S45.80%)为原料。在电解MnO2与黄铁矿精矿配比(质量比)为10:1、矿浆质量分数为1%、搅拌速度为1 200 r/min 和温度为90 ℃(±1 ℃)的反应条件下,考察了矿浆中硫酸浓度对MnO2-FeS2-H2SO4反应过程的影响,矿浆中硫酸浓度分别为1.2,1.0,0.8,0.6 和0.4 mol/L。试验过程中对Mn2+的质量浓度、Fe3+的浓度和Fe2+的质量浓度进行了监测,结果如图2 和图3 所示。
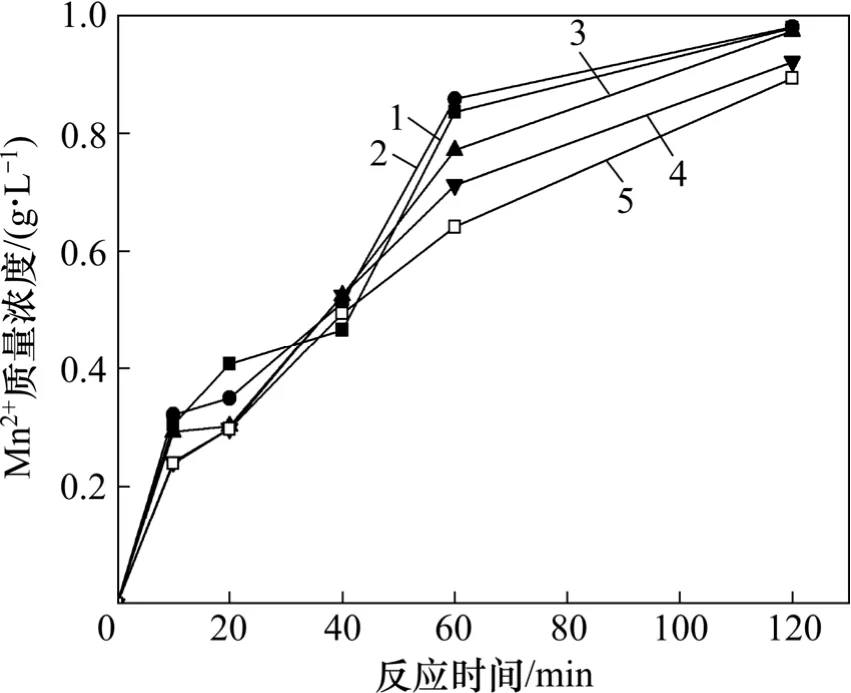
图2 MnO2-FeS2-H2SO4 体系中不同浓度硫酸对Mn2+浸出的影响Fig.2 Effects of different concentrations of H2SO4 on leaching of manganese in MnO2-FeS2-H2SO4 system

图3 MnO2-FeS2-H2SO4 体系下不同浓度硫酸时反应过程中Fe2+和Fe3+的变化Fig.3 Variations of Fe2+ and Fe3+ under different concentrations of H2SO4 in MnO2-FeS2 system
由图2 可以看出:硫酸浓度与MnO2浸出率和浸出速率存在密切关系。在硫酸浓度低于1 mol/L 时,MnO2的浸出率随硫酸浓度的上升而缓慢上升,但当硫酸浓度达到1.2 mol/L 时,MnO2的浸出率不再随硫酸浓度上升,甚至存在略微下降。同时硫酸浓度还影响着MnO2的浸出速率,由图2 可以看出:在反应初期硫酸浓度高时,MnO2的浸出速率与硫酸浓度成正比关系,而在反应后期MnO2的浸出速率与硫酸浓度却成反比关系。对比1.0,0.8,0.6 和0.4 mol/L 的硫酸浓度下Fe3+质量浓度的变化,发现反应过程中Fe3+的浸出率和浸出速率都与硫酸浓度呈正比关系,硫酸浓度在1.2 mol/L 时,在反应20~40 min 之间,Fe3+质量浓度基本没有变化。同时溶液中Fe2+质量浓度很小,一直都低于0.01 g/L。所以如果以Fe3+浸出率变化来计算FeS2的利用效率的话,在反应后期,硫酸浓度低的,反而有利于FeS2高效利用。
2.2 Fe3+对MnO2-FeS2-H2SO4 反应过程的影响
在电解MnO2与黄铁矿精矿配比(质量比)为10:1、矿浆质量分数为1%、温度为90 ℃(±1 ℃)和硫酸浓度为1 mol/L 的条件下,考察矿浆中Fe3+质量浓度对MnO2-FeS2- H2SO4反应过程的影响,矿浆中Fe3+质量浓度分别为0,1,4 和8 g/L。不同质量浓度Fe3+对MnO2-FeS2- H2SO4反应浸出MnO2的影响如图4 所示。由图4 可见:Mn2+的浸出率随溶液中添加Fe3+质量浓度的升高而上升;通过反应中不同时间段Mn2+增长曲线斜率,Mn2+的浸出速率随反应时间延长逐渐降低,且溶液中Fe3+质量浓度越高,其最初反应时间段内的反应速率越高,随着反应时间的延长,Fe3+质量浓度为1,4 和8 g/L 时,Mn2+的浸出速率趋向于一致。
2.3 Fe3+催化MnO2-FeS2 反应过程电化学研究
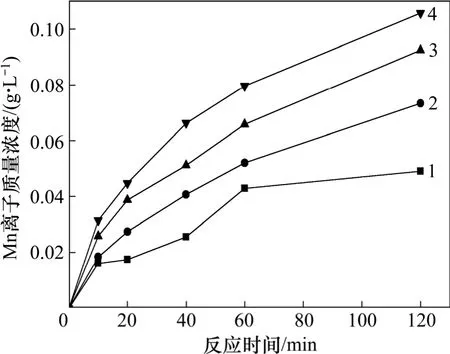
图4 不同质量浓度Fe3+对MnO2-FeS2-H2SO4 反应浸出MnO2 的影响Fig.4 Effects of different mass concentrations of Fe3+ on leaching of MnO2 in MnO2-FeS2-H2SO4 system
使用反应过程中使用的黄铁矿精矿与电解MnO2分别与异丙醇、全氟磺酸离子交换溶液(黏合剂)与蒸馏水混合后,在玻炭电极上进行涂抹混合物作为工作电极,以玻炭电极为对电极和甘汞电极为参比电极对不同Fe3+质量浓度的1 mol/L 硫酸溶液,进行了电化学研究,循环伏安法电化学结果如图5 和6 所示。
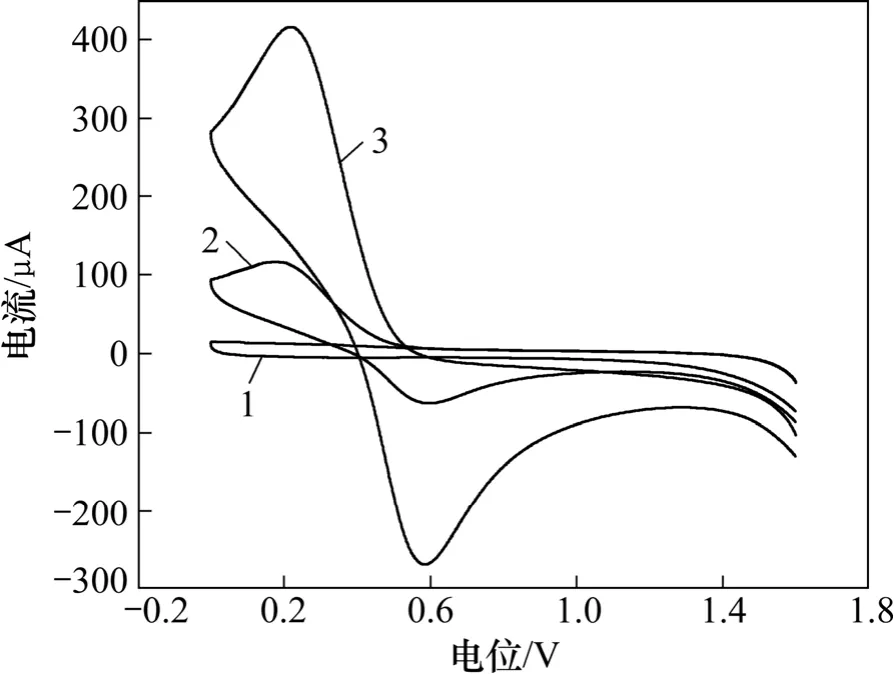
图5 FeS2 在溶液中循环伏安曲线Fig.5 Cyclic voltammetry curves of FeS2 in solution
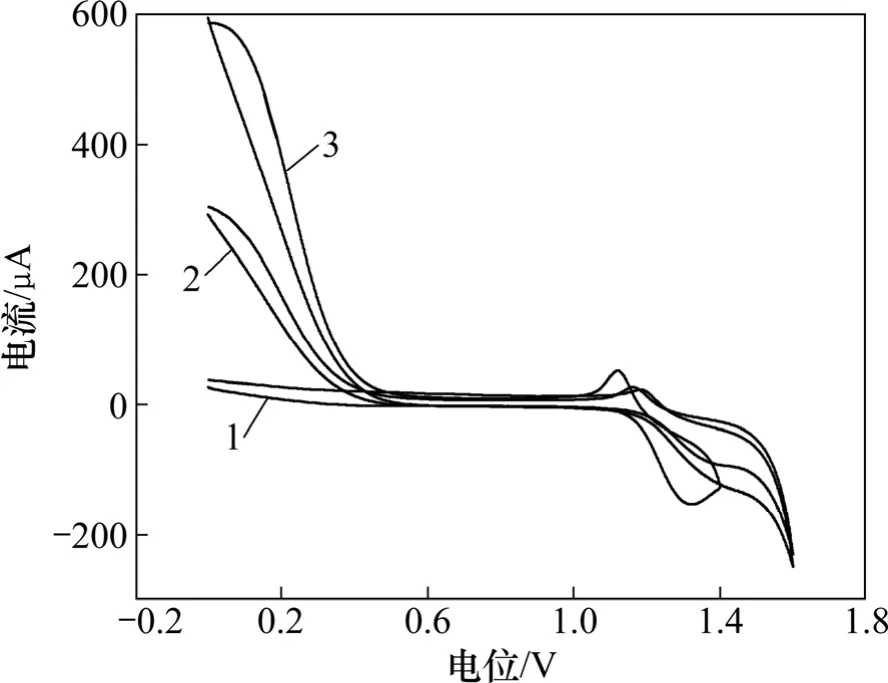
图6 MnO2 在溶液中循环伏安曲线Fig.6 Cyclic voltammetry curves of MnO2 in solution
由图5 和6 可以看出:Fe3+对溶液导电性与FeS2表面反应有巨大的影响,随Fe3+质量浓度的上升,FeS2表面更容易发生氧化反应[17-19]。当溶液中Fe3+质量浓度达到4 g/L 时,FeS2出现2 个新的氧化峰,结合FeS2-MnO2-H2O 的Eh-pH 图,在氧化峰0.58 V(甘汞电极为参比电极)时,反应为:2Fe3++FeS2=3Fe2++2S;在氧化峰电位为1.0 V(甘汞电极为参比电极)时,反应为:2FeS2+7O2+2H2O=2Fe2++4HSO4-。同时随Fe3+质量浓度的上升,在MnO2表面出现更加明显的还原峰,说明Fe3+对MnO2氧化有一定的催化作用[20-21]。
2.4 Fe3+催化MnO2-FeS2 反应浸出Mn2+过程动力学分析
根据不同Fe3+质量浓度下Mn2+质量浓度的变化和反应方程式(1)计算浸出率,时间与浸出率关系如图7所示;MnO2-FeS2反应浸出Mn2+过程动力学模型如图8所示(α为MnO2浸出率)。由图7和8可以看出:1-2/3α-(1-α)1/3与时间关系是符合的很好的(各线相关系数均在99%以上)。说明不同Fe3+质量浓度下MnO2-FeS2-H2SO4反应过程中符合产生固体反应物的固-液反应动力学,且由溶液中FeS2-H2O与MnO2-H2O的Eh-pH 图看出,反应条件下MnO2反应均为可溶物质(主要为Fe2+与MnO2的反应),不存在固体反应产物,而FeS2反应过程中可能存在反应方程(6),(7)和(9)等方式,所以,MnO2-FeS2-H2SO4浸出过程主要受FeS2表面反应及反应产物控制。反应模型如图9 所示。
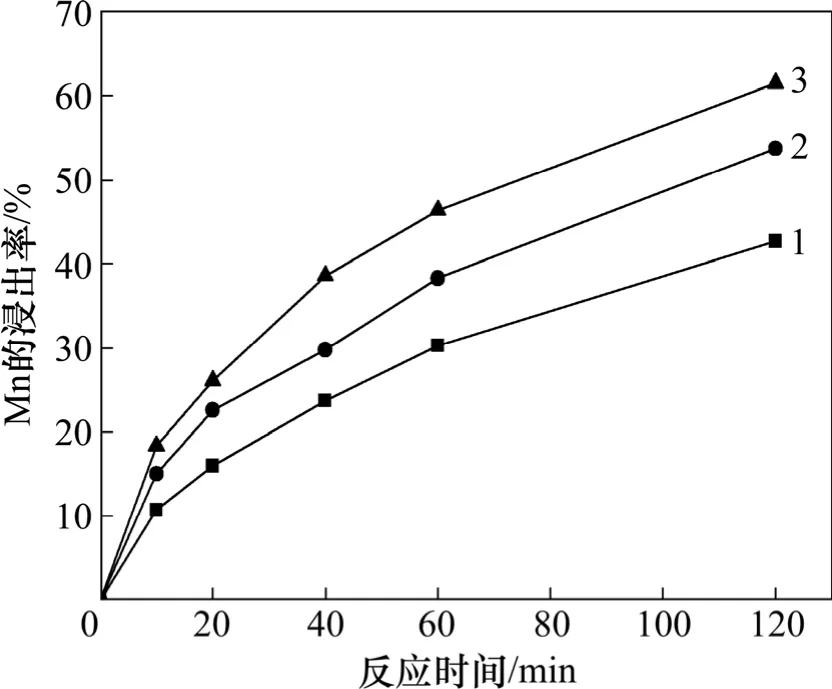
图7 不同Fe3+质量浓度下MnO2-FeS2-H2SO4 反应浸出MnO2 的速率Fig.7 Mn2+ leaching rates under different mass concentrations of Fe3+ in MnO2-FeS2-H2SO4 system

图8 MnO2-FeS2-H2SO4 反应浸出MnO2 过程中1-2/3α-(1-α)1/3 与时间关系Fig.8 1-2/3α- (1-α)1/3 relationships with time in process of leaching Mn2+ in MnO2-FeS2-H2SO4 system
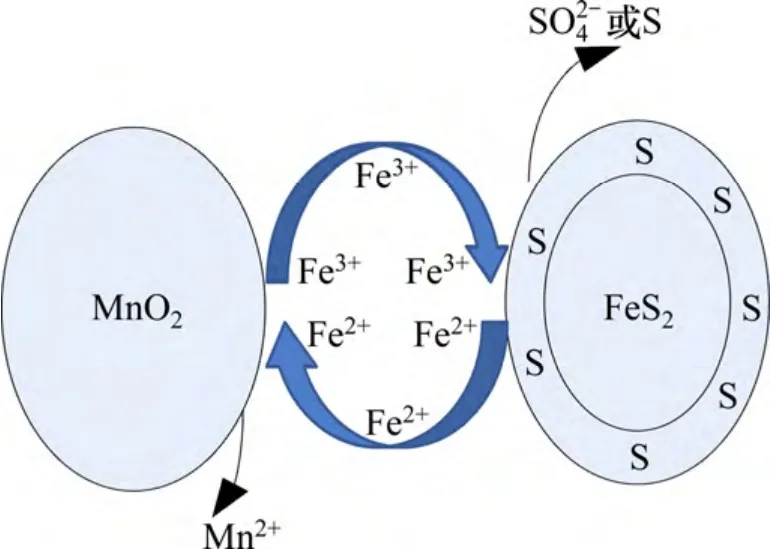
图9 MnO2-FeS2 系反应模型Fig.9 Reaction model of MnO2-FeS2 system
因此,MnO2-FeS2-H2SO4反应浸出MnO2过程主要分为4 个步骤:
1) Fe3+通过产物膜扩散到FeS2反应核表面。
2) Fe3+与FeS2反应核发生反应,生成Fe2+,SO42-和S。
3) Fe2+扩散至MnO2反应表面发生反应,生成Fe3+与Mn2+。
4) Fe3+溶液扩散至FeS2产物膜表面,进行步骤1)并在FeS2与MnO2进行循环。
3 结论
1) 在一定反应条件下,当硫酸浓度较低时, Mn2+浸出率随硫酸浓度的上升而上升,但当硫酸浓度超过1.0 mol/L 时,Mn2+浸出率不在上升且略微有些下降。同时通过对比不同时间段的Mn2+浸出速率与Fe3+的浸出速率,得出硫酸浓度越低,在反应的后期,FeS2的利用率越高。
2) Fe3+对MnO2-FeS2-H2SO4反应浸出MnO2有一定的催化作用,尤其是反应初期,溶液中Fe3+质量浓度越高,其反应速率越高,而到反应后期Mn2+的浸出速率去向一致,说明Fe3+失去了对反应过程的催化作用。
3) 通过FeS2-MnO2-H2O 的Eh-pH 图、Fe3+催化MnO2-FeS2-H2SO4反应电化学分析和 Fe3+催化MnO2-FeS2-H2SO4反应浸出MnO2过程动力学分析,表明MnO2-FeS2-H2SO4反应初期, Fe3+促进了FeS2表面的化学反应,FeS2表面反应存在S 与SO42-2 种方式,随着FeS2反应产物S 固化层的产生,Fe3+催化MnO2-FeS2-H2SO4的反应过程受到FeS2反应产物S 固化层扩散控制。
[1] Nayl A A, Ismail I M, Aly H F. Recovery of pure MnSO4·H2O by reductive leaching of manganese from pyrolusite ore by sulfuric acid and hydrogen peroxide[J]. International Journal of Mineral Processing, 2011, 100: 116-123.
[2] Hazek E, Lasheen M N, Helal T A, et al. Reductive leaching of manganese from low grade Sinai ore in HCl using H2O2as reductant[J]. Hydrometallurgy, 2006, 84: 187-191.
[3] Pettersson F, Biswas A, Sen P K, et al, et al. Analyzing leaching data for low-grade manganese ore using neuralnets and multiobjective genetic algorithms[J]. Materials and Manufacturing Processes, 2009, 24(3): 320-330.
[4] 杨娟, 胡波. 锰矿还原技术[J]. 中国锰业, 2011, 29(1): 40-43.YANG Juan, HU Bo. On reduction technology of Mn-ore[J].China’s Manganese Industry, 2011, 29(1): 40-43.
[5] 谭柱中, 梅光贵, 李维健, 等. 锰冶金学[M]. 长沙: 中南大学出版社, 2004: 1-2.TAN Zhuzhong, MEI Guanggui, LI Weijian, et al. Metallurgy of manganese[M]. Changsha: Center South University Press, 2004:1-2.
[6] 袁明亮, 梅贤功, 陈荩, 等. 两矿法浸出软锰矿的工艺与理论[J]. 中南工业大学学报(自然科学版), 1997, 28(4): 329-332.YUAN Mingliang, MEI Xiangong, CHEN Jin, et al. Technique and theory of two ore method to leach manganese dioxide ore[J].Journal of Central South University of Technology (Science and Technology), 1997, 28(4): 329-332.
[7] Guven A, Hurman E. Kinetics of the solid-state carbothermic reduction of wessel manganese ore[J]. Metallurgical and Material Transaction B, 1995, 26B: 13-24.
[8] Momade F W Y, Momade Z G. A study of the kinetics of reductive leaching of manganese oxide ore in aqueous methanol-sulphuric acid medium[J]. Hydrometallurgy, 1999, 54:25-39.
[9] Trifoni M, Veglio F, Taglieri G, et al. Acid leaching process by using glucose as reducing agent: a comparison among the efficiency of different kinds of manganiferous ores[J]. Mineral Engineering, 2000, 13(2): 217-221.
[10] Sahoo R N, Naik P K, Das S C. Leaching of manganese from low-grade manganese ore using oxalic acid as reductant in sulphuric acid solution[J]. Hydrometallurgy, 2001, 62: 157-163.
[11] CHENG Zhuo, ZHU Guocai, ZHAO Yuna. Study in reduction-roast leaching manganese from low-grade manganese dioxide ores using cornstalk as reductant[J]. Hydrometallurgy,2009, 96: 176-179.
[12] 杨志超, 冯雅丽, 李浩然, 等. 锰方解石的盐酸浸出及四氧化三锰的制备[J]. 中南大学学报(自然科学版), 2013, 44(1):25-31.YANG Zhichao, FENG Yali, LI Haoran, et al. Hydrochloric acid leaching of manganocalcite and preparation of manganese tetraoxide[J]. Journal of Central South University (Science and Technology), 2013, 44(1): 25-31.
[13] Cai Z, Feng Y, Li H, et al. Co-recovery of manganese from low-grade pyrolusite and vanadium from stone coal using fluidized roasting coupling technology[J]. Hydrometallurgy,2013, 131: 40-45.
[14] KUAN Wenhui, CHAN Yenchuan. pH-dependent mechanisms of methylene blue reacting with tunneled manganese oxide pyrolusite[J]. Journal of Hazardous Materials, 2012, 239:152-159.
[15] Bafghi M S, Zakeri A, Ghasemi Z, et al. Reductive dissolution of manganese ore in sulfuric acid in the presence of iron metal[J].Hydrometallurgy, 2008, 90: 207-212.
[16] Zakeri A, Bafghi M S, Shahriari S. Dissolution kinetics of manganese dioxide ore in sulfuric acid in the presence of ferrous ion[J]. Iranian Journal of Materials Science & Engineering, 2007,4: 3-4.
[17] Chabre Y, Pannetier J. Structural and electrochemical properties of the proton/γ-MnO2system[J]. Progress in Solid State Chemistry, 1995, 23(1): 1-130.
[18] Chandra A P, Gerson A R. The mechanisms of pyrite oxidation and leaching: a fundamental perspective[J]. Surface Science Reports, 2010, 65(9): 293-315.
[19] Long H, Dixon D G. Pressure oxidation of pyrite in sulfuric acid media: a kinetic study[J]. Hydrometallurgy, 2004, 73(3):335-349.
[20] 冯雅丽, 张旭, 李浩然, 等. FeS2-MnO2-H2SO4浸出软锰矿反应[J]. 东北大学学报(自然科学版), 2014, 35(2): 241-244.FENG Yali, ZHANG Xu, LI Haoran, et al. Pyrolusite Leaching reactions in FeS2-MnO2-H2SO4system[J]. Journal of Northeastern University (Natural Science), 2014, 35(2):241-244.
[21] Zhang Y, You Z, Li G, et al. Manganese extraction by sulfur-based reduction roasting–acid leaching from low-grade manganese oxide ores[J]. Hydrometallurgy, 2013, 133: 126-132.

