诺斯卡品逆转人卵巢癌裸鼠移植瘤对顺铂耐药的作用及机制
申薇 梁冰锋 李秀荣 程建新 李红方
肿瘤多药耐药逆转的研究对临床化疗疗效的提高具有重要意义。但目前仍未发现高效、低毒的耐药逆转剂。诺斯卡品(Noscapine,NOS)是一种无毒苄基异喹啉类生物碱,一直以来作为镇咳药使用[1]。研究证实,NOS在肿瘤细胞和动物肿瘤模型的实验研究中均表现出良好的抗肿瘤活性,并且该药物对肿瘤细胞有耐药逆转作用,能逆转OVCAR3细胞对长春新碱和多柔比星的敏感性[2,3],但未见在卵巢癌的研究中报道。本文利用人卵巢癌SKOV3/DDP细胞裸鼠皮下移植瘤模型,研究低剂量NOS与顺铂(cisplatin,DDP)联合应用对移植瘤细胞增殖、凋亡及X链锁凋亡抑制蛋白(X-linked inhibitor-of-apoptosis Protein,XIAP)、半胱氨酸天冬氨酸蛋白酶-3(cysteine-aspartic acid Protease-3,Caspase-3)、B细胞淋巴瘤/白血病-2(Bell rymphoma/lewkmia-2,Bcl-2)和生存素(Survivin)表达的影响,并探讨其可能机制。
1 材料与方法
1.1 材料
1.1.1 细胞培养:卵巢上皮性肿瘤细胞系SKOV3/DDP由河北医科大学第四医院科研中心提供。细胞于37℃、5%CO2培养箱内,以含10%胎牛血清的RPMI-1640培养液在培养瓶内单层传代培养,取对数生长期细胞进行实验。
1.1.2 实验裸鼠:BALB/c nu/nu裸小鼠购自中国人民解放军军事医学科学院动物实验中心,3~4周龄,均为雌性,体重18~22 g,合格证号:SCXK(军)2007-004。动物饲养于河北医科大学第四医院动物实验中心,室温控制在(25±1)℃,相对湿度为40%~60%的SPF层流罩中。室内进行定期紫外线照射,自由摄入无菌的标准饲料和无菌水。
1.1.3 主要试剂:NOS购自美国SIGMA公司,DDP购买自山东齐鲁制药厂,PBS缓冲液、RPMI-1640培养液购自美国Gibco公司,胎牛血清购自杭州四季青公,二甲基亚砜(DMSO)购自天津化学试剂。兔抗人Bcl-2和XIAP多克隆抗体购自bioworld公司,鼠抗人Survivn和Caspase-3单克隆抗体购自北京中杉金桥公司。
1.2 方法
1.2.1 药物配制:NOS溶解于DMSO,以80 mmol/L为储存浓度,保存于-80℃。不同浓度的NOS及DDP作用于含10%胎牛血清RPMIl640培养基培养的SKOV3/DDP细胞。DMSO的终浓度小于0.1%。DDP溶解于0.9%氯化钠溶液,以2 mg/ml为储存浓度,保存于4℃,按实验需要用培养基稀释至所需浓度。
1.2.2 裸鼠移植瘤模型的建立、实验分组及药物干预治疗:取对数生长期SKOV3/DDP细胞,调整细胞密度为3×107/ml。将单细胞悬液注入裸鼠右肩胛部皮下,200 μl/只。接种后第2周,待右肩胛部皮下肿瘤生长至直径约5 mm,将裸鼠随机分成4组,每组6只。对照组,腹腔注射0.9%氯化钠溶液;NOS组,腹腔注射NOS 40 mg/kg;DDP组,腹腔注射DDP 3 mg/kg;NOS联合DDP组,腹腔注射NOS 40 mg/kg后6 h,再腹腔注射DDP 3 mg/kg。每次注射液量均为0.2 ml,3 d给药1次,共注射7次。结束治疗后第3天脱颈处死裸鼠,摘除裸鼠移植瘤组织,秤重并测量移植瘤长(a)、宽(b),按V(cm3)=ab2/2计算肿瘤体积,绘制肿瘤生长曲线,并计算抑瘤率。抑瘤率=(对照组平均重量 -实验组平均重量)/对照组平均重量 ×100%。
1.2.3 流式细胞术检测移植瘤细胞周期及凋亡率:将裸鼠移植瘤组织用70%乙醇溶液固定后,立即用网搓法制备单细胞悬液。取0.1 ml细胞悬液向其中加入DNA染液1 ml,在4℃冰箱中染色30 min,PBS缓冲液洗涤细胞2次,分别应用Muticycle AV软件和Expo ADC软件对细胞周期的时相分布和细胞凋亡情况进行分析。实验重复3次。
1.2.4 流式细胞术检测移植瘤细胞蛋白表达:取0.1 ml细胞悬液,向细胞悬液中加入XIAP、Caspase-3、Bcl-2和Survivin抗体,室温避光放置30 min后,PBS缓冲液洗涤细胞2次,上机检测死亡受体XIAP、Caspase-3、Bcl-2和Survivin蛋白表达量,以平均荧光强度表示。
1.3 统计学分析 应用SPSS 13.0统计软件,计量资料以±s表示,3组比较采用方差分析,进一步两两组间比较采用LSD法,P<0.05为差异有统计学意义。
2 结果
2.1 DDP和(或)NOS对裸鼠移植瘤生长的影响 接种SKOV3/DDP细胞后,3 d左右皮丘消平,7 d左右裸鼠皮下瘤长出,接种成功率为100%。移植瘤呈圆形或椭圆形,待瘤长至5 mm时开始用药(图1)。在整个实验过程中,用药组老鼠生长状态良好,没有出现体重明显下降等现象,无裸鼠死亡。给药前,各实验组平均肿瘤体积差异无统计学意义(P>0.05);给药结束后,联合组裸鼠皮下移植瘤体积及重量明显小于对照组和其他用药组,差异有统计学意义(P<0.05)。4组肿瘤生长曲线见图2,4组裸鼠体重、平均瘤体积、重量见表1。
图1 人卵巢癌裸鼠皮下移植瘤

图2 裸鼠皮下移植瘤生长曲线
表1 4组裸鼠体质量及移植瘤体积、体重及抑瘤率n=6,±s
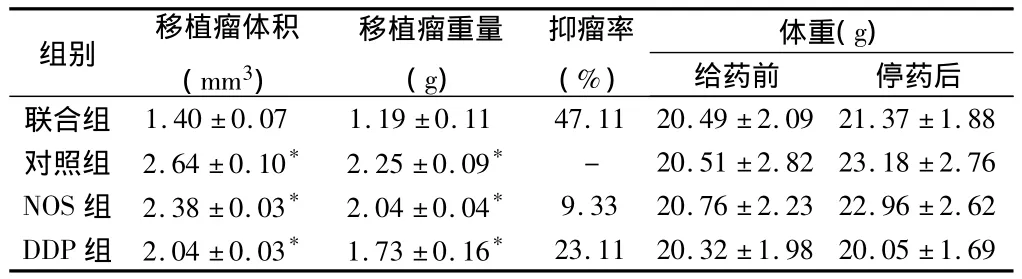
表1 4组裸鼠体质量及移植瘤体积、体重及抑瘤率n=6,±s
注:与联合组比较,*P<0.05
组别 移植瘤体积(mm3)7±1.88对照组2.64±0.10*2.25±0.09*-20.51±2.8223.18±2.76 NOS组2.38±0.03*2.04±0.04*9.3320.76±2.2322.96±2.62 DDP组2.04±0.03*1.73±0.16*体重(g)给药前 停药后联合组1.40±0.071.19±0.1147.1120.49±2.0921.3移植瘤重量(g)抑瘤率(%)23.1120.32±1.9820.05±1.69
2.2 移植瘤细胞凋亡率 与对照组比较,NOS组细胞凋亡率差异无统计学意义(P>0.05)。与DDP组和NOS组比较,联合组细胞凋亡率显著增高(P<0.05)。见图3,表2。
2.3 移植瘤细胞周期分布 与对照组相比,DDP组细胞G0/G1期细胞比例减少,S期细胞比例增高,差异有统计学意义(P<0.05)。NOS组和联合组细胞G2/M期比例增加,与对照组和DDP组相比差异有统计学意义(P<0.05)。见表2。

图3 裸鼠移植瘤细胞凋亡率
表2 裸鼠移植瘤细胞凋亡率及细胞周期的分布n=6,%,±s

表2 裸鼠移植瘤细胞凋亡率及细胞周期的分布n=6,%,±s
注:与对照组比较,*P<0.05;与NOS组比较,#P<0.05;与DDP组比较,△P<0.05
50±431.5±4.818.1±3.011.9±0.8 NOS组47±31.3±0.952.0±2.713.1±1.0 DDP组39±3*#49.7±4.0*#10.9±3.7*#15.0±0.5联合组50±3△1.6±0.9*△48.0±1.9#*△21.0±0.7*#△细胞凋亡率对照组组别 细胞周期G0/G1期S期G2/M期
2.4 移植瘤细胞XIAP、Caspase-3、Bcl-2和Survivin蛋白表达 与对照组比较,NOS组细胞中Survivin、XIAP、Bcl-2蛋白的表达量下降,Caspase-3蛋白表达量增高,差异有统计学意义(P<0.05),但DDP组XIAP、Caspase-3、Bcl-2和Survivin蛋白表达量差异无统计学意义(P>0.05)。与DDP组比较,联合组细胞中Survivin、XIAP、Bcl-2蛋白的表达量下降,Caspase-3蛋白表达量增高,差异有统计学意义(P<0.05)。见表3,图4。
表3 裸鼠移植瘤细胞XIAP、Caspase-3、Bcl-2和Survivin蛋白的表达量n=6,±s
注:与对照组比较,*P<0.05;与NOS组比较,#P<0.05;与DDP组比较,△P<0.05
组别242±6127±8293±4173±6 NOS组198±4154±12234±4142±7 DDP组239±7131±6*#286±5170±6联合组200±5*△161±7*△238±4*△141±8 XIAPCaspase-3Bcl-2Survivin对照组*△
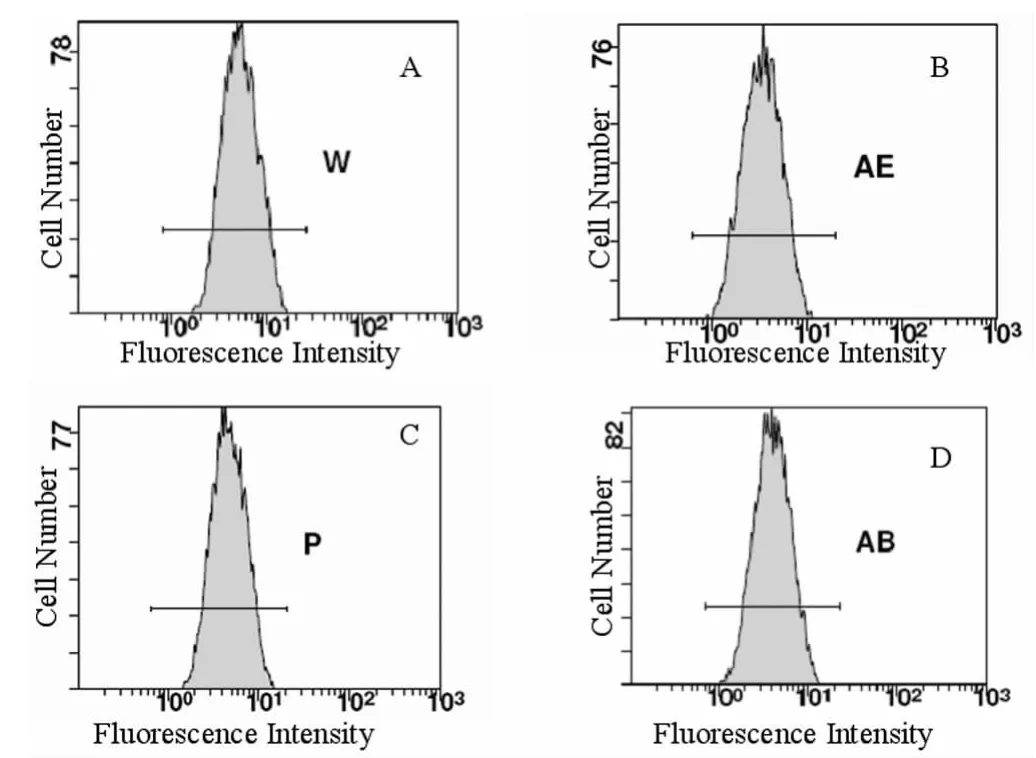
图4 裸鼠移植瘤细胞XIAP蛋白表达量
3 讨论
卵巢癌是目前世界范围较常发的恶性肿瘤之一,发病及病死率高[4]。对于卵巢癌的治疗,除采用手术治疗外,采用DDP、紫杉醇等为主的联合化疗的辅助治疗是目前治疗的主要手段。但肿瘤的多药耐药性降低了肿瘤细胞对化疗药物的敏感性,甚至造成化疗的失败[5]。研究发现,NOS具有抗肿瘤作用,可通过抑制微管动态不稳定性、干扰肿瘤细胞有丝分裂的方式抑制肿瘤细胞的繁殖[6],从而达到抗肿瘤的作用。NOS可以抑制非小细胞肺癌、神经胶质细胞瘤、黑色素瘤、乳腺癌等多种癌细胞的增殖,另外对一些紫杉醇耐药癌细胞也有较好的抑制作用。其作用机制目前还不清楚,可能包括抑制G2/M期有丝分裂及激活c-JNK、p21参与、NF-κB信号通路调节、caspase级联反应、Bcl-2/Bax下调等途径,实现对癌细胞的增殖抑制,从而达到抗肿瘤的作用[7-10],动物试验表明,采用口服、注射等不同的给药方式,对心、胸腺、十二指肠、肾、血液和骨髓等器官或组织没有明显的不良反应,且与联合药品不产生交叉耐药[11,12]。本研究将卵巢癌耐药细胞SKOV3/DDP接种裸鼠,形成皮下移植瘤。在实验中裸鼠未出现严重的不良反应,未表现出进食少、皮肤干涩、体重下降、精神萎靡等症状。结果表明,DDP与NOS联合组移植瘤重量和体积明显低于DDP组和NOS组(P<0.05),同时NOS改变了移植瘤细胞周期的分布,增加了DDP对移植瘤细胞的杀伤作用,提高了移植瘤细胞对DDP的敏感性。提示NOS能逆转SKOV3/DDP细胞裸鼠移植瘤对DDP的耐药。
耐药相关机制很多,其中耐药蛋白的异常表达是重要因素之一。XIAP、Caspase-3、Bcl-2和Survivin蛋白是细胞凋亡途径的重要调节因子,研究发现四种蛋白在食管癌、乳癌、前列腺癌、卵巢癌等多种恶性肿瘤细胞中表达异常,并且参与了肿瘤多药耐药性的产生,在恶性肿瘤的发生发展中起了至关重要的作用[13-16]。本实验还进一步研究证实NOS可显著降低Survivin、XIAP、Bcl-2蛋白表达,增高Caspase-3蛋白表达。这些结果提示NOS逆转SKOV3/DDP细胞移植瘤耐药作用与XIAP、Caspase-3、Bcl-2和Survivin相关。
总之,NOS增加了SKOV3/DDP细胞移植瘤细胞对DDP的敏感性,逆转其对DDP的多药耐药。但NOS的耐药逆转机制是否还有其他参与因素还有待今后的进一步研究证实,本实验结果为改善卵巢癌治疗效果,寻求新的临床治疗方案提供了实验基础。
1 Ye K,Ke Y,Keshava N,et al.Opium alkaloid noscapine is an antiturnor agent that arrests metaphase and induces apoptosis in dividing cells.Proc Natl Acad Sci USA,1998,95:1601-1606.
2 Ke Y,Ye K,Grossniklaus He,et al.Noscapine inhibits tumor growth with little toxicity to normal tissues or inhibition of immune responses.Cancer Immunol Immunother,2000,49:217-225.
3 Mahmoudian M,Rahimi-Moghaddam P.The anticancer activity of noscapine.Recent Patents Anti cancer Drug Discovery,2009,4:92-97.
4 Siegel R,Ward E,Brawley O,et al.The impact of eliminating socioeconomic and racial disparities on premature cancer deaths.CA Cancer J Clin,2011,61:212-236.
5 田芬,段爱红,卢静.复发卵巢癌的化疗效果研究.河北医药,2009,31:448-449.
6 Zhou J,Panda D,Landen JW,et a1.Minor alteration of microtubule dynamics causes loss of tension across kinetochore pairs and activates the spindle checkpoint.J Biol Chem,2002,277:17200-17208.
7 Zhou J,Gupta K,Yao J,et al.Paclitaxel-resistant human ovarial cancer cells undergo c-Jun NH2-terminal kinase-mediated apoptosis in response to noscapine.J Biol Chem,2002,277:39777-39785.
8 Aneja R,Ghaleb AM,Zhou J,et al.P53 and p21 determine the sensitivity of noscapine-induced apoptosis in colon cancer cells.Cancer Res,2007,67:3862-3870.
9 苏文敬,黄磊,敖启林,等.那可丁对宫颈癌Hela细胞的抑制作用及机制探讨.华中科技大学学报(医学版),2011,40:287-290.
10 Mahavir Chougule,Apurva R.Patel,pratik sachdeva anticancer activity of noscapine,an opioid alkaloid in combination with cisplatin in human non-small cell lung cancer.Lung Cancer,2011,71:271-282.
11 魏少荫,李敏.微管抑制剂那可丁及其衍生物的抗肿瘤作用研究进展.中国新药杂志,2006,15:1238-1242.
12 郝亚伟,陶惠民.微管抑制剂诺斯卡品抗肿瘤作用研究进展.国际骨科学杂志,2010,37:2569-2573.
13 Lee JW,Cho MK.Phenethy is othiocyanate induced apoptosis via down regulat-ion of Bcl-2/XIAP and triggering of the mitoch ondrial pathway in MCF-7 cells.Arch Pharm Res,2008,31:1604-1612.
14 丁坚,蔡军.P53、XIAP与细胞凋亡的关系及其靶向的细胞凋亡在肿瘤治疗中的研究进展.实用临床医学,2013,14:127-130.
15 英焕春,吕靖,张淑兰.凋亡相关基因及蛋白的表达与人卵巢癌细胞顺铂耐药的关系.中国现代医学杂志,2007,17:820-824.
16 李佳平,周洪贵,唐良萏,等.Bcl2基因基因家族相关蛋白在人卵巢癌耐药细胞凋亡中的作用.肿瘤学杂志,2008,14:118-121.

