嗜热链球菌为模板制备银微米球及其电化学性能
冯莉莉,白 阳,玄哲文,苏长伟,郭俊明
(1.云南民族大学 云南省生物高分子功能材料工程技术研究中心,云南 昆明 650500;2.云南民族大学 民族药资源化学国家民委-教育部重点实验室,云南 昆明 650500)
贵金属纳米颗粒因其独特的尺寸和形貌依赖的光学性质和催化能力成为目前研究的一个热点.其中,银作为最常用的表面增强拉曼光谱(SERS)的增强介质,引起了人们浓厚的研究兴趣.美国印第安那大学的Nie等[1]在单个银纳米粒子上,观察到高达1014~1015的SERS增强因子[1].与其他金属相比,人们一直认为银催化活性较低,但是当金与银形成合金双金属纳米结构后,能够在常温下催化CO氧化,从而在燃料电池与防止一氧化碳中毒方面具有相当大的研究开发价值[2].在分析检测方面,已经有报道利用银的SERS增强检测生物分子,如氨基酸、儿茶酚胺,甚至DNA等生物大分子[3-4].因此,银纳米颗粒的制备研究具有重要价值.目前,制备银纳米颗粒的合成法一般是在溶液中,在表面活性剂的保护下,使用还原剂,将金属前驱体还原为零价的银纳米颗粒.但是,这种传统的化学制备方法制备的银溶胶制备的重复性较差,粒度分布不均匀,并且在银纳米颗粒表面吸附一层表面活性剂,进而对SERS检测产生一定影响.
相比于传统物理化学的制备方法通过生物体系作为模板,制备纳米材料,可以得到具有特殊生物结构的纳米材料,是目前的一个研究热点[5-6].目前,利用植物提取物[7]、海藻溶液[8]以及淀粉溶液[9]等已经制备得到了金和银的纳米材料.但是这些溶液中成分较为复杂,很难鉴定具体哪种物质对纳米材料的制备起到关键作用.因此,单组分的生物材料更加有利于研究和分析生物模板法制备纳米材料的原理.蛋白、DNA、病毒、菌等都是典型的生物模板.例如:Braun等[10]通过在DNA长链上沉积银纳米微粒,成功地在2个金电极之间制备出纳米银导线.Erik等[11]以烟草花叶病毒为模板,制备了金属纳米材料[11].但是,DNA和病毒等价格较高,且需要安全方面的特殊处理.菌类生物模板具有杆状、球状、螺旋状、纺锤状、星状等多种形貌[12],可以作为模板制备多种形貌的金属纳米材料.乳酸杆菌、嗜热链球菌等是制作酸奶的原料,使用安全性相对较高,因此,适合作为生物模板制备纳米材料.目前,酵母菌[13]、大肠杆菌[14-15]、乳酸杆菌[16]等作为生物模板制备纳米材料的研究相对较多,但是嗜热链球菌用于制备银纳米颗粒的研究尚在起步阶段[17].
在本实验中以嗜热链球菌作为模板,硝酸银作为前驱体,抗坏血酸作为还原剂,制备了银微球.研究了嗜热链球菌模板和硝酸银的用量对所制备的银微球的形貌影响.并将银微球修饰在玻碳电极上,用于检测溶液中的对苯二酚.
1 实验部分
1.1 试剂
硝酸银、抗坏血酸、对苯二酚、磷酸二氢钠、磷酸氢二钠均为分析纯,购于中国国药集团上海试剂公司,在使用前未进行进一步的纯化.实验中用水电阻率为18 MΩ·cm的超纯水.实验中所用的玻璃器皿使用体积比为7∶3的硫酸和双氧水溶液煮沸30 min,以进行表面清洗.
1.2 标准菌种及来源
嗜热链球菌购买自中国工业微生物菌种保藏管理中心,菌种编号:21729. 本实验中的菌种分装于上海交通大学微纳米科学研究院生物纳米工程研究室.
1.3 菌种的培养
1.3.1 实验器具的灭菌
在菌体培养过程中需要用到的试管、移液器吸头、移液器、去离子水等置于压力灭菌锅内,在0.1 MPa,120 ℃灭菌15 min.灭菌完成后,放入超净工作台中备用.
1.3.2 培养基的制备
取蛋白胨20 g,酵母浸出粉5.0 g,明胶2.5 g,葡萄糖5 g,蔗糖5 g,乳糖5 g,吐温801.0 mL,氯化钠4.0 g,乙酸钠1.5 g,抗坏血酸0.5 g,加蒸馏水至1.0 L,调酸度至pH=6.8.然后分装到250 mL的具塞锥形瓶中,用牛皮纸封口,置于压力灭菌锅内,在0.1 MPa,120 ℃灭菌15 min.灭菌完成后,放入超净工作台中备用.
1.3.3 菌种的活化复苏
将-77 ℃冰箱内保存的菌种或者购买的菌种,在无菌超净工作台中,取少量菌种,用移液器加入到装有3 mL培养基溶液的15 mL的试管中.将试管置于恒温回旋振荡器中,在37 ℃,培养16 h,回旋振荡速率为250 r·min-1,活化复苏菌种,并以同样方法转接2~3代,以期得到活性较好的嗜热链球菌.
1.3.4 菌种的增值培养
在超净工作台中,点燃酒精灯,在灯焰10 cm范围内,取3 mL灭菌处理过的培养基溶液装入15 mL灭菌后的试管中,用100 μL的吸头蘸取少量菌种粉末,加入到培养基溶液中.将试管置于恒温回旋振荡器中,在37 ℃,培养12 h,回旋振荡速率为250 r·min-1.
1.4 银微球的制备和表征
将增值培养的嗜热链球菌稀释至光学密度(OD,270 nm)至0.6.实验前将增值培养的菌体用磷酸缓冲液(PBS溶液)清洗2遍,之后用去离子水清洗1遍.将一定量菌体置于AgNO3(100 mmol/mL)溶液中,磁力搅拌0.5 h后,加入抗坏血酸,使银离子还原为银微球(具体数量见表1~2).反应0.5 h后,将制备得到的银微球离心分离,并用去离子水清洗,得到纯净的银微球.将银微球在5 kV工作电压下,8 cm的工作距离下,采用蔡司场发射扫描电子显微镜 (FESEM, Zeiss Ultra) 观察形貌.
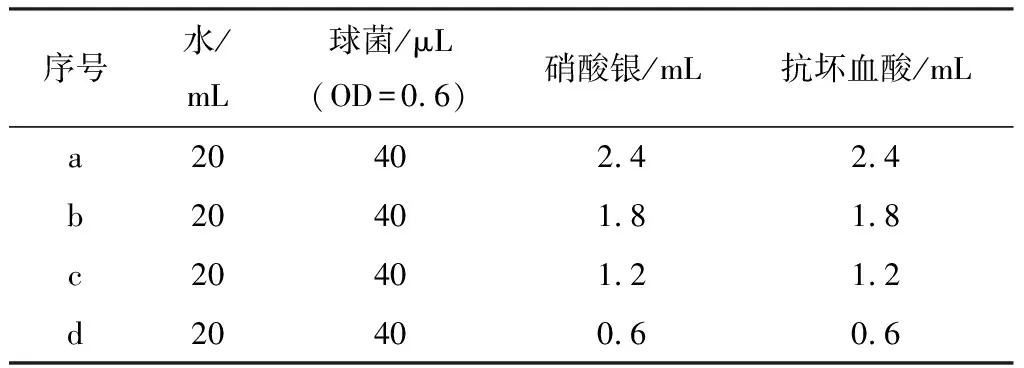
表1 不同硝酸银用量时银微球的制备条件
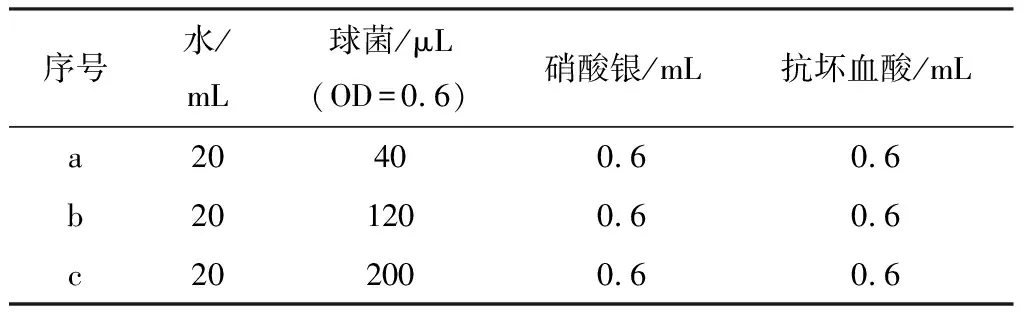
表2 不同嗜热链球菌用量时银微球的制备条件
1.5 银微球的电化学性能表征
电化学性能表征是使用循环伏安扫描测试方法,用所制备的银微球探测溶液中对苯二酚.该实验在上海辰华产CHI660D电化学工作站上完成.实验在三电极测试池中进行,使用玻碳电极作为工作电极,铂丝电极作为对电极,饱和Ag/AgCl电极作为参比电极.在测试前,将玻碳电极分别用0.3 μm和0.05 μm的氧化铝粉末进行抛光,之后将玻碳电极分别置于乙醇和去离子水中超声处理20 min,用以清洗电极表面的氧化铝粉末.将清洗干净的玻碳电极表面用氮气吹干,并将5 μL所制备的银微球溶液滴于电极表面,并在真空干燥的条件下将电极干燥.采用含有1 mmol·L-1对苯二酚的0.1 mol·L-1磷酸缓冲溶液(PBS溶液)作为电解液;并使用未加入对苯二酚的0.1 mol·L-1磷酸缓冲溶液(PBS溶液)作为空白对照实验的电解液.电解液在测试前通入氮气30 min,在循环伏安测试时,氮气始终被用于保护测试体系.循环伏安测试在-1.0~1.1 V电压范围内进行,扫描速度为50 mV·s-1.
2 结果与讨论
2.1 不同硝酸银用量对银微球形貌的影响
首先,将40 μL光学密度(OD,270 nm)为0.6的嗜热链球菌加入到20 mL 去离子水中,之后加入不同用量的硝酸银溶液,并用抗坏血酸还原,以考察在不同硝酸银用量时,形成的产物的不同形貌,具体的反应条件如表1所示.图1是最终产物的扫描电镜照片.从图中可以看出,以嗜热链球菌为模板,均制备得到球状的银微米材料,微球直径分别为:1.45,1.93,1.25,0.88 μm,可见,随着硝酸银用量的减小,银微球直径大体上呈现逐渐减小的趋势,但是当硝酸银用量为1.8 mL时,银微球直径稍有异常.我们认为这和银微球的生长均匀程度有一定关联.硝酸银用量较大的3个样品(2.4, 1.8, 1.2 mL时),银微球大小不均一,样品中混杂有一些较小的银球,这样,就有相对一部分银离子在较大的银球表面得以聚集生长.而当硝酸银用量是0.6 mL时,样品形貌很均一,银离子均匀地在嗜热链球菌及银球表面生长.我们推测本反应的反应机理如下:银离子首先吸附在嗜热链球菌表面,在加入抗坏血酸还原剂之后,吸附在嗜热链球菌表面的银离子被还原.之后,作为成核中心,银离子继续在嗜热链球菌表面以及形成的银球表面被还原.因此,在嗜热链球菌模板使用量一致的前提下,随着硝酸银用量的增加,制备得到的银微球的直径应逐渐增大.但是,由于生长过程中的不均匀性,导致一部分较小的银微球生成,因此,会有较多的银离子生长在较大的银微球上,从而导致部分银微球具有较大的直径.所以,当硝酸银用量为1.8 mL时,部分银微球直径较大.因此,在等量嗜热链球菌,不同硝酸银用量时制备银微球,银微球的直径随着硝酸银用量的减小逐渐减小.
2.2 不同嗜热链球菌用量对银微球形貌的影响
为了考察嗜热链球菌的用量对形成的银微球的形貌影响,选择了上述直径为0.88 μm的银微球的制备条件作为参考,在不改变硝酸银的用量时,将嗜热链球菌的用量分别调整为40,120,200 μL,具体的反应条件如表2所示.图2是最终产物的扫描电镜照片.在嗜热链球菌模板用量增多时,理论上材料生长的成核中心增多,在硝酸银不变的前提下,每个成核中心外包裹的硝酸银的量减小,因此银微球的直径理论上应该减小.但这一推断与SEM图片并不完全吻合.从图中可以看出,此时制备的银微球表面均较为粗糙,银微球的直径并没有随着模板用量的增加而减小.在保持硝酸银用量均为0.6 mL时,银微球的直径分别为0.88,2,1.5 μm,随着模板用量的增加,银微球的直径反而有所增大.和图1中的样品相比较,图1中样品是较为规则的球形,表面较为光滑.图2中(b)、(c)样品并不是规则的球形,而是具有很多棱角的类球形状.因此推断图2中(b)、(c)样品银微球的生长机理与图1实验条件时有所不同.我们分析此时的生长机理有可能是:在嗜热链球菌模板较多的情况下,硝酸银在模板外生长成为相对较小的颗粒;之后在表面能最小化的热力学驱动作用下,这些微小的银颗粒自发团聚,从而形成较大的类球体,并形成较为粗糙的表面.

综上对嗜热链球菌模板的用量以及硝酸银用量的研究发现,当使用嗜热链球菌作为材料生长的模板时,可以制备得到球形的微米材料.在本研究中,制备得到了银微球.
2.3 电化学性能的研究
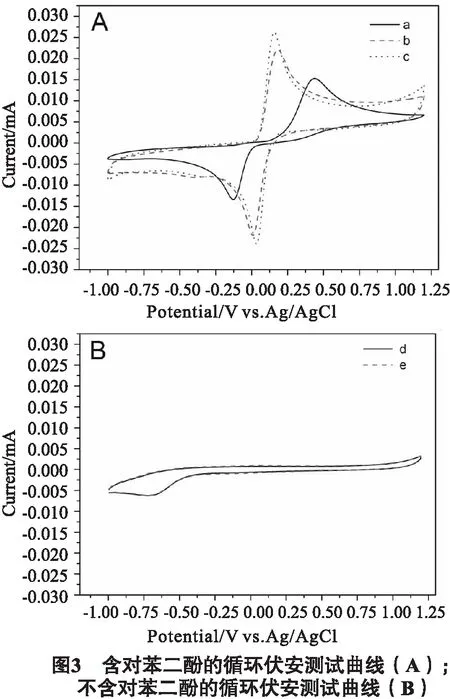
不同待测电极在含1 mmol·L-1对苯二酚的0.1 mol·L-1磷酸缓冲液中的循环伏安测试结果(见图3A);以及玻碳电极和修饰了银微球的电极在不含对苯二酚的0.1 mol·L-1磷酸缓冲液的空白电解液中的循环伏安测试结果(见图3B),扫描速率50 mV·s-1.在这一实验中,我们选择了图1(a)、1(d)中对应的直径分别为1.45,0.88 μm的银微球作为研究对象,用以评价该材料在电化学分析溶液中对苯二酚的含量的效果.图3A中a为 玻碳电极、b为图1中a样品修饰的玻碳电极、c为图1中d样品修饰的玻碳电极,在含对苯二酚的电解液中的测试结果显示,玻碳电极和修饰了银微球的电极在-0.3~0.8 V区间内,存在明显的对苯二酚的氧化还原峰.图3B中的d为玻碳电极,e为图1中a样品修饰的玻碳电极,在空白电解液中,玻碳电极和修饰了银微球的电极在-0.3~0.8 V区间内,没有任何氧化还原峰,说明在本次研究中,各种电极上的电信号,均是对对苯二酚的检测信号.在图3A所示的循环伏安曲线中,玻碳电极测试结果中在0.512 V电位和 -0.224 V电位时,出现了对苯二酚的特征氧化还原峰.这2个峰之间相差0.736 V.如此大的ΔEp,说明对苯二酚在玻碳电极上的电化学行为是一种不可逆的反应过程.直径1.45 μm的银微球修饰的玻碳电极测试结果中在0.181 V电位和0.011 V电位时,出现了对苯二酚的特征氧化还原峰.这2个峰之间相差0.17 V.ΔEp值相对于单纯的玻碳电极,减小了0.566 V.这说明直径1.45 μm的银微球的修饰减小了对苯二酚在玻碳电极上的过电位,使氧化电位减小,提高了对苯二酚在玻碳电极上的可逆性.除此之外,以直径1.45 μm的银微球修饰的玻碳电极测试得到的氧化电流峰值比单纯的玻碳电极上的氧化电流峰值要高,说明使用银微球修饰的玻碳电极对对苯二酚具有电催化作用,有利于对苯二酚的检测.直径0.88 μm的银微球修饰的玻碳电极测试结果中在0.155 V电位和0.033 V电位时,出现了对苯二酚的特征氧化还原峰.这2个峰之间相差0.122 V.ΔEp值相对于单纯的玻碳电极减小了0.614 V,相比于直径1.45 μm银微球修饰的玻碳电极减小了0.048 V.说明直径0.88 μm银微球的修饰对对苯二酚在电极上的可逆性的提高最大.因此,使用银微球修饰的电极对对苯二酚具有电催化作用,有利于对苯二酚的检测,且直径较小的银微球对对苯二酚的检测更加有利.
3 结语
本实验使用嗜热链球菌作为模板,制备得到了球状银微米颗粒.通过调控硝酸银的用量和嗜热链球菌模板的用量,可以调控银微球的大小.将直径不同的2种银微球修饰在玻碳电极上对溶液中对苯二酚进行循环伏安分析,发现使用银微球修饰的玻碳电极对对苯二酚具有电催化作用,有利于对苯二酚的检测,且直径较小的银微球对对苯二酚的检测更加有利.
参考文献:
[1] NIE S, EMORY S R. Probing single molecules and single nanoparticles by surface-enhanced Raman scattering[J]. Science, 1997, 275(5303): 1102-1106.
[2] WANG A Q, LIU J H, LIN S D, et al. A novel efficient Au-Ag alloy catalyst system: preparation, activity, and characterization[J]. Journal of Catalysis, 2005, 233(1): 186-197.
[3] REYNOLDS R A, MIRKIN C A, LETSINGER R L. Homogeneous, nanoparticle-based quantitative colorimetric detection of oligonucleotides[J]. Journal of the American Chemical Society, 2000, 122(15): 3795-3796.
[4] 黄洁, 姚建林, 顾仁敖. 金银复合体系表面增强拉曼光谱分离 [J]. 光散射学报, 2007, 19 (4): 352-357.
[5] ZHOU H, FAN T, ZHANG D. Hydrothermal synthesis of ZnO hollow spheres using spherobacterium as biotemplates[J]. Microporous and Mesoporous Materials, 2007, 100(1): 322-327.
[6] NARAYANAN K B, SAKTHIVEL N. Biological synthesis of metal nanoparticles by microbes[J]. Advances in Colloid and Interface Science, 2010, 156(1): 1-13.
[7] NADAGOUDA M N, VARMA R S. Green synthesis of silver and palladium nanoparticles at room temperature using coffee and tea extract [J]. Green Chemistry, 2008, 10 (8): 859-862.
[8] XIE J, LEE J Y, WANG D I C, et al. Silver nanoplates: from biological to biomimetic synthesis [J]. ACS Nano, 2007, 1 (5): 429-439.
[9] MALISAUSKAS M, MESKYS R, MOROZOVA-ROCHE L A. Ultrathin silver nanowires produced by amyloid biotemplating [J]. Biotechnology Progress, 2008, 24: 1166-1170.
[10] BRAUN E, EICHEN Y, SIVAN U, et al. DNA-templated assembly and electrode attachment of a conducting silver wire [J]. Nature, 1998, 391 (6669): 775-778.
[11] DUJARDIN E, PEET C, STUBBS G, et al. Organization of metallic nanoparticles using tobacco mosaic virus templates [J]. Nano Letters, 2003, 3 (3): 413-417.
[12] ZHOU H, FAN T, HAN T, et al. Bacteria-based controlled assembly of metal chalcogenide hollow nanostructures with enhanced light-harvesting and photocatalytic properties [J]. Nanotechnology, 2009, 20 (8):085603.
[13] YANG L, GUAN W, BAI B, et al. Synthesis of yeast-assisted Co3O4hollow microspheres-A novel biotemplating technique [J]. Journal of Alloys and Compounds, 2010, 504: L10-L13.
[14] SHEN L, BAO N, PREVELIGE P E, et al. Escherichia coli bacteria-templated synthesis of nanoporous cadmium sulfide hollow microrods for efficient photocatalytic hydrogen production [J]. Journal of Physical Chemistry C, 2010, 114: 2551-2559.
[15] 刘玉良, 由翠荣, 李杨, 等. 大肠杆菌为模板制备Au@TiO2催化剂及其CO氧化反应活性[J]. 物理化学学报, 2010,26(9):2455-2460.
[16] SINTUBIN L, WINDT W D, DICK J, et al. Lactic acid bacteria as reducing and capping agent for the fast and efficient production of silver nanoparticles [J]. Applied Microbiology and Biotechnology, 2009, 84: 741-749.
[17] YANG D, CHEN S H, HUANG P, et al. Bacteria-template synthesized silver microspheres with hollow and porous structures as excellent SERS substrate [J]. Green Chemistry, 2010, 12: 2038-2042.

