典型药物污染物的SPE-UPLC-MS-MS检测方法
杨晓凡,陆光华,刘建超
1.河海大学环境学院,江苏 南京 210098 2.安徽工程大学环境工程系,安徽 芜湖 241000
全世界每年消耗100 000 t以上的药物,包括消炎止痛药、抗生素、降血脂药、β-阻滞剂、激素、类固醇、抗癌药、镇静剂、癫痫药、利尿剂、兴奋剂等[1]。进入动物体或人体的药物大约有30%~95%随粪便排出体外[2-3],对污水处理厂出水检测的结果表明污水处理厂并不能完全去除药物污染物[4-5]。药物是新兴污染物PPCPs(药物和个人护理品)的重要组成部分,大部分药物不具有POPs的环境难降解特性,但持续不断地排入水环境所形成的“假持久性”,对水生生物及人体健康构成潜在的威胁[6]。
欧美等国家对各类药物在自然水体中的污染研究高度重视[7-9]。在中国,自然水体中的药物污染研究刚刚起步,对水体药物污染物的多残留检测方法[10-11]及其污染特征[12-13]等研究仍然集中在抗生素领域。而抗生素只是大量药物中的一部分,在科研和实践中,为了满足对不同类药物污染特征及其相关毒理学的研究,迫切需要建立能够满足同时检测不同种类药物的多残留检测方法。
在对中国常用药物调查的基础上,参照水环境中优先控制药物筛选方法[14]及国内外污染药物的检出频率、持久性和水生生物毒性,选择了10种药物作为典型的药物污染物(氧氟沙星、诺氟沙星、磺胺甲恶唑、心得安、阿替洛尔、布洛芬、双氯芬酸、咖啡因、氯霉素、三氯生),建立了10种不同类药物的SPE-UPLC-MS-MS检测方法,并应用此方法对自然水体进行了检测。
1 实验部分
1.1 仪器与试剂
超高效液相色谱-质谱联用仪(UPLC-Xevo TQ MS);固相萃取装置;氮吹仪;甲醇、乙腈、甲酸等,均为色谱纯;实验室制超纯水;标准品:氧氟沙星、诺氟沙星、磺胺甲恶唑、心得安、阿替洛尔、布洛芬、双氯芬酸、咖啡因、氯霉素、三氯生,均购自德国,纯度大于98%。
1.2 溶液配制
标准品储备液的配制:分别称取标准品50 mg,用甲醇溶解于50 mL棕色容量瓶中,配制成浓度为1 000 μg/mL的储存液,(-20) ℃保存。标准品工作溶液的配制:用甲醇将储备液稀释成浓度分别为200、50、20、5、1、0.5 μg/L工作溶液,4 ℃下棕色瓶保存。
1.3 SPE柱的富集和净化
实验水样取自较为洁净的地表水,经检测不含待测目标化合物。水样经过0.45 μm玻璃纤维滤膜过滤,调节pH后,备用。固相萃取小柱分别用3.0 mL甲醇和3.0 mL超纯水依次平衡,开启真空泵,将500 mL水样通过特富龙管连接进入固相萃取小柱,控制流速10 mL/min。完成过柱后,于N2保护下干燥1 h。用3.0 mL甲醇洗脱2次,洗脱液收集于10 mL离心管中。50 ℃水浴氮吹至近干,残留物用甲醇溶解并定容至1 mL,经0.22 μm玻璃纤维滤膜至色谱小瓶中,待测。
1.4 添加回收实验
用超纯水分别配制含各类药物50 ng/L的混合液,稀硫酸调节pH,配好的溶液在室温下平衡1 h后过固相萃取柱提取检测。通过添加回收实验,研究不同SPE柱、水样pH、洗脱溶剂及水样体积对目标化合物的富集或分离的影响。
1.5 质谱参数建立和优化
用乙腈分别配制目标药物50 mg/L,使用微量注射器将药物溶液直接注入质谱仪,先进行全扫描,找出准确的[M+H]+或[M-H]-的分子离子峰,分别对该分子离子进行轰击,获得二次碎裂产生的子离子,最后将分子离子和信号强度适宜的子离子组成监测离子对,多反应监测(MRM)模式进行检测。在此基础上优化各种质谱参数,使特征离子的丰度和比例达到最佳,用于后续的定性和定量分析。
测试过程中采用电喷雾电离源(ESl)、MRM模式进行质谱参数的优化。化合物在离子生成过程中,分子结构中含有较多的强电负性基团时(如氯、溴和烃基的化合物),易于生成负离子;而含仲胺或叔胺基团时则易于生成正离子。因此,氧氟沙星、诺氟沙星、磺胺甲恶唑、心得安、阿替洛尔、咖啡因采用正离子检测模式;布洛芬、双氯芬酸、氯霉素、三氯生采用负离子检测模式。
源温为150 ℃,雾化温度为500 ℃,离子源为ESI,扫描方式为正离子扫描和负离子扫描,检测方式为MRM,电喷雾电压为3 500 V,雾化气为1 000 L/h,各药物的质谱参数见表1。

表1 各药物的质谱参数表
1.6 超高效液相色谱分离参数的建立和优化
通过等度洗脱确定各目标药物的大致保留时间和顺序,调整梯度洗脱程序,以及流动相的pH来实现最佳液相色谱分离和离子对识别。
色谱柱ACQUITY UPLC BEH C18 (2.1 mm×50 mm,1.7 μm);柱温为30 ℃;正离子模式下流动相:A为甲醇;B为H2O(0.1%甲酸);梯度洗脱为0~1.0 min时90%~80% B;1.0~2.5 min时80%~20% B;2.5~4.9 min时20% B;4.9~5.0 min时20%~90% B;5.0~10.0 min时90% B;流速为0.2 mL/min;进样量5.0 μL。负离子模式下流动相:A为乙腈;B为H2O;梯度洗脱为0~1.0 min时90%~80% B;1.0~2.5 min时80%~20% B;2.5~5.9 min时20% B;5.9~6.0 min时20%~90% B;6.0~10.0 min时90% B;流速为0.2 mL/min;进样量5.0 μL。各药物的MRM色谱图见图1和图2。
图1 正离子模式下药物标准溶液的MRM色谱图
图2 负离子模式下药物标准溶液的MRM色谱图
1.7 定量方法
外标法定量,0.5、1、5、20、50、200 μg/L的工作液分别进样,重复3次,绘制定量标准曲线。
2 结果与分析
2.1 2种SPE柱富集、分离效果比较
由于药物以痕量存在于自然水体中,样品前处理过程中选择合适的富集材料是提高准确度和精密度的有效方法。在参考文献的基础上,比较了常用的HLB柱和C18柱的富集效果。由于天然水体的pH为7.0~7.5,实验调节水样pH=7.5。超纯水添加浓度100 ng/L,水样体积500 mL。结果见图3。总体来说,HLB柱相对C18柱具有更好的富集效果。
图3 HLB柱和C18柱对10种药物的富集分离效果
2.2 pH的影响
根据2种富集柱富集比较,选择HLB柱作为富集材料,考察了4种pH(7.5、5.0、3.0、2.0)条件下,10种药物的添加回收率,添加浓度100 ng/L,水样体积500 mL,结果见图4。
图4 不同pH条件下HLB柱富集10种药物的添加回收率
由图4可见,在较低pH时,大部分药物均有较高的回收率。pH=2.0时,平均回收率为79.2%,pH=3.0时,平均回收率为83%。显然水样pH=3.0时,HLB柱对10种药物的富集更具有优势。水溶液中pH的变化既能影响药物分子的理化性质,也能改变HLB柱富集颗粒的吸附特性,从而影响药物分子的富集和解析。
2.3 洗脱溶剂的影响
分别研究了体积分数为55%、75%、95%甲醇水和100%甲醇4种洗脱液对10种药物的洗脱效果。添加浓度为50 ng/L,水样体积500 mL,pH=3.0,结果见图5。
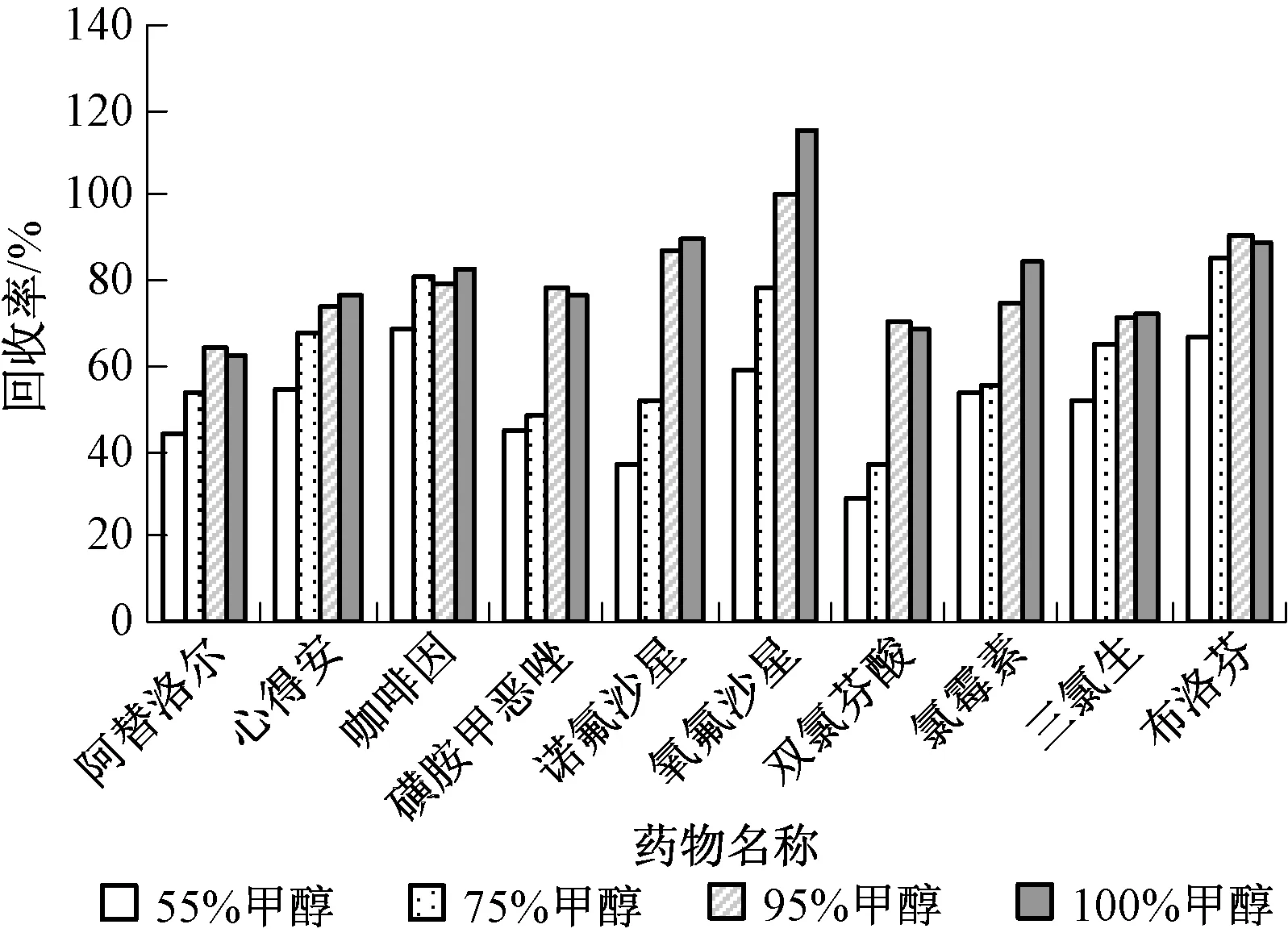
图5 不同体积分数的甲醇洗脱剂对10种药物添加回收率的影响
随着甲醇比例的增加,回收率增加,95%甲醇和100%甲醇均具有理想的淋洗效果。95%甲醇作为洗脱剂能够减少甲醇使用量,减少甲醇挥发,降低对人体的风险,并节约成本,因此选择95%甲醇作为洗脱剂。
2.4 水样体积的影响
选择经检测不含上述药物的自然水进行药物添加回收实验,见图6。
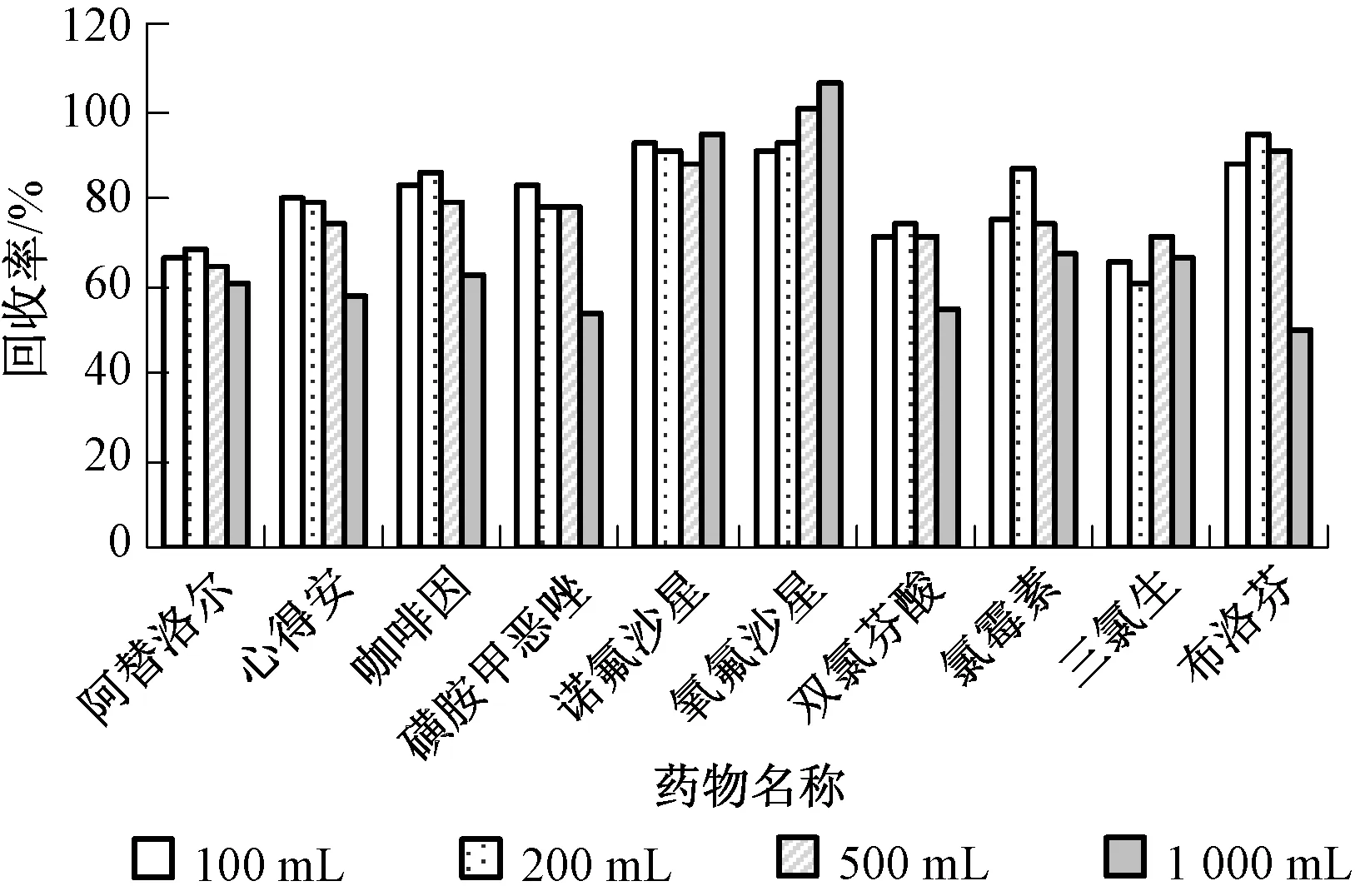
图6 富集水样体积对10种药物添加回收率的影响
由图6可见,100、200、500 mL 3种水样体积的添加回收率有差异,但是总体变化较小。除了氧氟沙星,当水样体积达到1 000 mL时,各药物添加回收率呈现明显的下降趋势。在1 000 mL时,氧氟沙星回收率超过了100%,没有达到120%。这种现象可能由于水样过柱体积加大,柱体富集选择性降低,杂质“假阳性”干扰增大所致。正常情况下,SPE柱填料有限,对水体中的物质吸附表现出一定的承载量,因此,当强行过滤的水样越多,吸附水体中的其他物质(腐殖酸等)也越多,达到其承载量附近时,吸附效果下降,添加回收率反而降低,影响检测的准确性和精密度。另外,随着水样的增加,HLB小柱透水性变差,导致流速变慢,工作效率降低;另一方面,药物在自然水体中以痕量存在,富集的水样体积太少,浓度太小,低于检测限,则检测不到。因此在自然水体检测中,选择200~500 mL作为样品体积较为适宜。
2.5 方法的相关参数
方法的回收率及检出限列于表2。

表2 方法回收率及检出限
从表2中可见,在0~200 μg/L范围内10种药物的标准曲线线性关系良好(r≥0.999),方法最低检出浓度0.5~2.0 ng/L,精密度高(RSD<10%),加标回收率为64.3%~100.7%。
2.6 实际水样测定
分别在太湖和某污水排水口取实际水样,按照优化后的方法进行检测,结果见表3。

表3 实际水样中10种药物检出浓度 ng/L
注:“—”表示未检测到药物或低于检出限。
相对于深圳河[15]和海河[13],太湖水样的磺胺类及喹诺酮类药物检测量相对较小。咖啡因残留量可以作为城市污水排放的指示药物[16-17],仅从北太湖的咖啡因含量看,北太湖仍然受到城市污水排放的威胁。在污水处理厂排水口检测到7种药物,这与国外的相关检出量近似[4,18],进一步证明污水处理厂并不能完全去除药物污染物。
3 结论
该方法使用样品体积为500 mL,调节水样pH=3.0,HLB柱富集,用6 mL体积分数为95%的甲醇洗脱,采用高效液相-串联质谱正负离子模式检测,外标法定量,检出限0.5~2.0 ng/L,精密度高(RSD<10%),加标回收率为64.3%~100.7%,并从实际2种水样中检测出了大部分的目标药物,表明该方法适合自然水体药物检测要求,同时选择的10种目标药物在研究中国水体污染中具有一定的代表性,可以为自然水体的药物污染检测及相关的生态毒理学研究提供参考。
[1] Ternes T A, Joss A, Siegrist H. Peer reviewed: scrutinizing pharmaceuticals and personal care products in wastewater treatment[J]. Environ Sci Technol,2004,38(20):392A-399A.
[2] Alcock R E, Sweetman A, Jones K C. Assessment of organic contanhnant fate in waste water treatment plants I: selected compounds and physicochemical properties[J].Chemosphere,1999,38(10):2 247-2 262.
[3] Beconi-Barker M G, Dame K J, Hornish R E. Ceftiofur hydrochloride: plasma and tissue distribution in swine following intramuscular administration at various doses[J].J Vet Pharmacol Ther,2006,19(3):192-199.
[4] Kuster M, Petrovic M,Hernando M D,et al. Analysis and occurrence of pharmaceuticals,estrogens, progestogens and polar pesticides in sewage treatment plant effluents, river water and drinking water in the Llobregat river basin(Barcelona, Spain)[J]. Journal of Hydrol,2008,358:112-123.
[5] Naddeo V, Meriç S, Kassinos D, et al. Fate of pharmaceuticals in contaminated urban wastewater effluent under ultrasonic irradiation[J]. Water Res, 2009,43(16):4 019-4 027.
[6] Richardson B J, Lam P K S, Martin M. Emerging chemicals of concern: pharmaceuticals and personal care products (PPCPs) in Asia, with particular reference to Southern China[J]. Mar Pollut Bull, 2005,50(9):913-920.
[7] Kolpin D W, Furlong E T, Meyer M T, et al. Pharmaceuticals, hormones, and other organicwastewater contaminants in U S Streams, 1999—2000: a national reconnaissance[J].Environ Sci Technol,2002,36(6):1 202-1 211.
[8] Ginebreda A, Muoz I, Alda M L, et al. Environmental risk assessment of pharmaceuticals in rivers: relationships between hazard indexes and aquatic macroinvertebrate diversity indexes in the Llobregat River (NE Spain)[J]. Environ Int, 2010,36(2):153-162.
[9] Tamtam F, Mercier F, Le Bot B, et al. Occurrence and fate of antibiotics in the Seine River in various hydrological conditions[J].Sci Total Environ,2008,393(1): 84-95.
[10] 张俊, 罗阳, 潘曼曼, 等. 水体中磺胺、四环素、喹诺酮类抗生素检测方法[J]. 中国环境监测, 2013,29(4):111-115.
[11] 高立红, 史亚利, 厉文辉, 等. 高效液相色谱-电喷雾串联质谱法检测环境水样中22种抗生素类药物[J].色谱,2010,28(5):491-497.
[12] 那广水, 陈彤,张月梅. 中国北方地区水体中四环素族抗生素残留现状分析[J].中国环境监测, 2009,25(6):78-80.
[13] Luo Y, Xu L, Rysz M, et al. Occurrence and transport of tetracycline, sulfonamide, quinolone, and macrolide antibiotics in the Haihe River Basin, China[J].Environ Sci Technol,2011,45 (5): 1 827-1 833.
[14] 王朋华, 袁涛,李荣,等. 水环境中优先控制药物筛选体系的建立与应用[J]. 中国环境监测, 2008,24(4):7-12.
[15] 叶计朋, 邹世春, 张干,等. 典型抗生素类药物在珠江三角洲水体中的污染特征[J]. 生态环境, 2007,16(2):384-388.
[16] Chen Z, Pavelic P, Dillon P, et al. Determination of caffeine as a tracer of sewage effluent in natural waters by on-line solid-phase extraction and liquid chromatography with diode-array detection[J]. Water Res,2002,36(19):4 830-4 838.
[17] Buerge I J, Poiger T, Müller M D, et al. Caffeine, an anthropogenic marker for wastewater contamination of surface waters[J]. Environ Sci Technol, 2003,37(4):691-700.
[18] Roberts P H, Thomas K V. The occurrence of selected pharmaceuticals in wastewater effluent and surface waters of the lower Tyne catchment[J]. Sci Total Environ,2006,356(1-3):143-153.

