棘孢小单孢菌原生质体制备条件的优化
邱小明,刘志琼
棘孢小单孢菌原生质体制备条件的优化
邱小明1,刘志琼2
(1.漳州职业技术学院 食品与生物工程系,福建 漳州 363000;2.上海皑博生物科技有限公司,上海 201620)
对棘孢小单孢菌() 原生质体制备条件进行了研究,研究表明:将棘孢小单孢菌的孢子接种到种子培养基培养36~48h(种液变为微红色),转接于含有0.3%Gly的抑制细胞壁合成培养基中继续培养48h,加入终浓度为15mg/ml的溶菌酶,37℃,酶解90min得到优化的原生质体制备条件,此时原生质体形成率与再生率之积最高,效果最好。
棘孢小单孢;原生质体;制备;再生;优化。
小单孢菌()是一类产生多种抗生素的放线菌[1,2],如临床上常用的庆大霉素[3]、小诺霉素[4]等。庆大霉素是由绛红色小单(NRRL 2953)和棘孢小单孢菌(NRRL 2985)产生的一族多组分的氨基糖苷类抗生素[5]。目前庆大霉素产生菌改良的主要措施是菌种诱变,如杨丽[6]等以庆大霉素产生菌JY1-12为出发菌株,经紫外线照射,选育出性能优良的菌株JY3-5,比出发菌株效价提高18.6%,也有人做了用诱变剂直接诱变小单孢菌的原生质体的尝试,如杨丽[6]以棘孢小单孢突变(JIM-401)为出发菌株,进行原生质体制备及再生条件的研究,结合UV照射及高能电子流诱变,筛选出MS-116菌株,30吨发酵罐试验,其C2b组分达85.6%。郑幼霞等[7]在研究棘状小单孢菌原生质体形成,再生和融合重组中发现,在含有0.3%甘氨酸的培养基中其菌丝形态有明显改变,以PEG4000为融合,重组子的效价为1900u/ml左右,比对照组提高约52%。这些充分显示了原生质体再生和原生质体融合在改良小单孢菌方面是一种比较有效的方法。本研究尝试对棘孢小单孢菌原生质体制备条件进行优化,期望对后续庆大霉素产生菌的基因工程育种方面提供帮助。
1 材料和方法
1.1 菌株和试剂
棘孢小单孢菌JBS)菌株。溶菌酶 生工生物工程(上海)有限公司
1.2 培养基及溶液
(1)棘孢小单孢菌原生质体再生培养基(g/L):可溶性淀粉 40,蔗糖103,MgCl210,KNO31,K2HPO40.3,MgSO40.5, NaCl 0.5, CaCO31,麸皮30,琼脂15,pH 7.6~7.8。
(2)棘孢小单孢菌孢子平板培养基(g/L):可溶性淀粉 10,KNO31,K2HPO40.3,MgSO40.5, NaCl 0.5, CaCO31,天冬素 0.02,琼脂17,pH 7.6~7.8。
(3)棘孢小单孢菌孢子斜面培养基(g/L):可溶性淀粉 10,KNO31,K2HPO40.3,MgSO40.5, NaCl 0.5, CaCO31,天冬素 0.02,琼脂15,pH 调至 7.6~7.8。
(4)棘孢小单孢菌生长培养基(g/L):可溶性淀粉 20 ,黄豆饼粉 20 ,蛋白胨5,葡萄糖5,CaCO34,MnSO4.0.0001,CoCl20.001,Gly 3,pH 调至 7.8,35℃培养 120h,摇床转速 220r/min。
1.3 常用溶液及缓冲液
(1)P缓冲液(原生质体制备缓冲液)(g/L):蔗糖 103,K2SO40.25,MgCl2·6H2O 2.02,微量元素2ml;
(2)微量元素[8];
(3)T 转化缓冲液(g/L):蔗糖165,,K2SO40.4,MgSO46H2O 3.4,微量元素3.3ml,将上述四种组分溶于900ml蒸馏水中,使用前加入STE(0.25M)10ml,KH2PO4(0.5%)1.7ml和CaCl2(5M)0.85ml,用0.22µm的滤膜过滤除菌;
1.4 棘孢小单孢菌原生质体的制备方法[5]。
1.5 棘孢小单孢菌原生质体形成率和再生率的计算公式为:
A: 酶解前菌丝体直接用无菌水适当稀释涂布平板长出菌落数;
B: 酶解液经无菌水适当稀释后涂布于孢子生长培养基平板长出菌落数;
C: 酶解液经P液适当稀释后涂布于再生平板长出菌落数。
2 结 果
2.1 甘氨酸浓度对原生质体形成的影响
小单孢菌与其它微生物不同,具有特殊的细胞壁结构,其肽聚糖中N-乙酰胞壁酸中乙酰基被羟乙酰基所取代。所以,溶菌酶不能很好的水解其细胞壁.甘氨酸则具有渗入细菌细胞壁替代肽聚糖中D-丙氨酸的作用,可能影响细胞壁组份的相互交联,并在一定程度上抑制了菌丝体的生长发育,但细胞壁对溶菌酶的敏感性却显著增强了,使其菌丝体细胞壁易受溶菌酶溶解,从而释放出大量的原生质体[9].有资料表明[4],放线菌Gly浓度以0.2-0.4%为宜,为考察Gly浓度对原生质体形成的影响,在生长培养基中分别加入0,0.1%,0.2%, 0.3%, 0.4%Gly,培养48小时后收获菌体,用15mg/mL溶菌酶,37℃,酶解2h,结果见图1所示。由图可知,在低浓度Gly作用下,原生质体的形成率随着Gly浓度的增加而增加,当Gly浓度高于0.3%以上,原生质体形成率没有明显提高。并且加入0.4% Gly会明显减少培养基中菌丝的生成量,因此选择在抑制细胞壁合成培养基中加入0.3% Gly为最合适。
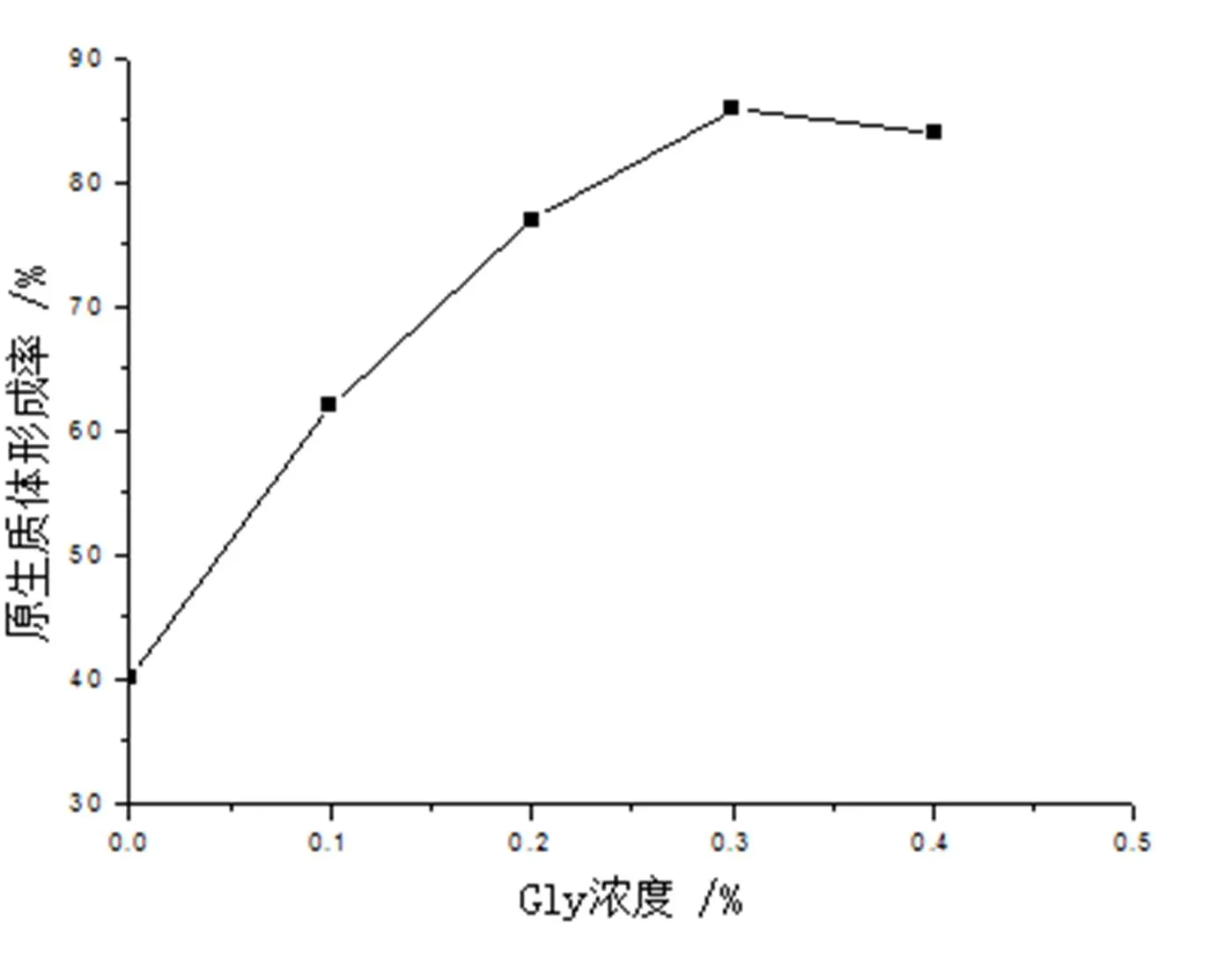
图1 不同甘氨酸(Gly)浓度对原生质体形成率的影响
2.2 溶菌酶浓度对原生质体形成和再生的影响
溶菌酶的浓度对原生质体的制备与再生至关重要,不同溶菌酶酶解浓度不仅会影响原生质体的形成,还会影响到原生质体的再生。在含0.3%Gly的抑制细胞壁合成培养基中培养48h收获菌体后,分别加溶菌酶浓度为2,5,10,15,20mg/mL,37℃酶解2h,考察溶菌酶浓度对原生质体形成率和再生率的影响,结果分别如图2和图3所示。
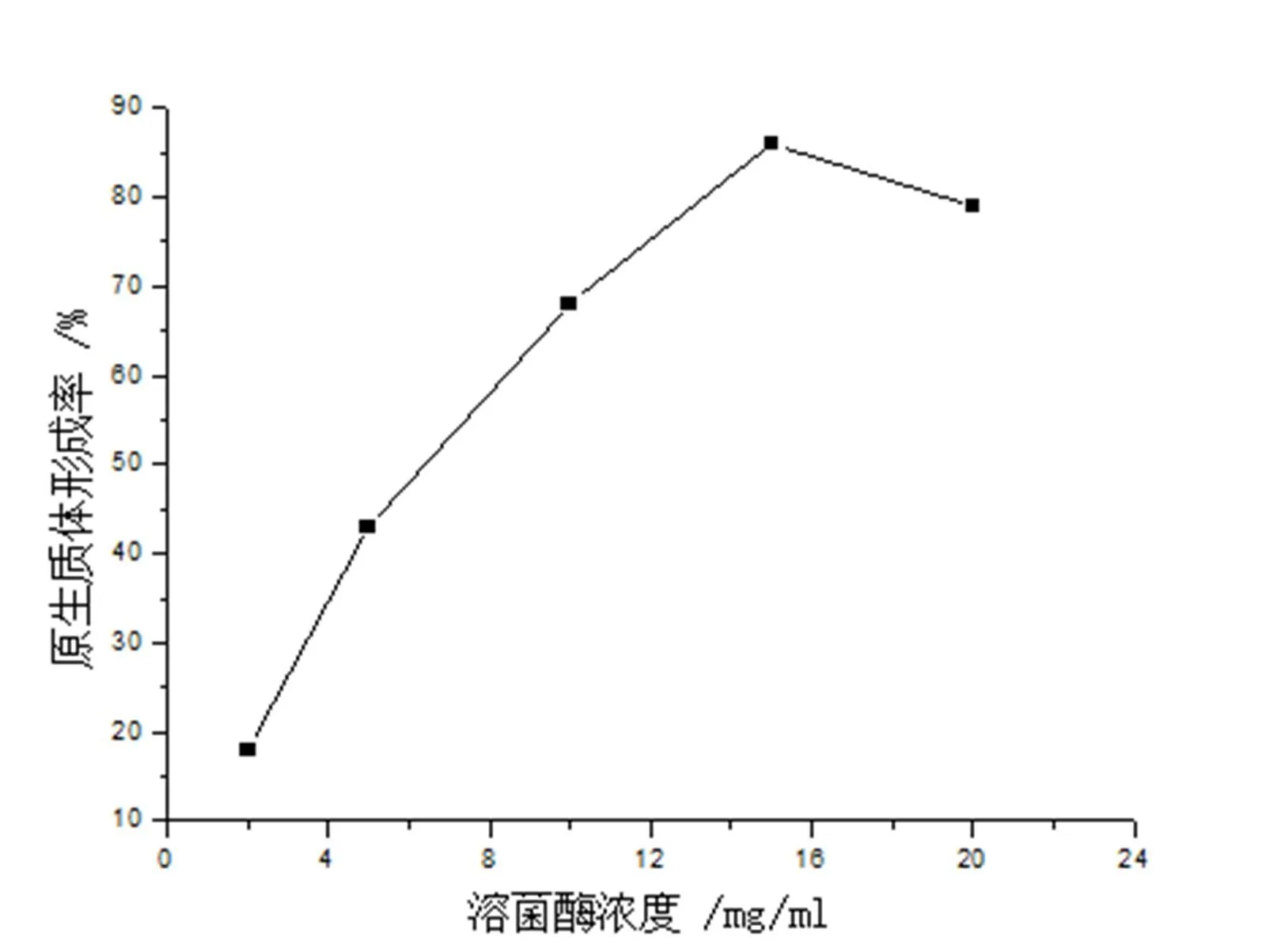
图2 溶菌酶浓度对原生质体形成率的影响
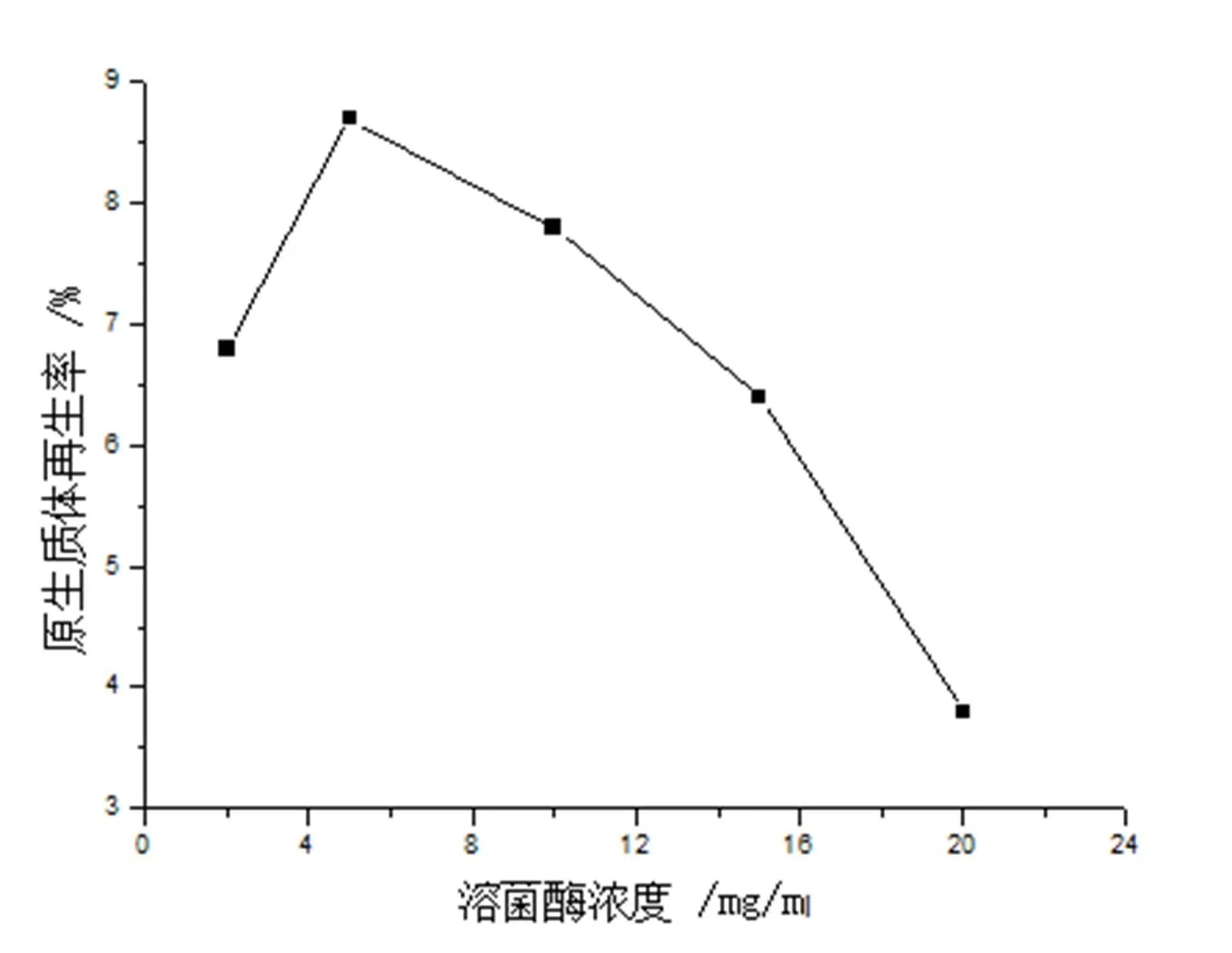
图3 溶菌酶浓度对原生质体再生率的影响
由图2可知,在溶菌酶浓度2mg/ml至15mg/ml范围内,原生质体的形成率随着酶浓的增加而增加。酶浓为15mg/mL时,原生质体形成率为86%,当酶浓达20mg/mL时,原生质体形成率却略有下降,约为79%。由图3可知,在溶菌酶浓度为2~5mg/mL范围内,原生质体的再生率随溶菌酶浓度的增加而增加,但当溶菌酶浓度超过5mg/mL时原生质体的再生率随着溶菌酶浓度的增加反而下降。当酶浓为20mg/mL时,再生率下降明显,仅为3.8%。原因可能是由于原生质体再生时需要残留的细胞壁作为“引物”,随着酶浓的增大,细胞脱壁彻底,于是降低原生质体的再生率[9];同时酶中往往含有对原生质体有害的酶类(如过氧化物酶、核糖核酸酶等),随着酶量的增加,杂酶的浓度也会随之增加,当达到一定浓度时,因细胞脱壁,杂质也易渗进细胞,必然会影响原生质体的活性,故此原生质体再生困难。综合溶菌酶浓度对原生质体形成率和再生率两方面的影响,用形成率×再生率来评价,得出溶菌酶最佳浓度为15mg/mL时,形成率×再生率为5.6%。
2.3 溶菌酶作用时间对原生质体生成和再生的影响
在含有0.3%Gly的抑制细胞壁合成培养基中35℃培养48h收获菌丝,在15mg/ml溶菌酶37℃作用下,棘孢小单孢菌菌体经不同时间酶解对原生质体的形成和再生的影响分别如图4和图5所示。
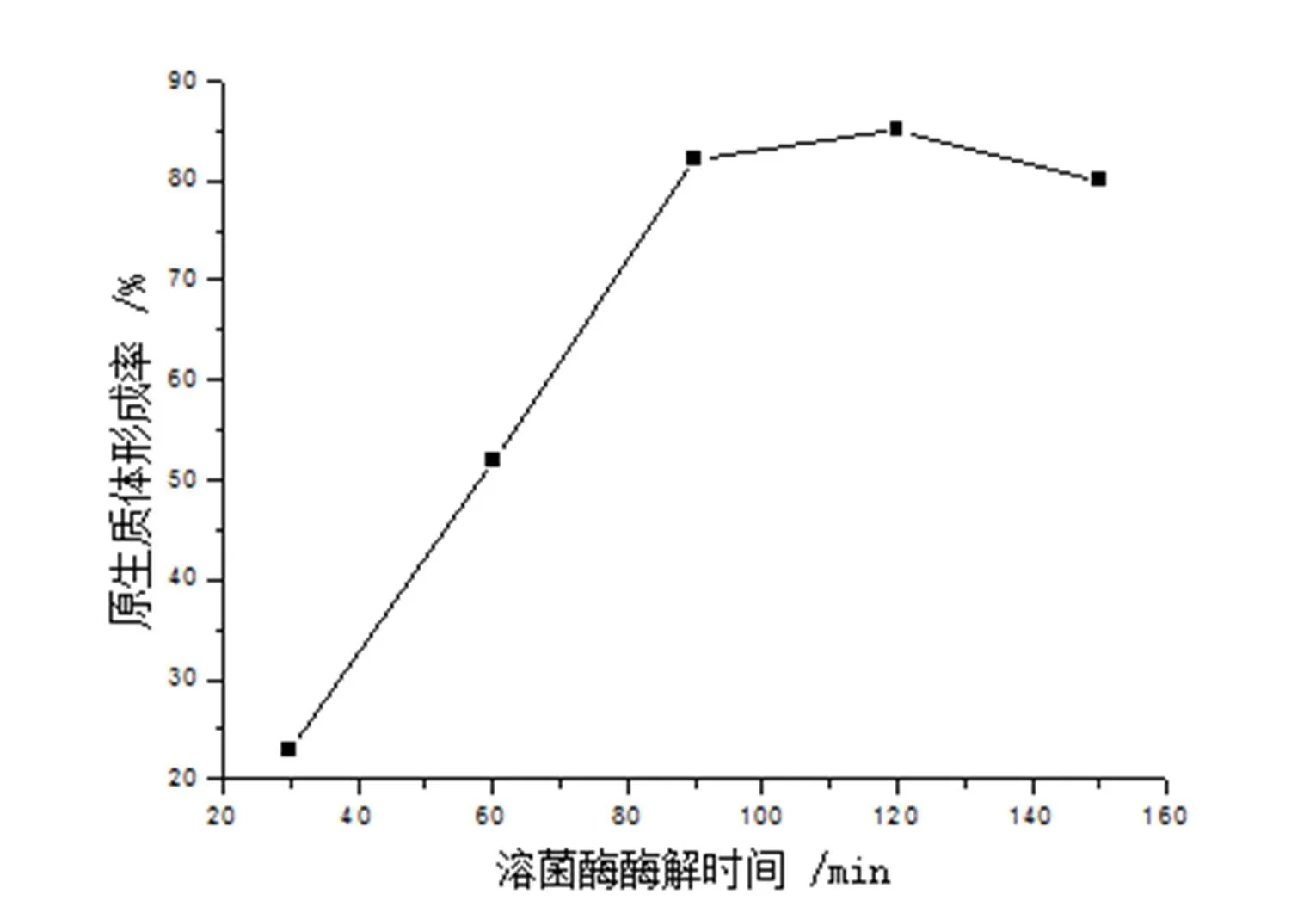
图4 溶菌酶酶解时间对原生质体形成的影响
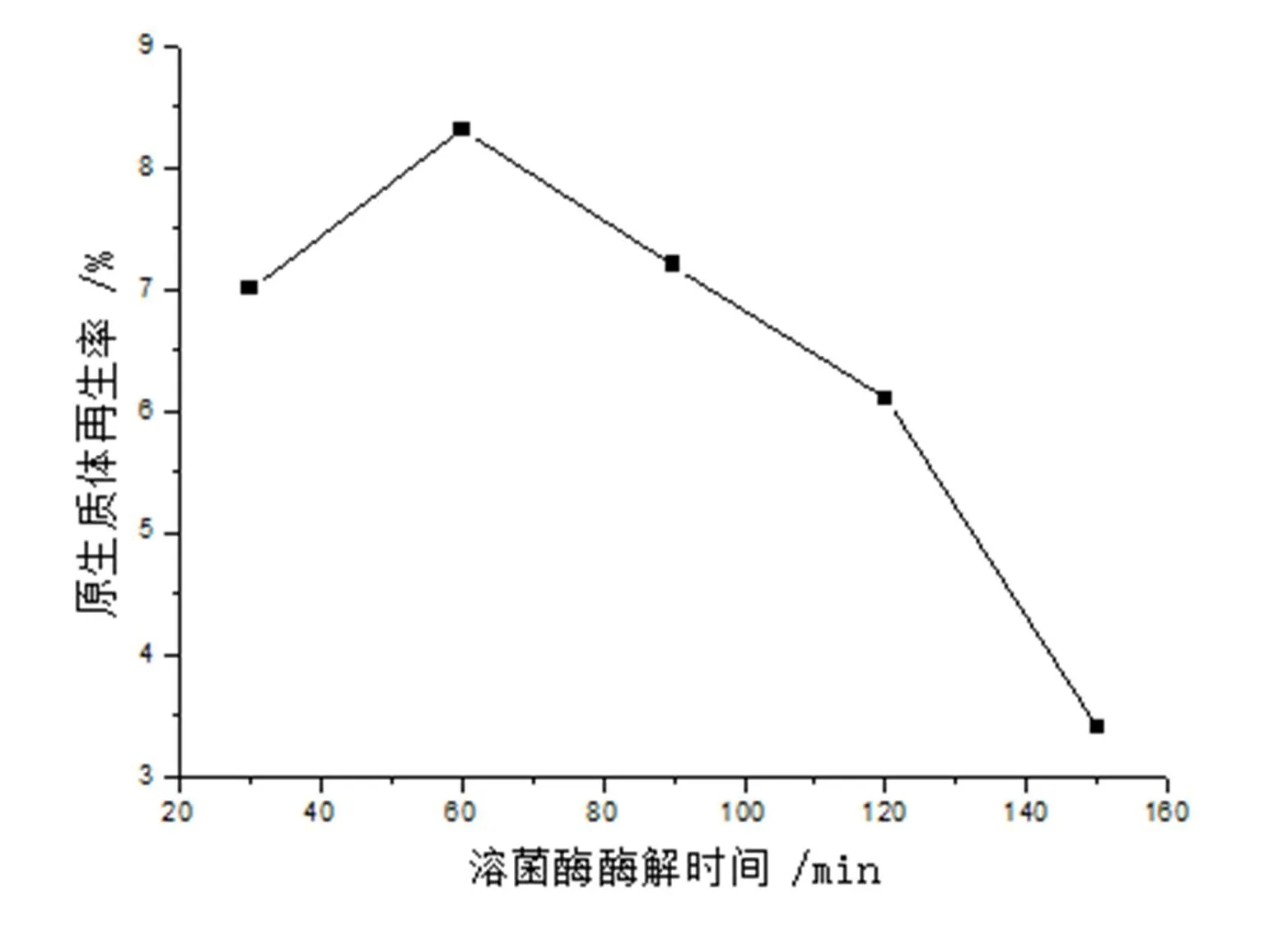
图5 溶菌酶酶解时间对原生质体再生的影响
由图4可知,在一定范围内,原生质体形成率随着酶解时间的增长而增加。酶解30min时,原生质体形成率约为23%,酶解时间为90min和120min时,原生质体形成率相差不大,分别为82%和85%;当酶解时间达150min时,原生质体形成率反而下降,约为80%。由图5可知,在溶菌酶作用时间小于60min时,原生质体再生率随酶解时间的增加而增加,但当超过60min后随着作用时间的增加再生率随之下降。分析其原因可能是:(1)因为原生质体的再生需要一定细胞壁的残余物作为再生“引物”,若原生质体的细胞壁消化太彻底,无助于细胞壁的再生,使原生质体难以再生。(2)溶菌酶作用时间太长可能会对原生质体发生作用而使细胞质膜受到一定的损伤,增加原生质体的再生困难。综合溶菌酶作用时间对原生质体的形成和再生二方面的影响,用形成率×再生率来评价,得出溶菌酶最佳酶解时间为90min,形成率×再生率为6.2%。
2.4 菌龄对原生质体形成和再生的影响
原生质体的释放效果与菌丝的生理状况关系十分密切,不同生长时期的菌丝用溶菌酶处理后,在显微镜下观察均可看到含有球状体(原生质体)。选用12h,24h, 36h,48h, 60h,72h菌龄的菌丝体在含有0.3 % Gly的抑制细胞壁合成培养基中35℃下培养收获菌丝后,用15mg/mL溶菌酶,37℃,酶解90min,考察菌龄对原生质体的形成和再生的影响。
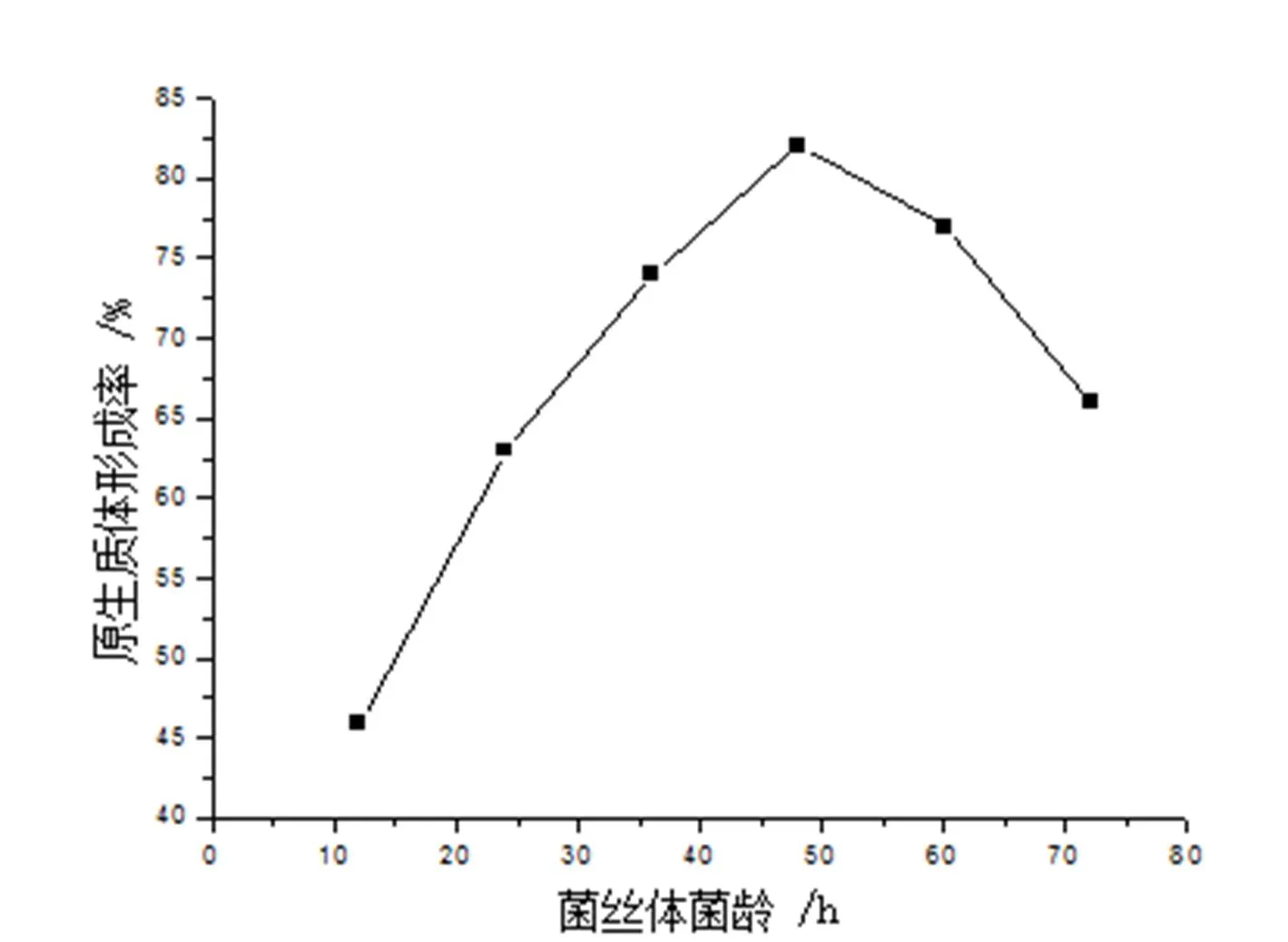
图6 菌丝体的菌龄对原生质体形成的影响
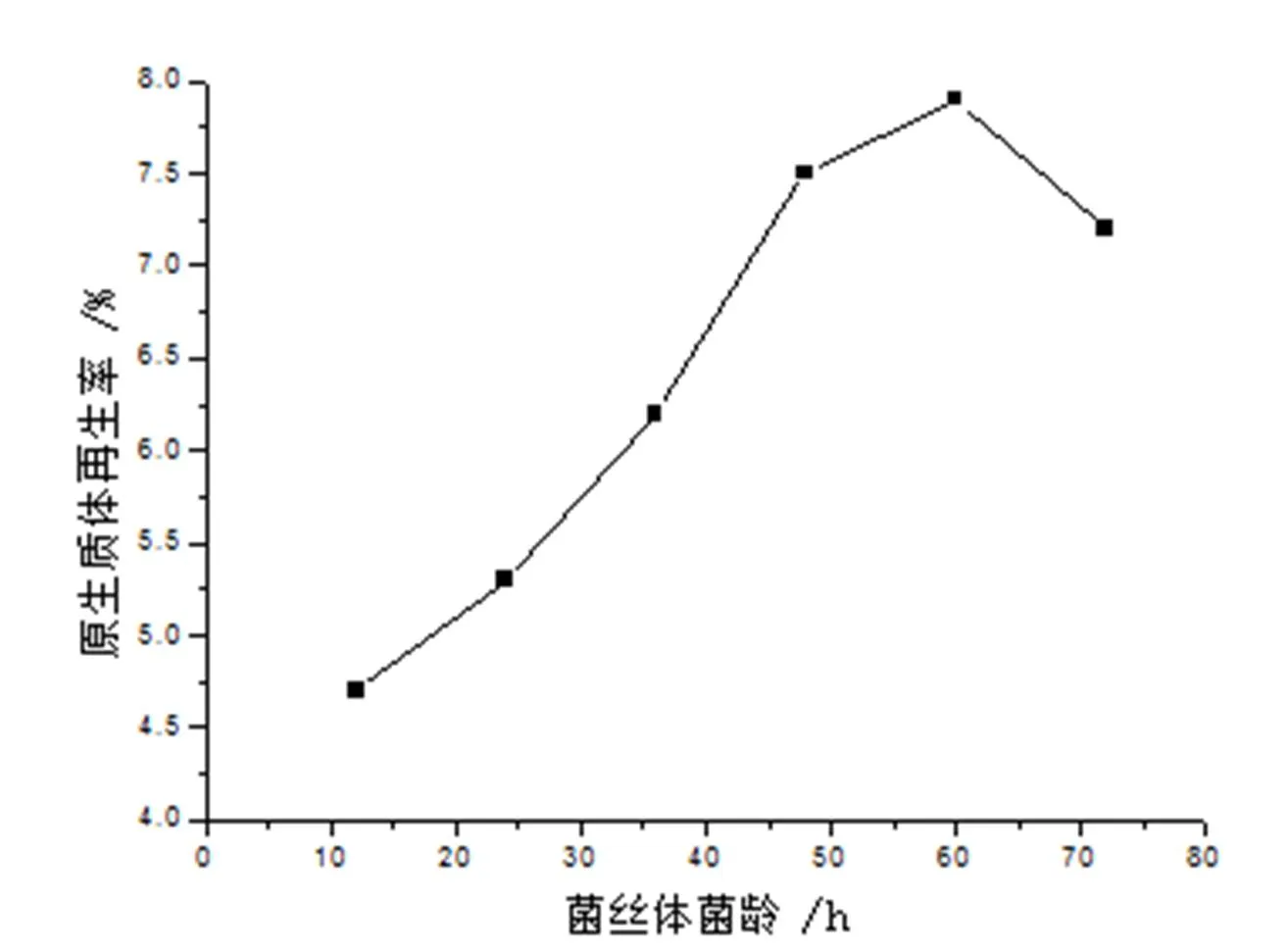
图7 菌丝体的菌龄对原生质体再生的影响
由图6可知,棘孢小单孢菌原生质体形成率在48h最高,达到82%左右,超过48h后,原生质体形成率反而开始下降。由图7可知,菌丝体的菌龄在60h时的再生率最高可达7.9%,48h时为7.5%。综合溶菌酶作用时间对原生质体的形成和再生二方面的影响,用形成率×再生率来评价,得出菌龄为48h对其原生质体的形成和再生最有利,形成率×再生率为6.2%。
3 讨 论
本文通过考察甘氨酸浓度、溶菌酶浓度、酶解时间、菌龄对棘孢小单孢菌原生质体制备的影响,确定棘孢小单孢菌原生质体制备的最优条件为:棘孢小单孢菌的孢子接种到3 7 ℃的种子培养基培养36~48h(种液变为微红色),转接于含有0.3 % Gly的抑制细胞壁合成培养基中继续培养48h,用无菌的P液洗涤,加入终浓度为15mg/ml的溶菌酶,37℃,酶解90min最合适,此时原生质体形成率与再生率之积最高,通过试验优化了庆大霉素产生菌棘孢小单孢菌原生质的体制备条件,为后续棘孢小单孢菌原生质体转化提供了有效的保障。
[1] Malfait MB, Godden MJ. Pennunckx,Growth and cellulase production of Micromonospora chalcae and Pseudonocardia thermophila[J]. Ann Microbiol (Paris),1984, 135B:79-89.
[2] Suarez JEC,Barbes C,Hardisson.Germination of spores of Micromonospora chalcae and biochemical changes[J].J Gen Microbiol,1980,121:159-167.
[3] Weinstein MJ, Iuedemann GM, Oden EM, et al. Gentamicin, a new broad-spectrum antibiotic complex[J]. Antimicrob Agents Chemother,1963, 161:1-7.
[4] Kawamura Y,Yasuda Y,Mayama M. Isolation of L-2- (1-methylcyclopropyl) glycine from Micromonospora miyakonensis sp. nov. 1. Taxonomic studies on the producing microorganism [J]. J Antibiot,1981,34(4):367-373.
[5] 戴自英.实用抗生素[M].上海:上海人民出版社,1977.
[6] 杨丽.庆大霉素产生菌的紫外线诱变育种及发酵条件研究[J].青岛化工学院学报,1999,20(1):48-51.
[7] 郑幼霞,徐小雪,杨佩,等.庆大霉素产生菌棘抱小单孢菌原生质体形成、再生及融合重组研究[J].生物工程学报,1987, 3 (2):115-118.
[8] Haifeng H, Kozo O. Novel Approach for Improving the Productivity of Antibiotic-Producing Strains by Inducing Combined Resistant Mutations[J].Applied and Environmental Microbiology, 2001, 67(4):1885-1892.
[9] 孙剑秋,周东坡.微生物原生质体技术[J].生物学通报,2002,37(7):9-11.
(责任编辑:季平)
The Optimization to The Preparation Conditions of Micromonospora echinospora Protoplast
QIU Xiao-ming1,LIU Zhi-qiong2
(1.Foods and biology engineering department, Zhangzhou Institute of Technology, Fujian Zhangzhou 363000;2.Shanghai Kaibo Biotechnology limited Co., Shanghai 201620)
The preparation conditions of micromonospora echinospora protoplast were studied. The results showed that: the spores of micromonospora echinospora were inoculated into seed medium and cultured for 36 ~ 48h (until seed liquid turned reddish), continued to culture for 48h in an inhibiting cell wall synthesis medium containing 0.3% Gly, then lysozyme with a final concentration of 15mg/m was added. The optimized preparation conditions of protoplast were at 37 ℃ and enzymolysis time of 90min, when the product of protoplast formation rate and regeneration rate was the highest and the result was the best.
micromonospora echinospora; protoplast; preparation; regeneration; optimization
2014-04-18
福建省教育厅科技计划项目(JB12334)
邱小明(1979-),男,江西信丰人,讲师,硕士,主要研究方向:生物制药与生化反应工程。
1673-1417(2014)02-0015-06
10.13908/j.cnki.issn1673-1417.2014.02.0003
TQ465
A

