2-(4-羟苯基)咪唑并[4,5-f]1,10-邻菲罗啉衍生物的合成及生物活性
霍燕芳,高焕瑞,朱莉娜
(天津大学理学院,天津 300072)
苯并咪唑类化合物是一类含苯并咪唑环的芳香杂环化合物,具有良好的生物活性,在抗癌、抗真菌、镇痛消炎、抗风湿、驱虫等方面具有重要的应用价值[1]。1,10-邻菲罗啉衍生物是一类具有刚性大的π共轭体系的含氮芳香稠环化合物,由于其结构易修饰,合成方法简单,易于与金属螯合配位,同时具有良好的光学性质,可与DNA发生嵌插结合,而被广泛用于分子识别、超分子组装、功能性配合物制备、DNA生物分子探针、抗肿瘤药物合成等领域[2-4]。
作者在此设计合成出3个新的2-(4-羟苯基)咪唑并[4,5-f]1,10-邻菲罗啉衍生物(化合物Ⅲ、Ⅳ、Ⅴ),对其结构进行了表征,并初步研究了其光谱性质及生物活性。其合成路线如图1所示。
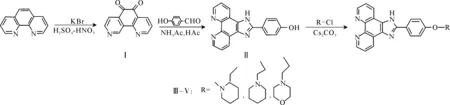
图1 目标化合物的合成路线
1 实验
1.1 试剂与仪器
所用试剂均为分析纯或色谱纯。
Perkin-Elmer 1600 FTIR 型傅立叶变换红外光谱仪(KBr压片法,扫描波数范围400~4 000 cm-1);TU-1901型紫外可见分光光度计;RF-5301PC型荧光分光光度计;Mercury Vx 300型核磁共振波谱仪(1HNMR,氘代DMSO为溶剂,TMS为内标,扫描频率300 MHz);Finnigan Lcqadvantage型质谱仪(溶剂为CH2Cl2,直接进样法,流动相为甲醇,正离子模式测试);艾科浦微量无机型超纯水机;Life Pro 基因扩增仪。
1.2 合成方法
1.2.11,10-邻菲罗啉-5,6-二酮(Ⅰ)的合成[5]
将4.0 g 邻菲罗啉和4.0 g KBr混合均匀,置于圆底烧瓶中,然后缓慢滴加到-10 ℃的40 mL浓H2SO4和20 mL浓HNO3的混合溶液中,将反应温度控制在110~130 ℃,加热回流3 h,冷却后倒入500 mL冰水中,然后用40%NaOH溶液中和至pH值为6。用三氯甲烷(100 mL×3)萃取。萃取液用无水Na2CO3干燥,过滤,减压蒸去三氯甲烷,得到1,10-邻菲罗啉-5,6-二酮粗品,再用乙醇重结晶,得到黄色或橙色针状晶体,即化合物Ⅰ。
1.2.2化合物Ⅱ的合成[6-7]
将1.0 g (4.7 mmol)化合物Ⅰ、4.0 g(51.9 mmol)乙酸铵和1.7 g(143 mmol)对羟基苯甲醛溶于30 mL冰乙酸中,加热,将温度控制在85~90 ℃,反应3 h后,将反应液冷却到20 ℃左右,然后在冰水冷却下用氨水中和至pH值为8,立即产生大量黄色沉淀,将沉淀用乙醇与甲醇的混合液重结晶2次,得黄色晶体,即化合物Ⅱ。
1.2.3化合物Ⅲ的合成[8-9]
将0.4665 g(1.5 mmol)化合物Ⅱ、0.235 g 2-氯乙基-N-甲基哌啶盐酸盐和1.5 g Cs2CO3置于圆底烧瓶中,加入50 mL DMF,加热,温度控制在50 ℃,反应3 d,将反应液冷却,过滤,减压蒸去DMF,用二氯甲烷溶解,加水洗涤,用玻璃棒搅拌,出现黄色沉淀,取出沉淀用水洗涤,得到黄色固体化合物Ⅲ。同法合成黄色化合物Ⅳ和Ⅴ。
1.3 目标化合物的表征和测试
表征:分别对化合物Ⅲ、Ⅳ、Ⅴ进行红外光谱、质谱、1HNMR及元素分析。
紫外光谱分析:将化合物Ⅲ、Ⅳ、Ⅴ分别用去离子水配成浓度为10 μmol·L-1的溶液倒入1 cm 石英比色皿中进行紫外光谱测试,扫描波长范围为190~450 nm。
荧光光谱分析:将化合物Ⅲ、Ⅳ、Ⅴ分别配制成浓度为10 μmol·L-1的溶液,在激发和发射狭缝宽度均为5 nm的条件下进行荧光光谱测试。
生物活性测试:由于双链DNA(AT、GC)和G-四链体DNA(Hum24)能使目标化合物的荧光发生猝灭,因此,在目标化合物溶液中加入上述DNA,通过测定它们之间的相互作用来研究其生物活性。待测试样总体积为100 μL,包括10 mmol·L-1Tris-HCl缓冲溶液(pH=7.4)、100 mmol·L-1NaCl、1 mmol·L-1Na2EDTA。DNA的浓度为0 μmol·L-1、5 μmol·L-1、10 μmol·L-1、15 μmol·L-1、20 μmol·L-1、25 μmol·L-1。每份待测样品均加热至95 ℃保持5 min,迅速冷却至25 ℃保持30 min,然后保持4 ℃过夜[10-14]。再加入5 μmol·L-1目标化合物后进行荧光光谱测定,激发波长为278 nm,测定波长范围为300~550 nm,狭缝宽度为5 nm。
2 结果与讨论
2.1 结构表征
2.1.1红外光谱分析
实验发现,化合物Ⅰ在1 688 cm-1处的强吸收峰为C=O的伸缩振动,证明了邻菲罗啉被氧化;1 610 cm-1处的强吸收峰为C=N的伸缩振动;3 212 cm-1处强而宽的吸收峰初步推断为O-H和N-H的伸缩振动,证明合成了化合物Ⅱ。
化合物Ⅲ~Ⅴ的红外光谱数据见表1。

表1 化合物Ⅲ~Ⅴ的红外光谱数据/cm-1
由表1可知:化合物Ⅲ在2 930 cm-1和2 787 cm-1处的强吸收峰,推断为亚甲基伸缩振动和甲基的伸缩振动;而1 248 cm-1处的吸收峰为C-O的伸缩振动,更进一步验证了化合物Ⅲ的合成。化合物Ⅳ在1 250 cm-1处的吸收峰为C-O的伸缩振动,2 932 cm-1处的吸收峰为亚甲基的伸缩振动,初步证明了化合物Ⅳ的合成。化合物Ⅴ在1 116 cm-1处的吸收峰为吗啉侧壁中C-O-C 的骨架伸缩振动,2 932 cm-1处的吸收峰为亚甲基的伸缩振动,也初步证明了化合物Ⅴ的合成。
2.1.2质谱分析(表2)
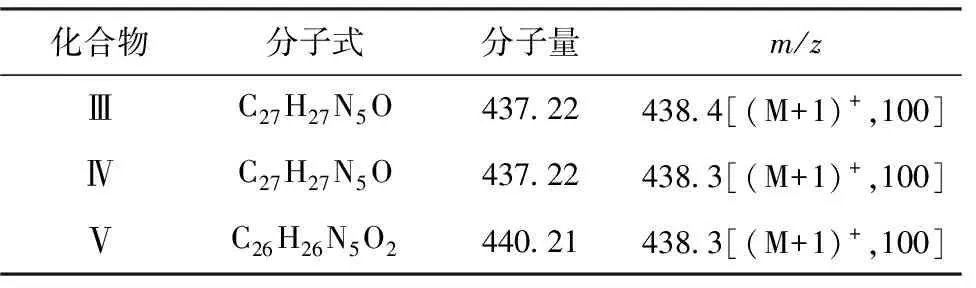
表2 化合物Ⅲ~Ⅴ的主要质谱数据
由表2可知,化合物Ⅲ~Ⅴ均能给出与相应分子量一致的准分子离子峰,表明这3个化合物为目标产物。
2.1.3元素分析(表3)
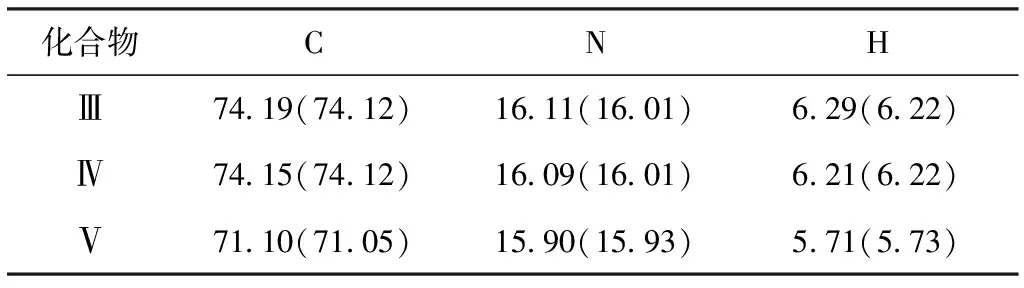
表3 化合物Ⅲ~Ⅴ的元素分析数据/%
由表3可知,测量值与计算值在误差允许范围内。
2.1.41HNMR分析(表4)

表4 化合物Ⅲ~Ⅴ的1HNMR分析数据/δ
由表4可知,化合物Ⅲ~Ⅴ为目标产物。
由红外光谱分析、质谱分析、元素分析和1HNMR分析可知,化合物Ⅲ~Ⅴ就是2-(4-羟苯基)咪唑并[4,5-f]1,10-邻菲罗啉衍生物。
2.2 紫外光谱和荧光光谱分析(图2)
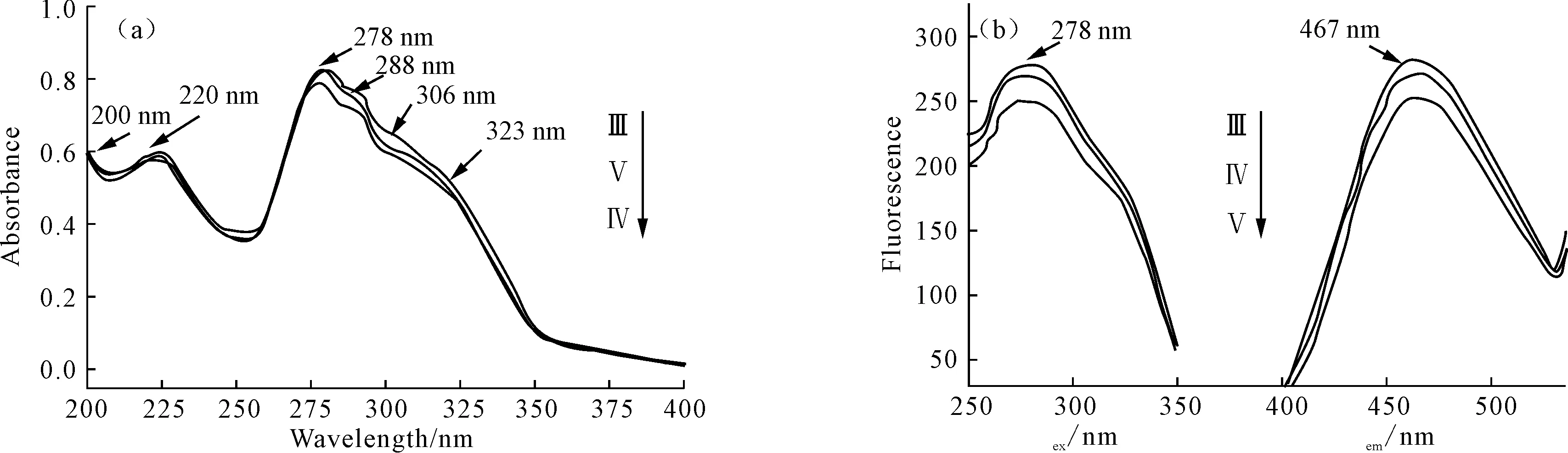
图2 化合物Ⅲ~Ⅴ的紫外光谱(a)和荧光光谱(b)
由图2a可看出:化合物Ⅲ~Ⅴ的紫外光谱十分相似,其紫外吸收峰分别位于:200 nm、220 nm、278 nm、288 nm、306 nm、323 nm 处,其中200 nm 处为共轭烯的紫外吸收峰,是由π→π*产生的 K 带电子跃迁;220 nm 处为 B 带吸收峰,属于芳香族化合物的特征吸收峰;278 nm和288 nm处是由n→π*产生的电子跃迁;306 nm和323 nm处的肩峰证明这3个化合物均含有2个以上的共轭体系。
由图2b可看出,化合物Ⅲ~Ⅴ的荧光光谱十分相似,最大激发波长(278 nm)和最大发射波长(467 nm)均相差189 nm,具有较大的斯托克斯位移。由于在邻菲罗啉的大共轭体系中引入的OR、NR2邻对位取代基为推电子取代基,p-π共轭引起分子刚性苯环的电子云密度增大,产生荧光的几率增大。
2.3 生物活性研究
2.3.1化合物Ⅲ~Ⅴ与双链DNA(AT、GC)的相互作用(图3)
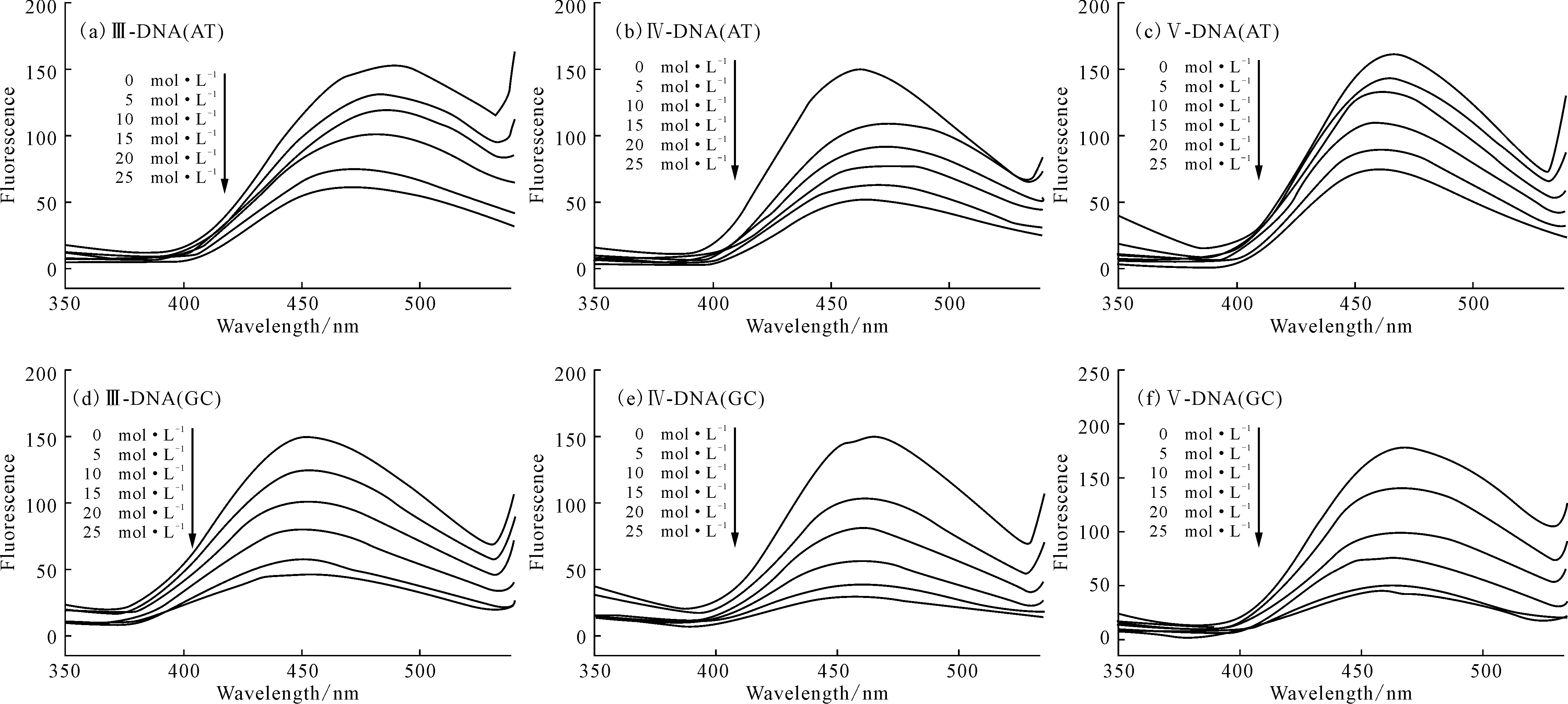
图3 不同浓度的双链DNA(AT、GC)对化合物Ⅲ~Ⅴ的荧光发射光谱的影响(λex=278 nm)
由图3可看出,随着双链DNA(AT、GC)浓度的增加,化合物Ⅲ~Ⅴ的荧光猝灭程度不断增大,且荧光猝灭程度与双链DNA(AT、GC)浓度呈线性关系。表明化合物Ⅲ~Ⅴ可以用来定量检测双链DNA(AT、GC)的浓度。
荧光的猝灭分为静态猝灭和动态猝灭。基态荧光分子与猝灭剂之间形成基态复合物引起的猝灭为静态猝灭;猝灭剂和荧光物质的激发态分子之间的相互作用引起的猝灭为动态猝灭,其过程遵循Stern-Volmer方程[15]:
F0/F=1+KSV[Q]=1+Kqτ0[Q]
式中:F、F0为有、无猝灭剂时的荧光强度;KSV为猝灭常数;[Q]为猝灭剂浓度;Kq为猝灭速率常数;τ0为无猝灭剂时荧光分子的平均寿命,生物大分子的荧光寿命约为 10-8s。
由于药物小分子与生物大分子之间的最大扩散控制的碰撞常数Kq为2 × 1010L·mol-1·s-1[16],因此, 可以初步确定化合物Ⅲ~Ⅴ与双链DNA(AT、GC)的猝灭作用是动态猝灭还是静态猝灭:当猝灭速率常数大于最大扩散控制的碰撞常数,可能为形成基态复合物的静态猝灭,反之则为动态猝灭。
图4是化合物Ⅲ~Ⅴ与双链DNA(AT、GC)作用导致荧光猝灭的Stern-Volmer图谱,由此图计算化合物Ⅲ~Ⅴ与双链DNA(AT、GC)作用的Stern-Volmer参数见表5。
由表5可知,化合物Ⅲ~Ⅴ与双链DNA(AT、GC)作用的猝灭速率常数Kq远大于药物小分子与生物大分子之间的最大扩散控制的碰撞常数 2×1010L·mol-1·s-1。因此,双链DNA(AT、GC)对化合物Ⅲ~Ⅴ荧光的猝灭作用不是动态猝灭,而是形成基态复合物的静态猝灭。
2.3.2化合物Ⅲ~Ⅴ与G-四链体DNA(Hum24)的相互作用(图5)
由图5可以看出:随着G-四链体DNA(Hum24)浓度的增加,化合物Ⅲ~Ⅴ的荧光强度先减弱后增强,而且伴有蓝移现象,这与双链DNA(AT、GC)的荧光猝灭作用不同。表明化合物Ⅲ~Ⅴ不仅可以定量检测双链DNA(AT、GC)的浓度,而且可以用来区分DNA的G-四链体构型及双链构型。
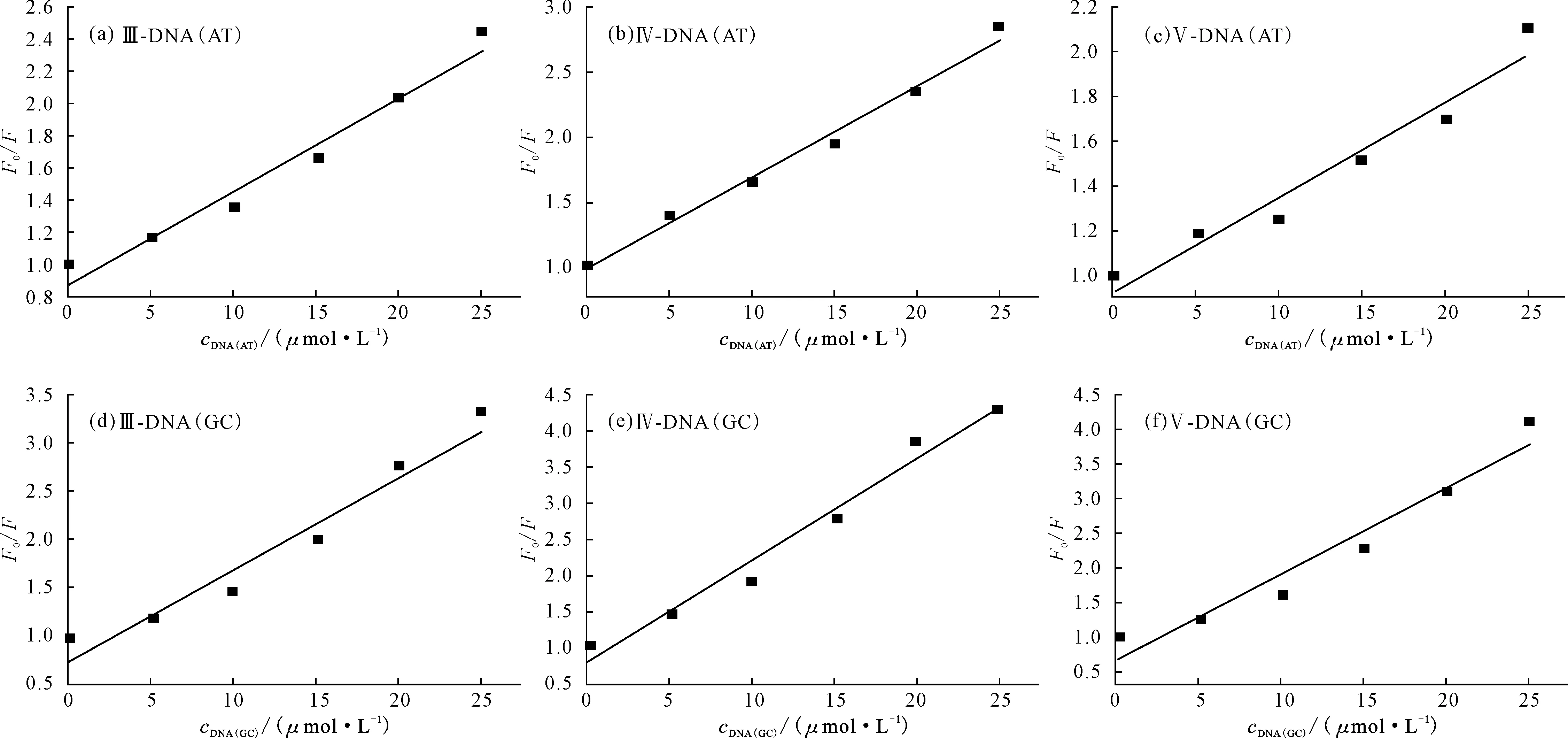
图4 化合物Ⅲ~Ⅴ与双链DNA(AT、GC)相互作用的Stern-Volmer图谱
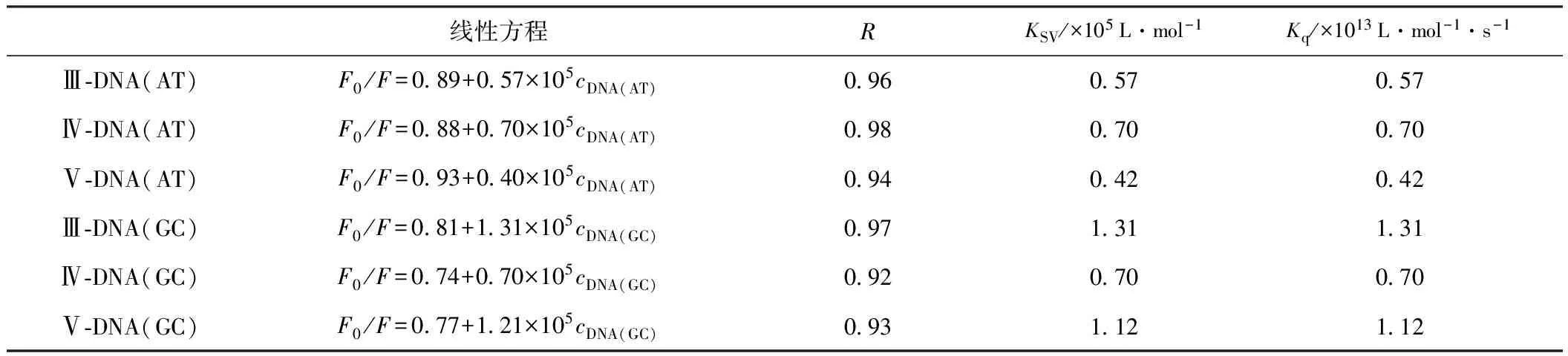
表5 化合物Ⅲ~Ⅴ与双链DNA(AT、GC)相互作用的Stern-Volmer参数
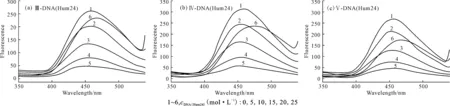
图5 不同浓度的G-四链体DNA(Hum24)对化合物Ⅲ~Ⅴ的荧光发射光谱的影响
3 结论
合成了3个新的2-(4-羟苯基)咪唑并[4,5-f]1,10-邻菲罗啉衍生物,通过红外光谱、质谱、1HNMR、元素分析对其结构进行了表征,证明成功地合成出目标化合物。3个化合物均具有较强的荧光和较大的斯托克斯位移,使其在光电材料、有机药物等领域具有潜在的应用价值。通过研究3个化合物与双链DNA(AT、GC)、G-四链体DNA(Hum24)的相互作用,发现DNA对3个化合物的荧光具有猝灭作用,初步研究了它们的猝灭模式。其中目标化合物的荧光猝灭程度与双链DNA(AT、GC)的浓度呈线性关系,使得这3个化合物有望被开发用作荧光猝灭探针检测双链DNA(AT、GC)的浓度。
参考文献:
[1]CHAIRES J B,FOX K R,HERRERA J E,et al.Site and sequence specificity of the daunomycin-DNA interaction[J].Biochemistry,1987,26(25):8227-8236.
[2]DERVAN P B.Design of sequence-specific DNA-binding molecules[J].Science,1986,232(4749):464-471.
[3]CUESTA-SEIJO J A,SHELDRICK G M,SHELDRICK G M.Structures of complexes between echinomycin and duplex DNA[J].Acta Crystallogr D Biol Crystallogr,2005,61(4):442-448.
[4]崔运成,王家军.1,10-邻菲罗啉类配体修饰的研究进展[J].吉林师范大学学报(自然科学版),2007,28(1):39-41.
[5]LENAERTS P,STORMS A,MULLENS J,et al.Thin films of highly luminescent lanthanide complexes covalently linked to an organic-inorganic hybrid materialvia2-substituted imidazo[4,5-f]-1,10-phenanthroline groups[J].Chemistry Materials,2005,17(20):5194-5201.
[6]MEI W J,LIU J,ZHENG K C,et al.Experimental and theoretical study on DNA-binding and photocleavage properties of chiral complexes △- and ∧-[Ru(bpy)2L](L=o-hpip,m-hpip andp-hpip)[J].Dalton Transactions,2003,(7):1352-1359.
[7]STECK E A,DAY A R.Reactions of phenanthraquinone and retenequinone with aldehydes and ammonium acetate in acetic acid solution[J].Journal of the American Chemical Society,1943,65(3):452-456.
[8]BIAN Z Q,WANG K Z,JIN L P,et al.Syntheses,spectroscopic and crystal structural studies of novel imidazo[4,5-f]1,10-phenanthroline derivatives and their Eu(Ⅲ) ternary complexes with dibenzoylmethane[J].Polyhedron,2002,21(3):313-319.
[9]REED J E, NEIDLE S,VILAR R,et al.Stabilisation of human telomeric quadruplex DNA and inhibition of telomerase by a platinum-phenanthroline complex[J].Chemical Communications,2007,(42):4366-4368.
[10]ZHU L N,ZHAO S J,WU B,et al.A new cationic porphyrin derivative (TMPipEOPP) with large side arm substituents:A highly selective G-quadruplex optical probe[J].PLoS One,2012,7(5):e35586.
[11]ZHU L N,WU B,KONG D M.Specific recognition and stabilization of monomeric and multimeric G-quadruplexes by cationic porphyrin TMPipEOPP under molecular crowding conditions[J].Nucleic Acids Research,2013,41(7):4324-4335.
[12]WEI C Y,WANG J H,WEN Y,et al.4-(1H-Imidazo[4,5-f]-1,10-phenanthrolin-2-yl)phenol-based G-quadruplex DNA binding agents:Telomerase inhibition,cytotoxicity and DNA-binding studies[J].Bioorganic & Medicinal Chemistry Letters,2013,21(11):3379-3387.
[13]WEI C Y,WANG Y B,ZHANG M Y.Synthesis and binding studies of novel di-substituted phenanthroline compounds with genomic promoter and human telomeric DNA G-quadruplexes[J].Organic & Biomolecular Chemistry,2013,11(14):2355-2364.
[14]WEI C Y,WANG J H,ZHANG M Y.Spectroscopic study on the binding of porphyrins to (G4T4G4)4 parallel G-quadruplex[J].Biophysical Chemistry,2010,148(1-3):51-55.
[15]马贵斌,高飞,任斌知,等.荧光法研究药物分子与人血清白蛋白的结合作用[J].化学学报,1995,53(12):1193-1197.
[16]陈国珍.荧光分析法[M].北京:科学出版社,1990:122.

