甘露糖正向筛选体系在巨尾桉遗传转化中的应用
张 乐, 庞 涛, 夏新莉
(北京林业大学 生物科学与技术学院,北京 100083)
转基因植物中选用安全性标记基因代替传统的负向选择标记基因受到许多研究者的关注。甘露糖正向筛选体系以甘露糖为筛选剂,磷酸甘露糖异构酶(Phosphomannose isomerase, PMI)基因为标记基因进行筛选。甘露糖对植物没有直接的毒害作用,它作为一种额外的糖源在己糖激酶的催化下转化为6-磷酸甘露糖,转化细胞在PMI 的催化下,6-磷酸甘露糖转化为可供植物细胞代谢的6-磷酸果糖,从而进入糖酵解途径被细胞利用[1]。非转化细胞由于没有PMI 基因不能将6-磷酸甘露糖转化成6-磷酸果糖,造成植物体内6-磷酸甘露糖大量积累,ATP 新陈代谢受阻,抑制糖酵解,植物生长受到抑制,从而区分转化细胞与非转化细胞。自从1998年Joersbo 等[2]将PMI/ 甘露糖阳性筛选系统用于甜菜转基因植物筛选以来,现已应用于甘蔗、拟南芥[3-4]等多种植物的遗传转化筛选。磷酸甘露糖异构酶(PMI)只存在于少数豆科植物中[5],因而PMI 基因可以作为标记基因用于巨尾桉转化筛选试验中。
巨尾桉(Eucalyptusgranddis×E.uophylla)属桃金娘科落叶乔木,巨桉和尾叶桉的杂交种[6-7]。本研究利用从大肠杆菌中克隆的PMI基因构建了植物表达载体,建立甘露糖为筛选标记的甘露糖正向选择体系,并在巨尾桉的遗传转化中进行了初步应用。
1 材料与方法
1.1 试验材料
实验所需巨尾桉组培苗由国家林业局桉树研究开发中心提供。
参照GenBank 上公布的PMI 基因序列,通过PCR 从大肠杆菌中已成功克隆6-磷酸甘露糖异构酶(6-phosphomannose isomerase, PMI)基因,由作者实验室保存。
根癌农杆菌(Agrobacteriumtumefaciens)EHA105 菌株,植物表达载体pCAMBIA1301-PMI 由作者实验室保存。
1.2 愈伤组织诱导和不定芽分化
MS 培养基作为愈伤诱导培养的基本培养基,选用TDZ与NAA设计不同浓度正交试验,剪取长度约1 cm桉树茎段接种于不同激素配比的愈伤诱导培养基,统计愈伤形成及芽分化情况。每种浓度培养分别进行3次重复。
1.3 生根培养
1/2 MS 培养基作为基本培养基,选用NAA与IBA设计不同浓度正交试验,将经过分化培养生长健壮的无菌苗接种于培养基上诱导生根,进行生根率的统计分析。
1.4 甘露糖选择压的确定
遗传转化之前进行甘露糖敏感性测试,获得最佳筛选浓度,以便确定巨尾桉对甘露糖的天然耐性。以MS 培养基为基本培养基,甘露糖与蔗糖比例分设13 个梯度,观察愈伤形成及出芽情况。
1.5 遗传转化
剪取灭菌后的巨尾桉茎段,接种于愈伤诱导培养基中,避光培养1 d;将菌体离心后悬浮,经预培养的茎段浸于菌体悬浮液中25~30 min;侵染后的茎段接种至含有羧苄青霉素(Carbenicillin,Car)200 mg/L的甘露糖筛选培养基中,避光培养。
1.6 抗性转化植株分子鉴定
经CPR 法和PCR 检测初步确定转基因植株。CPR 检测参照Boscariol 等[8]的方法;CTAB 法提取基因组DNA 进行PCR 检测,设计引物:Ppmi-1:5′-GACTCTTGACCATGGATGCA-3′;Ppmi-2: 5′-CTTGAAG ATCTGAGGGTAAATTTC-3′。以质粒DNA 为模板的PCR 扩增产物作为阳性对照,未转化的拟南芥植株基因组DNA 为模板的PCR 扩增产物为阴性对照。
2 结果与分析
2.1 PMI基因及序列分析
根据NCBI 数据库提供的PMI基因序列设计引物,大肠杆菌基因组为PCR 扩增模板进行扩增反应。PCR 扩增产物回收后与PMD18-T 载体连接,重组质粒经酶切测序得到长度为1176 bp 的片段,编码391个氨基酸残基(图1)。与NCBI 上GenBank 中发表的已知核苷酸序列进行同源性比对,只有1091 处碱基出现差异,同源性达到99.91%;氨基酸序列比对后,同源性达到100%[4],该基因登录号为DQ146721。

图1 PMI基因碱基序列
2.2 愈伤诱导及出芽分化
以MS 培养基为基本培养基,设计不同激素配比的27种愈伤诱导培养基,30 d 后统计愈伤组织生长情况及芽分化情况(表1)。
由表1可知,TDZ 对巨尾桉的愈伤组织诱导具有显著的影响,TDZ 浓度取0.5 mg/L最为适宜,过低浓度的TDZ 会使愈伤组织发红,而过高浓度的TDZ 则导致芽分化率降低;NAA 对愈伤组织诱导影响不甚显著,但适当浓度的NAA 会增加芽的分化率。最佳的愈伤诱导与分化出芽培养基为MS+TDZ0.5 mg/L+NAA0.1 mg/L(图2)。
2.3 生根培养

表1 不同浓度TDZ、NAA对愈伤诱导及分化的差异显著性分析
注:(1)表中数据为10次重复平均值±标准差;(2)同列数据后小写英文字母不同者表示经LSD 法检验差异极显著,下同。

图2 愈伤组织形成(A)与分化出芽情况(B)
生根是保证苗木移栽成活的重要程序,分化出的根系的类型、长度及质量等均是影响移栽成活率的重要因素。以1/2 MS培养基为基础培养基,设计9种生根培养基,30 d后观察生根情况(表2)。
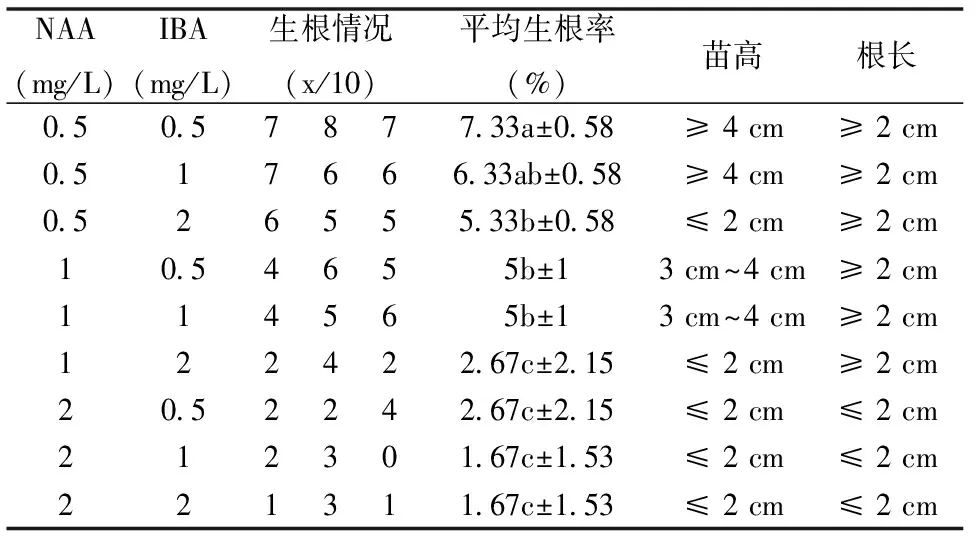
表2 不同浓度NAA、IBA对生根的差异显著性分析
由表2可知,NAA及IBA对于巨尾桉芽的生根均具有显著影响,随着NAA浓度的升高,生根率逐渐降低,生根质量亦逐渐变差,根也变得越来越短,说明低浓度的NAA对巨尾桉生根有促进作用,而浓度较高则会抑制生根;IBA对植株生根也具有明显的促进作用,浓度过高时则会抑制根和无菌苗的生长。诱导巨尾桉芽生根的最佳培养基是1/2MS+NAA0.5 mg/L+IBA0.5 mg/L(图3)。

图3 巨尾桉生根情况
2.4 甘露糖选择压的确定
由表3 可知,在不添加甘露糖的培养基中,80% 诱导愈伤出现,芽分化情况良好;随着甘露糖比例的逐渐增加,蔗糖含量减少,诱导愈伤率逐渐降低,但差异不明显;芽分化能力较弱,出现生长缓慢乃至停滞现象;当甘露糖浓度达到11 g/L 时,愈伤组织诱导情况明显变差,芽亦停止分化。只有当甘露糖浓度达到能够完全抑制愈伤组织诱导的临界水平,才能区分转化与非转化细胞,蔗糖与甘露糖比例定为19∶11。
2.5 遗传转化
巨尾桉茎段经侵染后接种在含有Car 200 mg/L 的甘露糖筛选愈伤诱导培养基中,经愈伤诱导,分化出芽,继代培养至生根培养筛选后初步得到待测阳性植株。
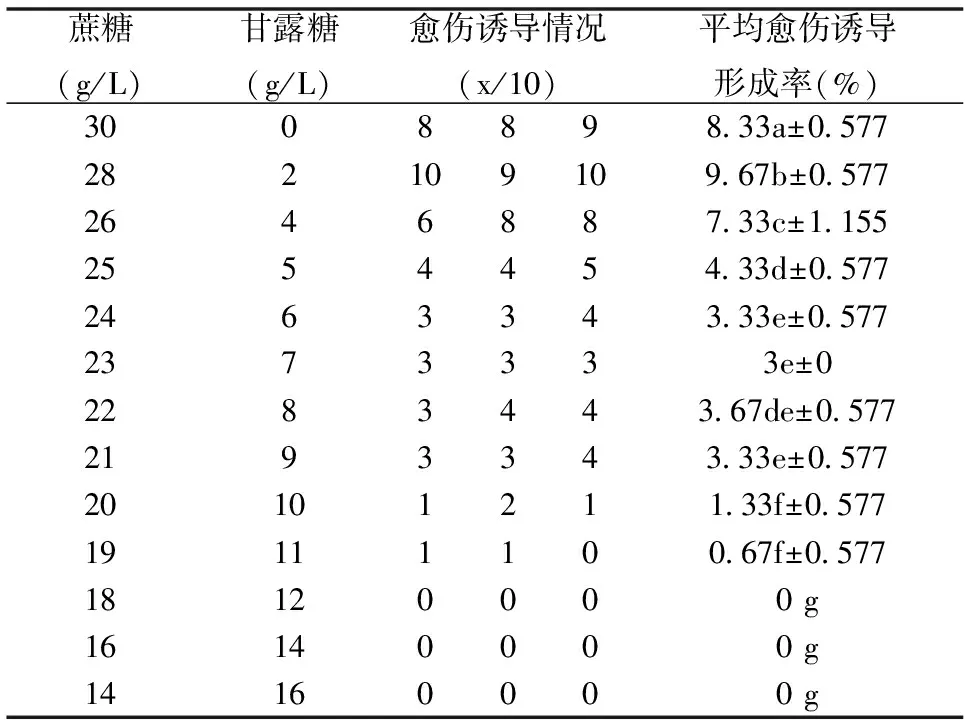
表3 不同浓度甘露糖对巨尾桉愈伤形成的差异显著性比较(LSD)
2.6 抗性转化植株分子鉴定
2.6.1 氯酚红(CPR)法检测 选取46 株待测转基因植株叶片用于显色反应,部分显色图(图4),经CPR 法染色后出现黄色或桔红色的有14 棵阳性株系,阳性率为34.78%。

1—非转基因叶片;2-7—转基因株系的叶片。

M—DNA Marker III;1—阴性对照(CK);2-8—转基因待测株系;9—阳性对照。
图5转基因巨尾桉PCR检测结果
Fig 5 PCR analysis of transgenic plants
2.6.2 PCR 检测 经CPR 法筛选出的14 棵阳性株系,剪取少量叶片提取基因组DNA 并进行PCR 检测,结果显示12 棵植株出现大小相对应的特异性条带,遗传转化率达到26.09%,部分检测结果(图5)。
3 结论与讨论
甘露糖正向筛选过程中,非转化细胞只是出于碳饥饿状态,不会出现坏死,促使转化细胞快速生长,来达到筛选目的。不同植物对总碳源量的要求,以及所需的甘露糖筛选压最适浓度都不尽相同。Negrotto 等[9]转化玉米时筛选培养基中碳源的最佳组合为10 g/L 甘露糖+5 g/L 蔗糖;Lucca 等[10]转化水稻时,在保持甘露糖浓度不变(30 g/L)的前提下,蔗糖浓度逐次递减至5 g/L,转化效率达到最优;Todd 和Tague[11]转化拟南芥时甘露糖浓度仅为2 mmol/L;Kim 等[12]辣椒转化过程中碳源最佳组合为15 g/L 甘露糖+20 g/L 蔗糖;番茄AV6 转化时[13],30 g/L 蔗糖添加3 g/L 甘露糖。本实验最终确定MS 培养基添加糖源蔗糖与甘露糖比例为19∶11,只有当甘露糖浓度达到能够完全抑制愈伤组织诱导的临界水平,才能区分转化与非转化细胞。甘露糖筛选浓度较低时,假阳性比例较大,筛选效果不明显;而如果浓度过大又会抑制植物生长,此时适当比例的蔗糖会缓解甘露糖的抑制作用。
植物组织培养过程中,植物生长调节剂至关重要。同时,不同种类生长素和细胞分裂素的组合比例以及它们的绝对浓度都能影响细胞生长和分化[14]。通过对愈伤组织诱导与出芽分化过程中外源植物激素TDZ 与NAA 以及生根过程中IBA 与NAA 的浓度配比的调整,确定最优激素配比为TDZ0.5 mg/L+NAA0.1 mg/L,生根过程中为NAA0.5 mg/L+IBA0.5 mg/L,优化了巨尾桉组织培养与再生体系,愈伤形成及出芽率达到76.7%,生根率达到73.7%。
本研究首次将PMI/ 甘露糖筛选体系应用于木本植物巨尾桉的遗传转化中,在以农杆菌介导的巨尾桉遗传转化过程中,选用适宜的甘露糖浓度筛选转化植株,桉树遗传转化的阳性率达到26.09%,有效解决桉树基因工程育种中遗传转化率低的瓶颈障碍,应用前景广阔。
参考文献:
[1]Reed J, Privallel M, Powel L, et al. Phosphomannose isomerase: an efficient selectable marker for plant transformation[J]. In Vitro Cell Dev Boil Plant, 2001, 37(2): 127-132.
[2]Joersbo M, Donaldson I, Kreiberg J, et al. Analysis of mannose selection used for transformation of sugar beet[J]. Molecular Breeding, 1998, 4(2): 111-117.
[3]Jain M, Chengalrayan K, Abouzid A, et al. Prospecting the utility of a PMI/ mannose selection system for the recovery of transgenic sugarcane plants[J]. Plant Cell Rep, 2007, 26(5): 581-590.
[4]杨彩云, 尹伟伦, 夏新莉. 甘露糖正向筛选体系的建立及在拟南芥遗传转化中的应用[J].分子植物育种, 2009, 6(7): 1120-1129.
[5]高世武, 阙友雄, 郭晋隆, 等. 甘露糖筛选系统的建立及在甘蔗转基因中的应用[J]. 热带作物学报, 2010, 31(5): 789-796.
[6]祁述雄. 中国桉树[M]. 北京: 中国林业出版社, 2006.
[7]Prakash M G, Gurumurthi K. Genetic transformation and regeneration of transgenic plants from precultured cotyledon and hypocotyl explants ofEucalyptustereticornisSm using agrobacterium tumefaciens [J]. In Vitro Cell Dev Biol Plant, 2009, 45(4): 429-434.
[8]Boscariol R L, Almeida W A B, Derbyshire M T V C, et al. The use of the PMI/ mannose selection system to recover transgenic sweet orange plants[J]. Plant Cell Rep, 2003, 22(2): 122-128.
[9]Nerotto D, Jolley M, Beer S, et al. The use of phosphomannose isomerase as a selectable marker to recover transgenic maize plants via agrobacterium transformation [J]. Plant Cell Reports, 2000, 19(8): 798-803.
[10]Lucca P, Ye X.D, Potrykus I. Effective selection and regeneration of transgenic rice plants with mannose as selective agent[J]. Molecular Breeding, 2001, 7(1): 43-49.
[11]Todd R, Tague B W. Phosphomannose isomerase: a versatile selectable marker forArabidopsisthalianagerm-line transformation[J]. Plant Mol Biol Rep, 2001, 19(4): 307-319.
[12]Kim J Y, Jung M, Kim H S, et al. A new selection system for pepper regeneration by mannose[J]. Plant Biotechnol, 2002, l4(3): 129-134.
[13]岳建雄, 孟钊红, 张炼辉, 等. 以甘露糖作为筛选剂的棉花遗传转化[J]. 棉花学报, 2005, 17(1): 3-7.
[14]欧阳乐军, 李琼华, 黄真池, 等. 3种抗生素对尾巨桉愈伤组织诱导及植株再生的影响[J]. 西北农林科技大学学报, 2012, 40(2): 79-84.

