支架置入术治疗锁骨下动脉狭窄/闭塞合并相邻椎动脉起始部狭窄病变——回顾性病例系列分析和随访
万 跃 刘艳霞 彭小祥 严 丹 左 靖
锁骨下动脉及椎动脉起始部是动脉粥样硬化所致的动脉狭窄/闭塞的好发部位。椎动脉起始部粥样硬化性狭窄是后循环缺血性卒中的最主要原因之一,若患者同时伴有锁骨下动脉重度狭窄或闭塞会更加剧后循环的缺血症状[1]。单独血管内治疗锁骨下动脉狭窄/闭塞性病变或椎动脉起始部狭窄已见大量报道,本研究通过回顾性病例系列研究,分析一组支架置入术治疗锁骨下动脉狭窄/闭塞合并相邻椎动脉起始部狭窄患者的临床和随访资料,以了解血管内支架治疗对这类患者的疗效。
1 资料与方法
1.1 病例选择和资料收集
收集2008年1月~2012年12月在武汉大学附属中山医院脑血管病介入治疗中心接受血管内支架置入术治疗锁骨下动脉狭窄/闭塞合并相邻椎动脉起始部狭窄患者的资料。纳入标准:(1)一侧锁骨下动脉狭窄(≥70%)或闭塞合并相邻椎动脉起始部狭窄(≥70%);(2)有相应的临床症状或体征;(3)接受支架置入治疗。排除标准:其它原因,如多发性大动脉炎、纤维肌性发育不良和椎动脉串联性病变和椎动脉颅内段已闭塞。记录患者的人口统计学特征、既往病史、血管危险因素,锁骨下动脉狭窄/闭塞和椎动脉起始部狭窄的部位和特点,支架置入术的操作步骤和围手术期安全性以及随访资料。本研究获医院伦理委员会批准。
纳入的患者主要根据临床症状、体征和无创性影像学检查[如颈部血管彩超、颅内血管经颅多普勒超声(TCD)、CT血管造影(CTA)]以及数字减影血管造影(DSA)明确狭窄闭塞的部位、性质和程度,所有患者术前均行头颅CT和(或)MRI扫描。
1.2 介入操作
所有患者均在支架置入前签署知情同意书。术前口服拜阿司匹林100 mg+氯吡格雷75 mg,1次/d,至少持续3 d。术后继续双联抗血小板治疗至少6月,以后选用其中一种长期服用。如锁骨下动脉为狭窄病变,常规消毒铺巾,局麻下采用改良Seldinger技术穿刺股动脉成功后置入8 F动脉鞘,全身肝素化行病变侧锁骨下动脉造影,再次确认狭窄程度。在0.035导丝导引下将8 F导引导管置于锁骨下动脉狭窄的近段,将0.014微导丝小心通过椎动脉狭窄段达到椎动脉远段,同时将0.018微导丝通过锁骨下动脉狭窄段到达腋动脉以远端,沿着0.018微导丝将选择好的球囊送至锁骨下动脉狭窄处,在命名压下预扩张后造影预扩张的结果,再沿着0.014微导丝将球囊扩张支架(Express支架:Boston Scientific,美国;Palmaz支架:强生Cordis,美国)送至椎动脉起始部狭窄处,确认位置满意后,小心释放支架。然后撤出0.014微导丝,沿着0.018微导丝将自膨式支架(Wallstent支架:Boston Scientific,美国;Precise支 架:强 生Cordis,美 国;Protégé支 架:EV3,美国)送达狭窄处,支架要跨过椎动脉起始部或两支架呈V形,再次确认位置满意后,小心释放支架,复查造影若残余狭窄>30%,则选用合适球囊后扩张;如锁骨下动脉为闭塞病变,采用桡动脉和股动脉联合入路,将6 F指引导管在0.035导丝引导下置于近锁骨下动脉闭塞远心端,用0.035及0.014微导丝反复尝试穿过病变部位,在尝试过程中不断扭控导丝以防止进入膜下引起夹层,在成功穿过病变部位后先用小球囊(2 mm)预扩张以便支架或大球囊通过,再采用股动脉路径如上所述置入支架。支架置入均未使用栓子保护装置。此外有部分指征的对侧椎动脉起始部狭窄病变也进行支架置入治疗。
1.3 术后随访和指标定义
在术后第1、3、6和第12个月进行门诊或住院随访,此后每年随访1次。随访时记录患者的临床症状、体征、用药情况及无创性影像学检查。如在随访过程中临床症状或无创性影像学检查提示再狭窄,则行DSA检查。
支架内再狭窄定义为支架置入术后狭窄程度再次≥50%。技术成功定义为支架置入术后残余狭窄<30%;临床成功定义为技术成功的基础上,与锁骨下动脉狭窄/闭塞合并相邻椎动脉起始部狭窄相关的症状完全消失。首次血管成形通畅定义为初次支架置入术后血管始终保持通畅,未出现再狭窄。再次血管成形通畅定义为发生再狭窄的病变经再次血管成形治疗后血管实现通畅。主要的临床相关事件定义为各血管床病变引起的所有新发心脑血管事件或症状复发,以及各种原因导致的死亡。
1.4 统计学处理
采用SPSS17.0。计量资料如年龄、双上肢血压差值、病变长度等用¯x±S表示;计数资料如病例数和病变数等以频数或百分数表示。
2 结 果
2.1 患者的病变特点
共纳入28例一侧锁骨下动脉狭窄/闭塞合并相邻椎动脉起始部狭窄患者,其中男19例,女9例,平均年龄(65±9)(47~78岁)。介入治疗指征包括后循环缺血(60.7%)、患侧上肢缺血(78.6%)和缺血性脑卒中/短暂性脑缺血发作(TIA)(35.7%)。23例(82.1%)患者存在1个以上与锁骨下动脉狭窄/闭塞合并相邻椎动脉起始部狭窄相关的临床症状和体征,12例(42.9%)患者存在同侧椎动脉逆向血流。表1对患者的人口统计学特征、血管危险因素、并存疾病、临床症状和主要介入指征等基线资料进行了归纳。

表1 28例锁骨下动脉狭窄/闭塞合并相邻椎动脉起始部狭窄患者的基线资料

表2 28例锁骨下动脉狭窄/闭塞合并相邻椎动脉起始部狭窄患者的支架治疗和随访资料
本组28例患者中DSA共检出23例锁骨下动脉狭窄合并相邻椎动脉起始部狭窄病变,其中有4例合并双侧锁骨下动脉病变,有2例合并双侧椎动脉起始部病变,其中1例对侧椎动脉起始部狭窄大于60%进行了干预治疗;另有5例锁骨下动脉闭塞合并相邻椎动脉起始部狭窄,有2例合并对侧锁骨下动脉狭窄,但其狭窄程度均小于50%,因此未进行干预治疗。所有锁骨下动脉病变均位于椎动脉开口近端。
2.2 近期转归
2.2.1 技术成功率和临床成功率
总的技术成功率为92.9%,其中狭窄患者为95.7%,完全闭塞患者80%。支架置入后,平均狭窄由(80.3±9.3)%降至(9.9±18.2)%。技术失败2例,其中1例为左锁骨下动脉完全闭塞的患者,反复尝试后导丝仍无法穿过;另外1例技术失败为左锁骨下动脉狭窄段呈锐角,支架置入并球囊后扩张后因血管弹性回缩而导致残余狭窄,狭窄程度>30%。在技术成功的患者中,临床成功率为84.6%,其症状术后明显缓解,双侧血压差值由(39.2±14.6)mmHg降至(7.5±13.8)mmHg;4例临床失败主要是术后患者头晕症状无缓解。
2.2.2 并发症
围手术期发生并发症2例,其中1例在锁骨下动脉完全闭塞合并左椎动脉开口重度狭窄患者在术后出现左眼偏盲,血管造影未见颅内大动脉闭塞,未行溶栓治疗,次日行MRI示枕叶小的梗死灶,药物治疗2周恢复良好;1例发生穿刺部位假性动脉瘤,在超声引导下进行压迫后闭塞。
2.3 远期随访
27例支架置入的患者平均随访(24±18)个月(6-55个月),其中2例患者1年后失访,1例2年后失访,这些患者以12、24个月作为截断值纳入分析。
2.3.1 再狭窄和血管通畅率
术后12、24个月和最后随访时的首次血管成形通畅率分别为92.4%、82.5%、78.8%。有3例发生再狭窄,其中无症状2例,有症状1例。无症状再狭窄患者,左右锁骨下动脉各1例,有症状1例是左锁骨下动脉完全闭塞合并左椎动脉开口狭窄患者,术后6个月时发现再狭窄,表现为后循环缺血症状,行球囊扩张成形术并加用他汀类和普罗布考药物,直到最后随访,血管仍保持通畅。
2.3.2 临床相关事件及无相关事件存活率
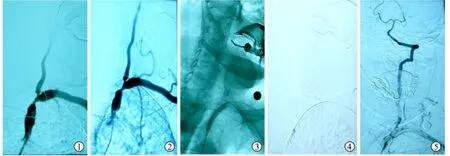
图1 男性,62岁,反复头晕伴左上肢不适6个月。左锁骨下动脉造影示左锁骨下动脉及相邻椎动脉起始部重度狭窄 图2 锁骨下动脉狭窄置入Protege自膨式支架(10 mm×30 mm)后造影,显示狭窄改善,但仍有大于30%的残余狭窄 图3 将微导丝置于椎动脉V2段,于锁骨下动脉狭窄处后扩张后造影,锁骨下动脉管径恢复 图4 椎动脉起始部置入Express球扩式支架(6 mm×15 mm)后的双支架形态 图5 支架置入后即刻造影,显示锁骨下动脉及椎动脉起始部管径恢复,血流通常
术后12、24个月和最后随访时的无相关事件存活率分别为92.5%、78.6%、70.5%。随访期间共发现5例临床相关事件,其中1例为前面提到的枕叶梗死;另外4例患者中有2例患者分别在术后8和21个月出现脑梗死;1例患者出现TIA,经药物治疗缓解;1例患者行冠状动脉支架置入术。
3 讨 论
锁骨下动脉狭窄/闭塞合并相邻椎动脉起始部狭窄是一种常见的临床现象,多数为动脉粥样硬化造成。由于椎动脉起始部狭窄与锁骨下动脉相连或相邻,在扩张锁骨下动脉狭窄处时,难免会损伤椎动脉起始部,使其狭窄加重,甚至有可能使其闭塞。血管内支架置入术治疗椎动脉起始部动脉硬化斑块所致的狭窄已经在临床上广泛应用,并取得良好的疗效[2,3]。虽然近10年来介入技术和设备有了很大进步,但对于锁骨下动脉完全闭塞的病变,血管内介入治疗仍然是一个挑战。在回顾性病例系列中,本研究的技术成功率高达92.9%,其中狭窄患者为95.7%,完全闭塞患者80%,这些数据与以往报道的相近[4~6]。但同时置入支架技术相对复杂,椎动脉起始部置入支架要求精确定位,一旦支架释放后定位出现偏差,锁骨下动脉的支架就无法置入。而右锁骨下动脉狭窄或闭塞,由于距右侧颈总动脉起始部很近,支架置入球囊扩张治疗就较危险[7]。但本研究的1例右锁骨下动脉狭窄合并相邻右椎动脉起始部狭窄成功置入支架,临床上也取得了不错效果。开通闭塞的锁骨下动脉相对困难,但开通后在临床上往往有较好的效果[8]。对于锁骨下动脉闭塞病变,本研究采用股/桡动脉联合入路并取得了较高的治疗成功率,本研究的5例锁骨下动脉完全闭塞患者中就有4例开通。不同文献报道的锁骨下动脉完全闭塞的再通率存在差异,其中最近一项研究的技术成功率高达87%[9~11]。Michael报道了1例锁骨下动脉完全闭塞的患者,采用前引导管通过顺血流路径成功实现了再通[12]。
本组有2例发生了较严重的并发症,并发症发生率7.1%,未发生严重脑卒中和死亡。其中1例本研究考虑是由于左锁骨下动脉完全闭塞,在反复尝试穿越闭塞病变后,由于狭窄严重,预扩张不充分,置入支架后残余狭窄>50%,对此本研究又采取后扩张技术,附在支架的小斑块脱落阻塞了远端小动脉。
本组患者的临床成功率为84.6%,而术后12、24个月和最后随访时的无临床相关事件存活率分别为92.5%、78.6%、70.5%,这些数据低于以往报道[5,6]。本组4例临床失败患者均与顽固性头晕不能缓解有关。一项研究显示,约20%支架置入的锁骨下动脉或椎动脉狭窄患者头晕症状很难缓解[13]。脑灌注成像检查可能有助于澄清这些患者顽固性头晕的真正原因。
本组病例在随访过程中共发现3个再狭窄病变,其中2例再狭窄患者合并有糖尿病,提示再狭窄可能与糖尿病所致血管内膜增生有关。本研究由于样本量较小,无法进行统计学分析。此外,本研究也未发现可能与再狭窄有关的其它危险因素。
本研究对支架位置准确性的要求比较高。特别注意当在椎动脉起始部置入支架时,应在完全覆盖狭窄病变的基础上,突入锁骨下动脉的部分要尽可能的少一些。这样才不至于影响释放锁骨下动脉的支架。有作者报道,可在椎动脉起始部支架到位后,先在锁骨下动脉内置于球囊,充起球囊后,回拉椎动脉起始部支架再释放[14],使突入锁骨下动脉的部分更容易控制。治疗锁骨下动脉狭窄,本研究均选用自膨式支架。因自膨式支架容易弯曲,更适合用于扭曲受压的血管[15],对突入锁骨下动脉内的椎动脉起始部支架的影响要小一些。另有作者报道,对突入锁骨下动脉内的椎动脉起始部的支架要适当长一些,能用锁骨下动脉支架将其压住,效果可能会更好[16]。
总之,本组资料提示,血管内支架置入可安全和有效治疗锁骨下狭窄/闭塞合并相邻椎动脉狭窄的患者。然而,本研究是样本量较小的回顾性病例系列分析,无法通过统计学分析得出结论,因此有必要开展扩大样本的多中心前瞻性长期随访研究,以评估这些患者接受支架治疗后的远期临床转归。
1 Savitz SI,Caplan LR.Vertebrobasilar disease.N Engl J Med,2005,352(2):2618-2626.
2 Lin YH,Hung GS,Tseng WY,et al.Safety and feasibility of drug-eluting stent implantation at vertebral artery origin:the first case series in Asians.J Formos Med Assoc,2008,107(3):253-258.
3 周志明,徐格林,刘新峰.缺血性脑血管病介入治疗的新进展.中华神经医学杂志,2009,8(12):1294-1296.
4 Patel SN,White CJ,Collins TJ,et al.Catheter-based treatment of the subclavian and innominate arteries.Catheter Cardiovasc Interv,2008,71:963-968.
5 Wang KQ,Wang ZG,Yang BZ,et al.Long-term results of endovascular therapy for proximal subclavian arterial obstructive lesions.Chin Med J(Engl),2010,123:45-50.
6 Sixt S,Rastan A,Schwarzwalder U,et al,Long term outcome after ballon angioplasty and stenting of subclavian artery obstruction:a single centre experience.Vasa,2008,37:174-182.
7 De Vries JP,Jager LC,Vanden Berg JC,et al.Durability of percutaneous transluminal angioplasty for obstructive lesions of proximal subclavian artery:long-term results.J Vasc Surg,2005,41(1):19-23.
8 戚继胜,缪中荣,吉训明,等.血管内支架治疗锁骨下动脉闭塞的临床观察.中国脑血管病杂志,2006,3(10):459-461.
9 Sixt S,Rastan A,Schwarzwalder U,et al.Results after balloon angioplasty or stenting of atherosclerotic subclavian artery obstruction.Catheter Carddiovasc Interv,2009,73:395-403.
10 Babic S,Sagic D,Radak D,et al.Initial and long-term results of endovascular therapy for chronic total occlusion of the subclavian artery.Cardiovasc Intervent Radiol,2011.
11 Motarjeme A.Percutaneous transluminal angioplasty of supraaortic vessels.J Endovasc Surg,1996,3:171-181.
12 Michael TT,Banerjee S,Brilakis ES,Use of the frontrunner catheter to cross a chronic total occlusion of the left subclavian artery.Hellenic J Cardiol,2011,52:86-90.
13 Wholey MH,Wholey MH.The supraaortic and vertebral endovascular interventions.Teah Vasc Interv Radiol,2004,7:215-225.
14 Biria M,Tadros P,Gupta K.Subclavian-vertebrul artery bifurcation stenting using drug-eluting stents:a report of two cases using different techniques.J Invasive Cardiol,2007,19(6):156-159.
15 Woo EY,Fairman RM,Velazquez OC,et al.Endovascular therapy of symptomatic innominate-subclavian arterial occlusive lesions.Vasc Endovascular Surg,2006,40(1):27-33.
16 Roguin A,Alhaddad IA.Crush stenting of bifurcational left subclavian-vertebral artery stenosis.Catheter Cardiovasc Interv,2004,62(3):393-395.

