六种红树植物原位根系及根际土酚酸总量比较分析*
刘 玉,李艳萍,黄雄飞,彭逸生,夏北成
(中山大学环境科学与工程学院∥广东省环境污染控制与修复技术重点实验室,广东 广州 510275)
植物对根际微生态及根际微生物的影响猜测与其根系分泌物(Root Exudates)密切相关。通过根泌物的组成成分和含量对周围微生境产生影响,包括化感作用(allelopathy)的影响。多种高等水生植物如凤眼莲(Eichhorniacrassipes)等37种能通过分泌、释放化感物质来抑制藻类生长[1-2]。
植物根泌物种类繁多,并且会因物种、生长阶段、营养状况、微生物种数、土壤状况、光照及温度、空气成分等因素的改变而出现很大的差异。根据已发表的对多种植物的研究成果[3-7],本研究将已被鉴定的根泌物成分综合分成八大类:糖类、甾醇类、酶类、有机酸类、核苷酸和黄酮类、生长因子、无机物、其他(糖苷、皂苷、氢氰酸、荧光物质、生长调控物、植物抗毒素、麦根酸类植物铁载体等)。在各类分泌物中,以有机酸类的化合物种数最多和组成最复杂、分类杂乱,因此,本研究将有机酸类概括分为四大类,包括脂肪酸、氨基酸、羧酸和酚酸。
有机酸广泛存在于植物根泌物中,由于有机酸类分析相对较简单且对根系生态有很强的调控作用,因此,对根泌物的研究多从有机酸类开始。但对红树植物根泌物的有机酸类的研究目前基本上仍处于起步阶段,仅卢豪良等对秋茄根泌物进行了低分子量有机酸且主要是羧酸类的分离鉴定[8]。由于迄今为止尚未见对红树植物酚酸类的研究报道,因此,本研究重点对红树植物酚酸类进行分析和研究。
酚酸类物质在植物界中广泛分布,在多种植物根泌物中被证实是化感活性较强的一类物质,但在红树植物中相关酚酸类根泌物的研究起步较迟,李春强用正红树(Rhizophoraapiculata)根泌物对中肋骨条藻(Skeletonemacostatum)进行室内化感实验,推测化感作用的强弱与正红树之总酚含量有关但不成正比,也没有测定出总酚的含量[9]。
此外,大多根泌物的研究都采用室内植物生长模拟实验,虽然室内模拟容易控制变量,但与原位状况尚有较大差异。红树是否能通过根系分泌作用将酚酸释放到环境中,从而影响水体及土体中其他生物的生长,本文拟通过对红树根系微域区的酚酸总量分析来回答。原位采集广东湛江国家级自然保护区内六种建群红树植物的根系、根际土与非根际土及对照潮沟样品,测定各样品中酚酸总量,分析红树植物根系分泌酚酸的特点,判断其可能产生的生态效应,对厘清红树林生态机制尤其对根系微生态的作用机制具有重要意义。
1 材料与方法
1.1 研究区域概况
广东省湛江红树林国家级自然保护区位于廉江市高桥镇,是现今国内面积最大的红树林自然保护区,处于北亚热带与南亚热带过渡区,地理位置为东经109°41′20″-110°30′19″,北纬20°14′06″-2l°34′15″,总面积20 278.8 hm2[10]。保护区红树林区系属于东方类群,有真红树和半红树20多种。
1.2 采样时间与采样范围
于2012年10月17日-23日在6种红树林内采样。本次采样选择6种纯林红树桐花树(Aegicerascorniculatum)、秋茄(Kandeliacandel)、木榄(Bruguieragymnorrihiza)、红海榄(Rhizophorastylosa)、白骨壤(Avicenniamarina)、无瓣海桑(Sonneratiaapetala)进行。
1.3 六种红树根系、根际土、非根际土采样
在退潮时进行采样。每种红树选择3个采样点(即3株红树植物),挖取完整树根系,刮净根上附泥,将所得根系剪断放塑料袋中作为根系样品(roots),每棵树采集根系50 g左右。根际土(rhizosphere soil)为根上附泥及根系1 cm内土。非根际土(non-rhizosphere soil)则为根系外1 cm土,五点采样法用改装后的60 mL注射器(去除针头端)垂直插入土中,然后轻轻拔出,用注射器的推杆将柱状的泥土样推出,作为非根际土样品,每个点采集100 g左右。其中根系样品用于红树根系酚酸总量测定,土样品用于土中酚酸总量测定。对照点潮沟选择在红树林保护区的外围靠外海之处,同样选取3个采样点进行采样,每个样点相距500 m左右。
1.4 根系和土中酚酸总量测定
酚酸通常以游离态、可溶共价结合态以及束缚态存在[11]。考虑红树根系以根泌物的形式进入到环境,研究不能人为地用化学方法将不可溶部分提取出来从而提高根系分泌物组分浓度。因此,本文只分析可溶部分的红树根系酚酸。根系酚酸浸提剂主要有无机化合物和有机化合物两类。本研究参考比较多种方法,最终选定用NaOH溶液作酚酸浸提剂[11-14]。酚酸总量测定:采用铁氰化钾与三氯化铁显色法进行。利用酚酸化合物的酚羟基具有还原性的原理来进行总量的测定。酚酸化合物的还原性可将铁氰化钾与三氯化铁反应生成普鲁士蓝沉淀,在酸性条件下溶解,所得污绿色物质在730 nm具有最大吸光值[15-16]。
1.4.1 标准曲线制作 以没食子酸制作标准曲线,分别吸取0.0、0.4、0.8、1.0、1.4、1.6、2 mLρ为10 μg/mL没食子酸乙醇(φ=70%)溶液于10 mL常量瓶中,加入φ=70%乙醇至2 mL,加入0.8 mL 0.01 mol/L十二烷基硫酸钠(SDS)溶液、0.4 mL铁氰化钾-三氯化铁显色剂,摇匀,暗处静止5 min。1 mol/L醋酸稀释至刻度,摇匀,暗处静止30 min。以空白溶液作参比,50 min内,在730 nm处分光光度计测定其吸光度。以吸光度为横坐标,酚酸总量为纵坐标,制作酚酸总量标准曲线,得线性回归方程,y= 0.512x+ 0.014,R2=0.998。
1.4.2 样品制备及测定 将采回的红树根刷洗干净,自然风干后粉碎,过60目筛。土样自然风干研磨过40目筛。准确称取红树根系样品1 g,加入100 mLφ=70%乙醇,摇匀,室温静止24 h,超声提取1 h。过滤并用φ=70%乙醇清洗滤渣,合并滤液。滤液在-0.8 MPa 50 ℃条件下旋蒸至干,用φ=70%乙醇溶解梨形瓶中残留物质,定容至100 mL。
准确称取土样2 g,提取方法同根系总酚酸提取方法,最后定容至50 mL。
取适量(≤2 mL)样品测定酚酸总量,方法同标准曲线测定方法。按线性回归方程(2)计算酚酸总量。每个点设3个平行,求平均值。
1.5 主要仪器和试剂
主要仪器有:便携式GPS(合众思壮G330),超声仪(AutoScience,康洁CE-5200A),旋转蒸发仪(上海亚荣 RE-52AA),紫外分光光度计(日本岛津UV2450)。主要试剂有:乙醇>95%;丙酮、十二烷基硫酸钠(SDS)、三氯化铁(FeCl3)、铁氰化钾(K3[Fe(CN)6])、没食子酸(Gallic acid),分析纯;冰醋酸(Acetic acid),优级纯。
1.6 数据处理
数据用Excel、SPSS17.0分析处理,Excel作图。
2 结果与讨论
2.1 红树植物根系酚酸总量
六种红树根系酚酸总量见图1(误差线显示误差量百分比为5%)。六种红树植物中,以红海榄根系酚酸总量最高,平均值为8.84 mg/g。无瓣海桑与秋茄根系酚酸总量不稳定,无瓣海桑3个样品酚酸总量偏差最大,最高值为7.01 mg/g、最低值仅为3.71 mg/g。木榄与桐花树根系酚酸总量基本持平,木榄平均值为4.84 mg/g,桐花树平均值为4.69 mg/g,并且,两种红树三个样品酚酸总量稳定。较之,酚酸总量最低的为白骨壤,3个植物根系中酚酸含量最高为1.96 mg/g,最低仅为1.22 mg/g。
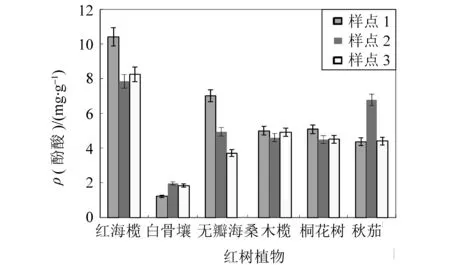
图1 六种红树植物根系酚酸含量
2.2 红树根际土与非根际土酚酸总量
六种红树植物根际土和非根际土酚酸总量如图2(误差线显示误差量百分比为5%)。可以看出,①在木榄和白骨壤样区,均显示出根际土酚酸总量小于非根际土;而在秋茄和桐花树,根际土酚酸总量均高于非根际土;无瓣海桑和红海榄均显示出有2株植物根际高于非根际。②木榄样区根际与非根际土壤酚酸总量平均值最高,分别为13.20 μg/g、20.12 μg/g;无瓣海桑酚酸总量平均值根际土小于非根际土,但两者差值最小(不足1 μg/g);秋茄林区根际土远高过非根际土。③在六种红树中,红海榄样区土壤酚酸含量最低,整体平均值为4.64 μg/g,根际土酚酸总量水平低于非根际土。④在18个样品中,只有8个样品酚酸总量根际高于非根际,10个样品中酚酸总量根际低于非根际。
2.3 红树林林内与林外潮沟土酚酸总量比较
六种红树林区与潮沟土酚酸总量测定结果如图3(误差线显示误差量百分比为5%)所示,不同红树样区土中酚酸总量整体水平不同。同种红树的根际土与非根际土酚酸总量也不同。在红海榄、白骨壤、无瓣海桑和木榄中,根际土酚酸总量小于非根际土中,而桐花树、秋茄则反之。木榄样区土中酚酸总量最高,样本整体平均值为16.66 μg/g;无瓣海桑样区土壤酚酸总量以10.06 μg/g居第二;桐花树、白骨壤样区土壤酚酸总量为第三、第四位,平均值分别为8.08、7.99 μg/g;秋茄样区土壤酚酸高于红海榄样区,平均值为6.01 μg/g,红海榄4.64 μg/g,为样区土壤酚酸总量最低。潮沟土酚酸总量平均值为8.71 μg/g,可见只有木榄和无瓣海桑样区酚酸总量高于潮沟。
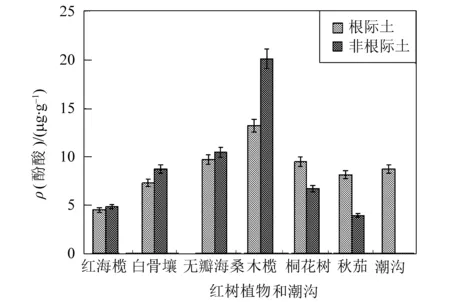
图3 六种红树根际土与非根际土与潮沟土中酚酸含量比较
3 讨 论
多数具有化感作用的酚酸均具有较强的水溶性和成盐性,在自然条件下易为土壤及植物根系所吸收,从而表现出化感作用[17],研究酚酸对于解释红树植物的化感作用具有重要意义。根系分泌物的原位研究一直是根际微域环境的前沿和难点[18]。
3.1 根系酚酸总量理论上应低于总酚含量
六种红树根系酚酸总量中以红海榄根系酚酸含量为最高,为8.84 mg/g,但均低于福建九龙江口秋茄老根材总酚含量(195.26±15.50) mg/g和幼根材总酚含量(119.15±2.29) mg/g,也低于广西山口与广东湛江红树植物红海榄成熟叶总酚含量200 mg/g。酚酸组成为总酚的一小部分,因此,本文得出的酚酸含量低于总酚实为正常。
3.2 根际土酚酸含量有可能低于非根际土中含量
根际是指受根系分泌物直接影响最强烈、在理化性质和生物学特性上明显地不同于其原土体的土壤微区域。总酚含量并非总呈现出根际土中含量高于非根际土中的特点,原因有诸多方面,如,环境胁迫、植物生长期、根际微生物效应、化感物质的吸附和解吸附现象等等。
磷胁迫下,向日葵根分泌物中酚类物质的含量显著增加[19]。万寿菊水分胁迫时,其酚类物质的含量明显高于在水分充足时的含量[20]。在3个大豆品种(H25、S10、K2)根泌物中共检测到2种酚酸,对羟基苯甲酸和香草酸。以H25的对羟基苯甲酸为例,在苗期、花期、鼓粒期、成熟期的含量分别为0.076 9、0.080 6、0.108 5、0.006 1 μg/mL。各品种成熟期对羟基苯甲酸的浓度均低于其它三个时期[21]。说明大豆向根际释放酚酸物质可能与植物的生长期和代谢活力有关。
苹果园土壤总酚含量的动态变化为根际土总酚含量高于非根际土。但也有研究表示,酚酸在土壤中是不稳定的。通过外源引入法研究了对羟基苯甲酸、香草酸、香草醛等酚酸类物质在土壤中的残留动态,发现上述酚酸很容易被土壤吸附或在微生物作用下转化为其它的物质,经过1周培养后各酚酸残留率仅为25%~17.5%,大部分酚酸已被微生物分解或被微生物的生长活动而消耗[22]。大多数情况下,植物根际微生物数量和代谢活性比原土体高,因而,有可能出现根际土酚酸含量低于非根际土中的现象。
此外,化感物质在土壤中的吸附和解吸附现象是非常复杂的。Cecchi用14C同位素标记研究了对羟基肉桂酸、阿魏酸、黎芦酸、香草酸、对羟基苯甲酸5种酚酸在7种土壤中的吸附和解吸附特性。试验显示,5种酚酸均出现了不同程度的解吸滞后现象,认为这种现象可能与土壤对5种酚酸的吸附不可逆性直接相关。吸附和解吸附现象高度依赖于有机质含量、酸碱性、金属氧化物含量及粘粒含量等土壤特性,其吸附动力学机制非常复杂,不能仅仅从土壤的某一特性进行判断[23]。酚酸类物质进一步降解为无毒性的化合物,其降解程度受到光、温、水、时间等环境因素的影响[24]。根泌物中能被迅速降解的占60%[25]。
一般情况下,红树根系分泌酚酸的总量浓度低于50 mg/L,可能会对根际微生物生长有促进作用,因而导致了酚酸的分解与转化。因而可能会出现根际土酚酸总量低于非根际土、红树林内的酚酸总量低于潮沟中的现象,主要可能是非根际土和潮沟中微生物种类和丰度都较低,因而对有机物的降解作用也较低的缘故。因此,根际土中酚酸含量有可能因微生物分解或土壤吸附及降解作用的综合作用而低于非根际土中含量。化感效应的发挥是在植物根系分泌能力远远超出土壤吸附能力和降解能力基础之上的最终结果。
3.3 红树植物根系中酚酸释放量很低
为了解红树根系是否会将其酚酸类物质释放入土壤,对根系酚酸总量与根际土酚酸总量做pearson相关性分析,发现相关程度均不同。其中,红海榄和桐花树呈正相关,但相关性并不显著,相关系数r/显著性p分别为0.729/0.480、0.961/0.179;而木榄、白骨壤、秋茄、无瓣海桑呈负相关且也不显著,分别为-0.823/0.385,-0.819/0.389,-0.974/0.146,-0.982/0.120。正相关说明红树根系有分泌作用,负相关说明根系分泌的酚酸很快降解,相关不显著说明分泌过程非常复杂。目前对此基本不了解,有待继续深入研究。
以红海榄根系酚酸总量平均值8 837.28 μg/g与根际土酚酸总量平均值4.46 μg/g相比较,可知,红海榄根系中只有极少量酚酸被分泌到根际土,百分释放量最低,仅为0.050 5%。其它5种红树的百分释放量分别为:桐花树0.201 6%、木榄0.272 8%、白骨壤0.435 5%、秋茄0.156 6%、无瓣海桑0.185 5%。所有样点酚酸总量都为根系中远远高于根际土及非根际土,根系中的酚酸释放量很低且不一定以相同比例释放进环境中,可能与具体树种、树龄、生长期、生长环境条件及分泌能力、酚酸与其它物质的共同作用有关。
3.4 化感物质来源广泛及多种化感物质共同作用
根系分泌物只是土壤中化感物质的来源之一,植物通过根茬腐解、茎叶淋洗等途径也可以向环境释放化感物质[26]。土壤中各类微生物的代谢活动也会释放化感物质。正红树中酚酸类化感物质可能并非红树粉抑藻的主要化学基础,还存在着其它化感物质同时起作用[9]。根际微域存在着诸多来源的化感物质且又存在着复杂的相互作用,目前在红树林的研究中对此知之甚少,属红树林根际微域环境的前沿和难点问题,有待进行学科交叉研究。
4 结 论
六种红树植物根系中以红海榄根系酚酸总量最高,平均值为8837.28 μg/g,白骨壤最低,平均值为1675.28 μg/g。根际土与非根际土中酚酸总量以木榄样区平均值最高,分别为13.20 μg/g、20.12 μg/g;红海榄样区最低,平均值分别为4.46 μg/g、4.81 μg/g。约55%的样品非根际土中酚酸总量高于根际土,根际土中酚酸含量可能因微生物分解或土壤吸附及降解的综合作用而低于非根际土中含量。红树植物根系酚酸百分释放量很低,红海榄仅为0.050 5%。对于复杂的根际系统,在化感物质的真正来源、分离鉴定及其在生态系统中的迁移形式等方面亟待研究,特别是进行实时监测和动态研究。
参考文献:
[1]FERRIER M D,BUTLER B R,TERLIZZI D E,et al.The effects of barley straw (Hordeumvulgare) on the growth of freshwater algae [J].Bioresource Technology,2005,96:1788-1795.
[2]胡光济,侯浩波,张维昊.淡水高等水生植物对浮游藻类化感作用评述[J].安全与环境工程,2010,17(4):3-11.
[3]涂书新,孙锦荷,郭智芬,等.植物根系分泌物与根际营养关系评述[J].土壤与环境,2000,9(1):64-67.
[4]陈龙池,廖利平,汪思龙,等.根系分泌物生态学研究[J].生态学杂志,2002,21(6):57-62.
[5]王美娥,周启星,张利华.污染物在根-土界面的化学行为与生态效应[J].应用生态学报,2003,14(11):2067-2071.
[6]林文雄,熊君,周军建,等.化感植物根际生物学特征研究现状与展望[J].中国生态农业学报,2007,15(4):1-8.
[7]王延平,王华田.植物分泌的化感物质及其在土壤中的环境行为[J].土壤通报,2010,41(2):501-507.
[8]卢豪良,严重玲.秋茄根系分泌低分子量有机酸及其对重金属生物有效性的影响[J].生态学报,2007,27(10):4173-4181.
[9]李春强,刘志昕,黎娟华,等.红树植物化感作用对中肋骨条藻生长的影响[J].热带作物学报,2009,30(6):862-867.
[10]缪绅裕.广东湛江红树林保护区植物群落生态研究[J].广州师院学报:自然科学版,1999,21(3):65-69.
[11]郝杰,张长虹,曹学丽.七种谷物麸皮中的酚酸类成分分析[J].食品科学,2010,31(10):263-267.
[12]阎飞,杨振明,韩丽梅.植物化感作用(Allelopathy)及其作用物的研究方法[J].生态学报,2000,20(4):692-696.
[13]张淑香,高子勤.连作障碍与根际微生态研究Ⅱ.根系分泌物与酚酸物质[J].应用生态学报,2000,11(1):152-156.
[14]谭秀梅,王华田,孔令刚,等.杨树人工林连作土壤中酚酸积累规律及对土壤微生物的影响[J].山东大学学报(理学版),2008,43(1):14-19.
[15]王胜春,蒋永培,迂苏宁,等.五灵丸中丹参总酚性成分的测定[J].第四军医大学学报,1993,14(5):386-387.
[16]黄喜茹,高洁,马骊,等.铁氰化钾-三氯化铁显色体系测定野生和栽培丹参及其制剂中水溶性酚酸总量[J].化学试剂,2007,29(9):532-534.
[17]YU J Q,MATSUI Y.Phytotoxic substances in the root exudates ofCacumissativusL[J].Journal of Chemical Ecology,1994(20):21-31.
[18]王小兵,骆永明,刘五星,等.花生根分泌物的鉴定及其化感作用[J].生态学杂志,2011,30(12):2803-2808
[19]KOEPPE E,SOUTHWICAKN L M,BITTELL D J E.The relationship of tissue chlorogenic acid concentrations and leaching of phenolics from sunflowers grown under varying phosphate nutrient conditions [J].Canadian Journal Botany,1976,54:593-599.
[20]TANG C S,YOUNG C C.Collection and identification of allelopathic compounds from the undisturbed root system of Bigalta limpograss (Hemarthriaaltissima) [J].Plant Physiology,1982,69(1):155-160.
[21]张俊英,王敬国,许永利.不同大豆品种根系分泌物中有机酸和酚酸的比较研究[J].安徽农业科学,2007,35(23):7127-7129,7131.
[22]张淑香,高子勤,刘海玲.连作障碍与根际微生态研究Ⅲ.土壤酚酸物质及其生物学效应[J].应用生态学报,2000b,11(5):741-744.
[23]CECCHI A M,KOSKINEN W C,CHENG H H,et al.Sorption-desorption of phenolic acids as affected by soil properties[J].Biological Fertil Soils,2004,39:235-242.
[24]CHOU C H,LIN H J.Autotoxication mechanism ofOryzasativaI.Phytototoxic effect of decomposing rice residues in soil [J].Journal of Chemical Ecology,1976,2:253-367.
[25]USELMAN S M,QUALLS R G,THOMAN R B.Effects of increased atmospheric CO2,temperature and soil N availability on root exudation of dissolved organic carbon by a N-fixing tree (RobiniapseudoacaciaL.) [J].Plant and Soil,2000,222:191-202.
[26]HYDER P W,FREDRICKSON E L,ESTELL M E,et al.Transport of phenolic compounds from leaf surface of creosotebush and tarbush to soil surface by precipitation [J].Journal of Chemical Ecology,2002,28:2475-2482.

