基于茎环引物定量检测miRNA的研究进展
,, , ,
(中国海洋大学食品科学与工程学院,山东青岛 266003)
miRNA是一类广泛存在于生物体内的非编码RNA,长度约为22nt。自1993年Lee等人[1]首先发现lin - 4基因表达的一种小RNA(lin - 4 RNA)以来,至今已报道的miRNA达到上万种。研究表明,miRNA在生物体内发挥着重要调节作用,如动物的神经系统发育和变态发育等生理过程与一些miRNA的表达有关[2 - 4]。另外,在疾病治疗,特别是癌症治疗中,miRNA作为标记物或基因药物也发挥了重要作用[5 - 7]。近期Zhang等人[8]以小鼠作为研究对象,对经口服摄入的植物miRNA的功能进行研究,惊喜的发现大米中的miRNA可以通过摄食在小鼠体内稳定存在,并发挥生理调节功能,miRNA因此被称作摄入的“信息”而再次引起关注。
随着生物信息学的发展,一些靶基因预测软件如TargetScan[9]、PicTar[10]、miRanda[11]和DIAN -microT[12]等,实现了对大量新的miRNA的预测[13]。然而,如需验证新预测的miRNA或研究已知miRNA表达量与功能间的关系,必须对其建立高效准确的定量方法。RNA印迹杂交法(Lee等[14])和基因芯片(Sun等[15])是研究miRNA表达的主要传统方法,但样品需求量大、线性范围和灵敏度有限(见表1)的突出缺陷限制了其应用。随着实时定量PCR(real time- quantitative PCR,RT - qPCR)技术的出现,推动了核酸定量的革命性进步,该法已广泛用于食品中微生物、致病菌的检测与定量和农业中植物致病菌检测等生物技术领域[16 - 17]。miRNA的检测也因此获益,依托该技术建立的miRNA测定方法应运而生。表1列举了现有的几种miRNA常用定量方法,比较显示,RT - qPCR具备更简便、快速、定量浓度范围广,以及特异性高等诸多优势。
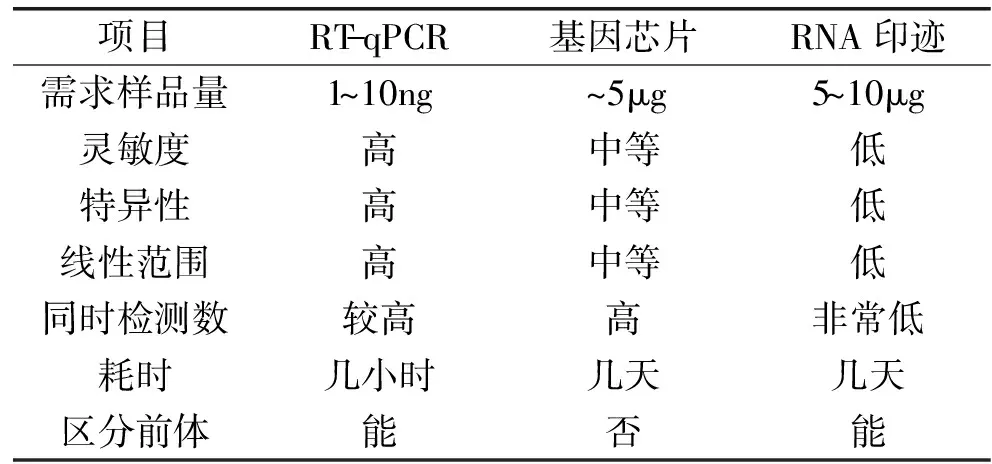
表1 miRNA定量方法比较[18]Table 1 Comparison of miRNA quantification methods[18]
由于miRNA只有22nt左右的长度,反转录后不能直接应用RT - qPCR对其进行扩增。2005年,Chen等人[19]发明了基于茎环引物的miRNA定量方法,在PCR前有效的对其进行了长度的延长,使RT - qPCR技术真正应用到了miRNA的定量检测中。经过不断改进,该方法发展迅速,已经成为目前在生物、医药、食品等领域定量miRNA最为重要的技术手段。本文将系统介绍该技术自建立近十年来在引物设计、多重定量、荧光标记等方面的发展及其应用情况,对之原理及关键技术进行综述,以期对miRNA的定量检测的应用和发展有所帮助。
1 基于茎环引物的RT - qPCR法定量单一miRNA
RT - qPCR是基于茎环引物的miRNA定量检测中使用的核心技术,它是在普通PCR技术基础上发展起来的一种核酸定量技术,由美国PE公司于1995年推出,Heid等人[20]首先对之原理和方法进行了报道。它实现了核酸PCR由定性到定量的跨越,引起了研究人员的广泛关注。
RT - qPCR的关键是在PCR反应体系里添加可以产生荧光信号的分子,通过实时测定体系荧光信号监测目的片段的PCR反应进程。荧光域值(threshold)和循环域值(Ct)是RT - qPCR中的两个重要参数[21]。荧光域值,也称本底信号,一般默认设置为反应3 ~ 15循环后荧光信号的标准偏差的十倍以上,信号在达到此域值前被背景信号掩盖。Ct值是每个反应体系的荧光信号达到荧光域值所对应的循环数。Ct值与体系内起始模板拷贝数的对数一般成线性相关,据此可得到标准曲线,以实现对未知样品起始模板数的定量。根据体系中荧光标记原理不同,RT - qPCR分为探针类和染料类。在定量miRNA的过程中主要应用Taqman探针法和SYBR Green I法。
使用RT - qPCR技术定量miRNA的瓶颈问题是其长度较短,无法实现直接PCR扩增,因此世界各国的科学家提出了多种长度延伸的方案,如基于poly A聚合酶加尾法[22]、LNA技术的引物延伸法[23]、基于茎环引物(Stem - loop Primer)的RT - qPCR法(SLP - RT- qPCR)等。其中基于茎环(Stem - loop)引物的RT -qPCR法在定量miRNA过程中具有特异性强、灵敏度高、miRNA前体的背景干扰小、线性范围广、效率高等优点。后经过科研人员的不断改进,在目前miRNA和siRNA等类似小RNA的研究中颇受青睐[24 - 28]。
1. 1 SLP - RT - qPCR对单一miRNA定量原理
图1描述了SLP - RT - qPCR技术的操作原理,分为逆转录和qPCR两个过程。如图所示,依据靶标miRNA特别设计的茎环引物3′ - 端有6 ~ 8nt碱基与靶miRNA 3′ - 端互补,通过其与miRNA的特异性互补结合挑选模板,作为引物进行反转录。即miRNA与特异性茎环引物结合后逆转录产生cDNA,作为下一步PCR扩增的模板。在PCR扩增中使用特异性上游引物和与茎环部位相对应的通用下游引物进行扩增。特异性上游引物的一部分与miRNA具有相同的序列。依据不同发光原理,特异性荧光探针或通用荧光染料在cDNA扩增过程中产生荧光信号,通过监测信号达到定量或半定量的目的。

图1 基于茎环引物的RT - qPCR原理Fig. 1 The principle of RT - qPCR based on Stem - loop primer
在整个定量过程中,高效、特异性地将目的miRNA全部逆转录是后续成功定量的前提,茎环引物解决了短链模板不能PCR扩增的难题,并保证了高灵敏性,是之后RT - qPCR应用的关键。
1. 2 茎环引物(Stem - loop Primer)
成熟miRNA的长度仅为22nt左右,普通的线性PCR引物由于长度的限制,无法用于miRNA扩增。茎环引物的出现,有效地弥补了普通引物的缺陷。针对miRNA设计的茎环引物持有茎 - 环状结构,保证了特异性的同时延长了miRNA逆转录cDNA产物的长度,以利于其扩增。Chen等人[19]设计的茎环引物(5′ - GTCGTATCCAGTGCAGGGTCCGAGGTA TTCGCACTGGATACGAC - 3')构造如图2所示,其总长度在50nt左右,由一段与miRNA特异性互补序列和一段较长的通用序列组成。
茎环引物3′ - 端有一段与miRNA特异性互补的碱基序列(一般为6 ~ 8nt),这是区别相似miRNA,保证特异性的第一步,PCR过程中特异性上游引物是保证扩增特异性的第二步。图2中两段茎柄区序列碱基互补,形成茎环的柄部。柄部的碱基堆积使miRNA的稳定性增加,提高了逆转录效率。其双链结构和自身互补形成茎环构象,可避免逆转录引物与miRNA前体及同源RNA发生杂交,减少背景干扰,若结合TaqMan探针可达到区分单个碱基差异的效果[19]。茎环引物的环中还包括了一段PCR过程中的通用下游引物序列(5′ - GTGCAGGGTCCGAGGT - 3′),它和上游引物一起完成PCR扩增。在茎环引物的序列中还特别插入较多G/C碱基,提高其退火温度,减少PCR非特异性扩增。
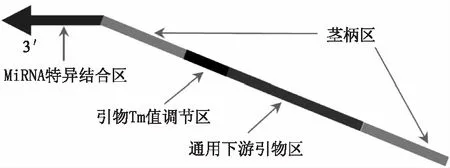
图2 茎环引物构造Fig. 2 The structure of Stem-loop Primer
在Chen等人设计的序列基础上,为设计通用探针,使该法操作更加简单,Mohammadi等人[29]对上述序列进行了优化,设计新序列(5′ - GGTC GTATGCAAAGCAGGGTCCGAGGTATCCATCGCACGC ATCGCACTGCATACGACC - 3′),将长度延伸14nt,使环部增长并提高了茎部退火温度,设计通用TaqMan探针,省去实验过程中分别为每种miRNA设计特异探针的步骤,节省时间降低实验成本。经验证,该序列在miRNA检测中可以保证良好的特异性与灵敏度,对部分miRNA的检测限可达每微升6个拷贝。
2 基于茎环引物的多重RT - qPCR法同时定量多种miRNA
越来越多的研究表明,miRNA的种类数量非常庞大。Bentwich等[30]通过生物信息学预测分析和基因芯片验证等方法发现,仅人体miRNA的数量就超过800种。基因芯片是在一个反应中同时分析多个miRNA的常用方法,但就目前的技术水平它对RNA的用量要求很高(一般超过1μg),然而一般提取方法从少量样品(如癌细胞等)中得到的RNA量无法满足这种需求。为使RT - qPCR法实现同时定量多种miRNA,同时降低对样品RNA需求的目的,Tang等人[31]应用基于茎环引物的RT - qPCR方法对单个胚胎干细胞中220种miRNA表达进行同时检测,成功实现了多重定量。Lao等人[32]对Tang等的方法进行了进一步验证,并对小量样品中的多种miRNA同时进行检测,证实了其可行性。
图3展示了多重RT - PCR同时定量多种miRNA的过程。全过程主要包括两大部分,即使用不同茎环引物同时逆转录所有目的miRNA和特异性定量目标cDNA。细胞裂解得到的总miRNA在同一体系内同时进行逆转录(根据需要测定的miRNA种类分别设计茎环引物),逆转录得到的全部cDNA用特异的上游引物(根据需要检测的目的miRNA分别进行设计)和通用下游引物同时进行一次预扩增反应,最后分别针对目的miRNA反转录的cDNA产物加入相应的荧光探针或染料单独进行定量PCR反应。
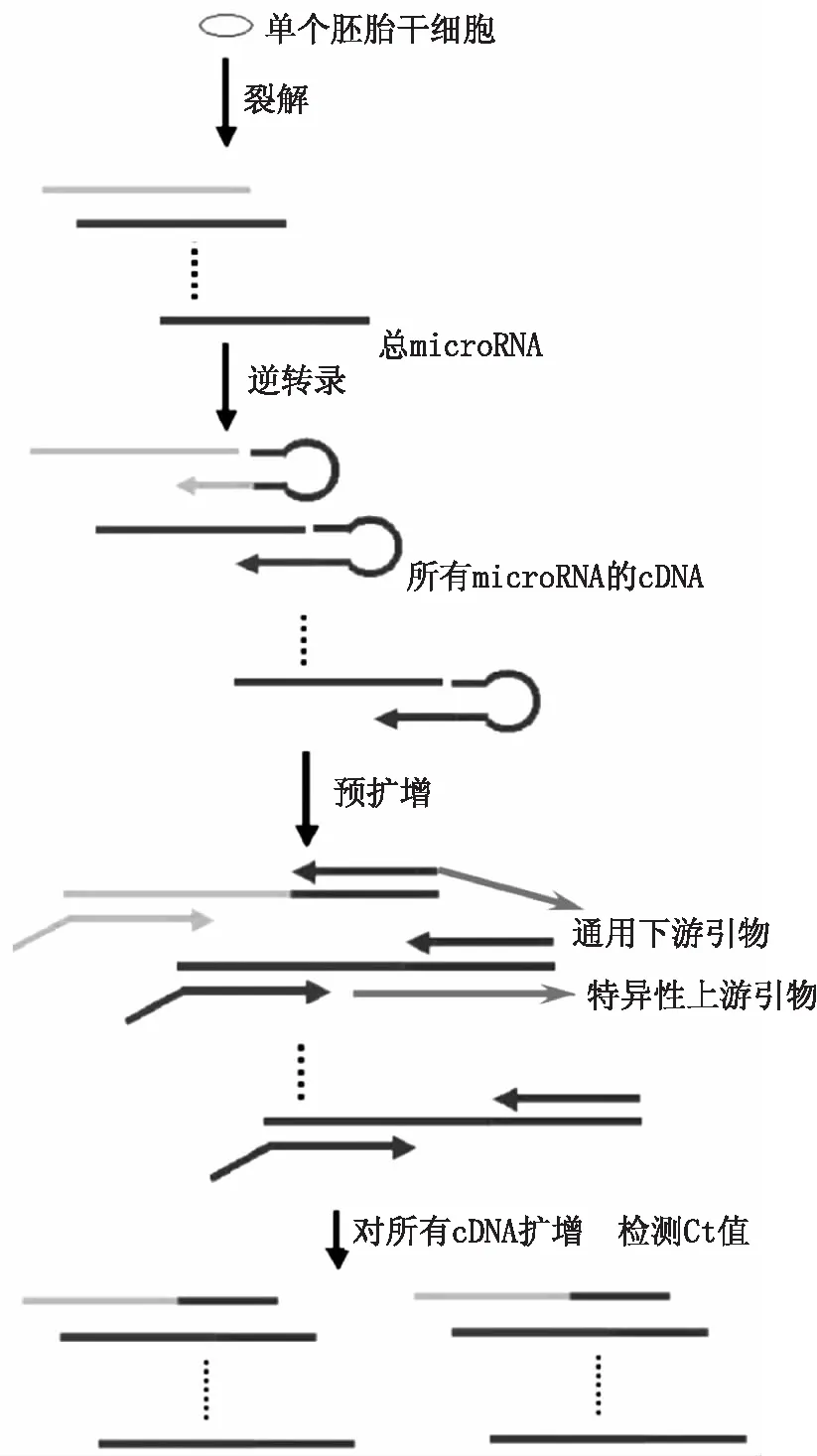
图3 多重RT - qPCR定量多种microRNA过程Fig. 3 Multiplexing RT - qPCR for the detection of multiple microRNAs
相较于单重定量反应,多重定量过程中采用循环脉冲逆转录反应并增加预扩增过程,以保证逆转录效率且提高检测的灵敏度[31]。
2. 1 循环脉冲逆转录反应
一般条件下,逆转录反应要在逆转录酶最适温度下孵育半小时,来保证逆转录效果。在多重反应体系中,体系复杂,不同引物间和不同miRNA间发生非特异性结合的概率大,且逆转录效率也较单重反应低。Tang等人[31]设计引入的循环脉冲温育(20℃,30s;42℃,30s;50℃,1s;60个循环),增加了逆转录效率,并且减少引物间和不同miRNA间的非特异性扩增。相较于普通逆转录,它将各产物的Ct值降低1左右,提高了检测的灵敏度。逆转录茎环引物浓度降低为单重反应的2% ~ 10%,进一步减少了引物间的非特异性结合。
2. 2 预扩增反应
在多重定量反应中,预扩增是非常重要的一步。为提高检测的灵敏度,在进行定量之前,需将所有cDNA进行PCR,使各cDNA得到同数量的扩增,为后续定量提供更多模板。为验证所有的cDNA是否都以相对统一的效率扩增,Lao等人[32]将逆转录整体cDNA产物分别进行1、5、10、14个循环的预扩增后分别对48种和190种miRNA分别进行定量,Ct值结果显示,适当预扩增未产生明显偏差,各cDNA相对扩增效率相同。Mestdagh等人[33]对上述结果进行了进一步验证,预扩增大大提高了检测的灵敏度,降低了检测所需要的RNA数量,且未偏离含量的真实水平。预扩增循环数控制在14以内为宜,当循环数过高时,不同miRNA的cDNA扩增效率产生的偏差增大,模板数扩增量不同,产生的PCR模板不能真实反映样品中miRNA含量情况。
3 SLP - RT - qPCR定量miRNA的应用
目前针对miRNA相关研究正在不断深入,其在多种疾病,特别是癌症的诊断与治疗方面发挥了多种功能。癌症等重大疾病的发作往往伴随着miRNA表达量的改变,使之可作为疾病标记物或诊断依据。SLP - RT - qPCR作为一种理想的miRNA定量方法,既可以对单一miRNA进行定量也可以实现多重定量,在定量癌细胞等动物样本miRNA表达量的研究中广泛应用。除了病理过程,miRNA还参与了生物体内其他多种生理过程,如变态发育、组织分化等。它们在这些过程中的作用大小与其表达量直接相关,SLP - RT - qPCR多与高通量测序等技术结合使用,系统研究miRNA表达情况。
Xu等人[34]用SLP - RT - qPCR对52名结肠直肠癌患者的癌细胞组织中miR - 21,miR - 31等四种miRNA表达进行了定量检测发现,与正常组织相比,肿瘤细胞内这四种miRNA表达量明显增加。Li等人[35]用同样方法对38个乳腺癌样本和正常样本中miR - 26b表达量定量检测发现,乳腺癌样本中该miRNA表达量明显降低,进一步的研究发现miR -26b有可能通过调节相关蛋白抑制乳腺癌细胞生长,为乳腺癌治疗提供帮助。Luo等人[36]对喉鳞状细胞癌中miR - 139表达量定量检测结合相关蛋白质表达研究发现,miR - 139可以抑制CXCR4表达,进而起到抑制癌细胞扩散和转移的作用。
除了直接定量相关miRNA表达量,由于SLP -RT - qPCR法准确、灵敏的检测能力,常被用于验证高通量测序得到的miRNA表达谱结果。Wei等人[37]采用深度测序技术系统地建立了催乳素治疗或未被治疗的乳腺癌T - 47D细胞的miRNA表达谱,并选取4种已知miRNA采用SLP - RT - qPCR法定量检测,验证了测序结果的可靠性。
4 SLP - RT - qPCR定量miRNA的发展
SLP - RT - qPCR技术虽然仅仅发明了十年时间,但是已经经历了大量的革新和进步。其发展主要体现在茎环引物的设计、多重定量方法的建立以及RT - qPCR技术中使用的新型探针/染料的研发等方面。前两个方面已有提及和论述,这里我们重点介绍一下用于定量的探针/染料的发展。多种新荧光标记的出现及应用,使该技术的结果呈现方式更加灵活,其中UPL(Universal Probe Library)通用探针和SYBR Green I等更加快捷、低成本的荧光指示物替代TaqMan探针,降低了定量检测成本且实验操作更加简便。
4. 1 UPL探针
早期RT - qPCR使用的主要是TaqMan探针,它是一种长20nt左右的寡核苷酸序列,其5′ - 端连有一个荧光报告基团,3′ - 端有一个荧光淬灭基团,探针完整时报告基团荧光被淬灭,不会产生信号。它通过碱基配对与产物结合,利用Taq聚合酶的外切酶活性,探针在扩增过程中被切断,报告基团因与淬灭基团远离而产生荧光信号。特异性TaqMan探针为检测提供了高特异性,但每种探针的设计和优化大大提高了检测成本。
基于TaqMan探针的缺点,罗氏公司推出了UPL通用探针[38],长度仅为8 ~ 9个碱基,结合LNA技术合成。此类探针的最大优势即省去了为每种miRNA单独设计探针的过程,特别是为定量多种miRNA节省大量时间。LNA是一种核酸修饰技术,通过一个亚甲基桥将核糖的2′ - 位氧原子和4′ - 位碳原子连接起来(如图4所示),增加了核酸的稳定性,提高了熔点温度。
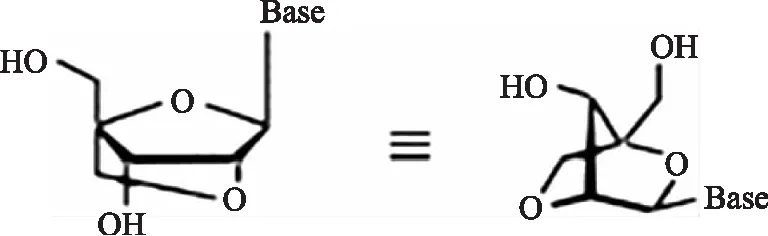
图4 LNA单体示意图Fig. 4 LNA Monomer
这种探针虽然序列短,但由于LNA的加入而大幅度提高了熔点。通过配合茎环引物上特定序列使用,能保证很高的检测特异性。Wu等人[39]使用UPL探针利用SLP - RT - qPCR法对植物中几类miRNA检测发现,UPL探针表现了良好的特异性和灵敏度。Stratford等人[40]用该法定量siRNA时,比较TaqMan探针和UPL探针的特异性发现,定量过程中的特异性主要由茎环引物提供,两者未表现出明显区别。利用UPL探针检测miR - 166,经过45个循环反应,阴性对照未检测到荧光信号[41]。
4. 2 SYBR Green I的应用
SYBR Green I是一种非饱和的菁类荧光素,可以与DNA双链的小沟非特异性结合,在游离状态时几乎无荧光信号,结合后荧光信号增强[42]。反应体系中荧光信号强度代表了DNA双链的数量。SYBR Green I具有通用性强、经济低毒的特点,在miRNA以及DNA、mRNA等各种核酸物质的定量中都有广泛应用。也正是由于其通用性强的特点,因而可以与体系内其他引物二聚体等双链结合,使背景干扰增加,无法应用于多重定量中。
事实上,应用于miRNA定量的探针/染料的发展是随着RT - qPCR的发展而同步进行的,这种发展为SLP - RT - qPCR的发展注入了新的活力。UPL探针与SYBR Green I染色应用,简化了为每种miRNA单独设计探针的过程,特别是UPL探针在多重定量中的应用,降低了检测的成本,且提供了相当的特异性和灵敏度,这对该方法的应用推广起到了促进作用。
5 结语
基于茎环引物的RT - qPCR方法特异性好、灵敏度高、效率高,是一种定量miRNA的理想方法,已经被广泛应用与动物和植物miRNA的研究[30,43]。它简化了实验的操作步骤,无需电泳、染色等后续操作。高通量检测的发展,让该方法应用更加广泛,在短时间内即可完成对多种miRNA的定量。鉴于多种优势,该方法已经推广到siRNA等类似的小RNA定量中,对RNA干扰的相关研究起到了很大的推动作用[22]。但遗憾的是迄今还没有任何一种定量方法可以对任意miRNA保证相同的检测效率。随着对miRNA研究的深入,一些恒温检测技术如RCA[44]、环介导恒温扩增[45]、基于DNA酶切的信号扩增[46]等相继应用到RNA检测,相信更加稳定高效的定量方法将会出现。
[1]Rosalind C Lee,Rhonda L Feinbaum,Victor Ambros. The C. elegans Heterochronic Genelin- 4 Encodes Small RNAs with Antisense Complementarity tolin- 14[J]. Cell,1993,75:843 - 854.
[2]Stark A,Brennecke J,Russell R B,etal. Identification of Drosophila microRNA targets[J]. PLoS Biology,2003,1(3):e60.
[3]Lewis B P,Shih I,Jones - Rhoades M W,etal. Prediction of mammalian microRNA targets[J]. Cell,2003,115(7):787 - 798.
[4]Fu Y,Shi Z,Wu M,etal. Identification and differential expression of microRNAs during meta - morphosis of the Japanese flounder(Paralichthys olivaceus)[J]. PLoS One,2011,6(7):e22957.
[5]Farazi T A,Hoell J I,Morozov P,etal. MicroRNAs in Human Cancer[M]//MicroRNA Cancer Regulation. Springer Netherlands,2013:1 - 20.
[6]Aguda B D. Modeling microRNA - Transcription Factor Networks in Cancer[M]//MicroRNA Cancer Regulation. Springer Netherlands,2013:149 - 167.
[7]Schmitz U,Wolkenhauer O,Vera J. MicroRNA Cancer Regulation:Advanced Concepts,Bioinformatics and Systems Biology Tools[M]. Springer,2013.
[8]Zhang L,Hou D,Chen X,etal. Exogenous plant MIR168a specifically targets mammalian LDLRAP1:evidence of cross -kingdom regulation by microRNA[J]. Cell research,2011,22(1):107 - 126.
[9]Lewis B P,Burge C B,Bartel D P. Conserved seed pairing,often flanked by adenosines,indicates that thousands of human genes are microRNA targets[J]. Cell,2005,120(1):15 - 20.
[10]Grün D,Wang Y L,Langenberger D,etal. microRNA target predictions across seven Drosophila species and comparison to mammalian targets[J]. PLoS Computational Biology,2005,1(1):e13.
[11]Enright A J,John B,Gaul U,etal. MicroRNA targets in Drosophila[J]. Genome Biology,2004,5(1):R1 - R1.
[12]Maragkakis M,Alexiou P,Papadopoulos G L,etal. Accurate microRNA target prediction correlates with protein repression levels[J]. BMC bioinformatics,2009,10(1):295.
[13]Doran J,Strauss W M. Bio - informatic trends for the determination of miRNA - target interactions in mammals[J]. DNA and Cell Biology,2007,26(5):353 - 360.
[14]Lee Y,Jeon K,Lee J T,etal. MicroRNA maturation:stepwise processing and subcellular localization[J]. The EMBO Journal,2002,21(17):4663 - 4670.
[15]Sun Y,Koo S,White N,etal. Development of a micro - array to detect human and mouse microRNAs and characterization of expression in human organs[J]. Nucleic Acids Research,2004,32(22):e188.
[16]Levin R E. The application of real - time PCR to food and agricultural systems. A review[J]. Food Biotechnology,2005,18(1):97 - 133.
[17]Postollec F,Falentin H,Pavan S,etal. Recent advances in quantitative PCR(qPCR)applications in food microbiology[J]. Food microbiology,2011,28(5):848 - 861.
[18]Chen C,McDonald K,Wong A H,etal. Real - time PCR Advancing RNA Interference and MicroRNA Studies[J]. Pharmaceutical Discovery,2005,2005:1 - 5
[19]Chen C,Ridzon D A,Broomer A J,etal. Real - time quantification of microRNAs by stem - loop RT - PCR[J]. Nucleic acids research,2005,33(20):e179.
[20]Heid C A,Stevens J,Livak K J,etal. Real time quantitative PCR[J]. Genome research,1996,6(10):986 - 994.
[21]郭杨,陈世界,郭万柱,等. 荧光定量 PCR 技术及其应用研究进展[J]. 动物医学进展,2009,30(2):78 - 82.
[22]Rui Shi,Vincent L Chiang. Facile means for quantifying microRNA expression by real - time PCR[J]. BioTechniques,2005,39(4):519 - 525.
[23]Raymond C K,Roberts B S,Garrett - Engele P,etal. Simple,quantitative primer - extension PCR assay for direct monitoring of microRNAs and short - interfering RNAs[J]. Rna,2005,11(11):1737 - 1744.
[24]Cheng A,Li M,Liang Y,etal. Stem - loop RT - PCR quantification of siRNAsinvitroandinvivo[J]. Oligonucleotides,2009,19(2):203 - 208.
[25]Czimmerer Z,Hulvely J,Simandi Z,etal. A Versatile Method to Design Stem - Loop Primer - Based Quantitative PCR Assays for Detecting Small Regulatory RNA Molecules[J]. PloS One,2013,8(1):e55168.
[26]Pinto M T,Nicolete L D F,Rodrigues E S,etal. Overexpression of hsa - miR - 125b during osteoblastic differentiation does not influence levels of Runx2,osteopontin,and ALPL gene expression[J]. Brazilian Journal of Medical and Biological Research,2013,46(8):676 - 680.
[27]Snyder C M,Rice A L,Estrella N L,etal. MEF2A regulates the Gtl2 - Dio3 microRNA mega - cluster to modulate WNT signaling in skeletal muscle regeneration[J]. Development,2013,140(1):31 - 42.
[28]Rao D,Wang Z,Nemunaitis J J,etal. BI - FUNCTIONAL shRNA TARGETING MESOTHELIN AND USES THEREOF:U S,13/852,446[P]. 2013 - 3 - 28.
[29]Mohammadi - Yeganeh S,Paryan M,Mirab Samiee S,etal. Development of a robust,low cost stem - loop real - time quantification PCR technique for miRNA expression analysis[J]. Mol Biol Rep,2013,40(5):3665 - 3674.
[30]Bentwich I,Avniel A,Karov Y,etal. Identification of hundreds of conserved and nonconserved human microRNAs[J]. Nature genetics,2005,37(7):766 - 770.
[31]Tang F,Hajkova P,Barton S C,etal. MicroRNA expression profiling of single whole embryonic stem cells[J]. Nucleic acids research,2006,34(2):e9.
[32]Lao K,Xu N L,Yeung V,etal. Multiplexing RT - PCR for the detection of multiple miRNA species in small samples[J]. Biochemical and biophysical research communications,2006,343(1):85 - 89.
[33]Mestdagh P,Feys T,Bernard N,etal. High - throughput stem- loop RT - qPCR miRNA expression profiling using minute amounts of input RNA[J]. Nucleic Acids Research,2008,36(21):e143.
[34]Xu X M,Qian J C,Deng Z L,etal. Expression of miR - 21,miR - 31,miR - 96 and miR - 135b is correlated with the clinical parameters of colorectal cancer[J]. Oncology Letters,2012,4(2):339 - 345.
[35]Li J,Kong X,Zhang J,etal. MiRNA - 26b inhibits proliferation by targeting PTGS2 in breast cancer[J]. Cancer Cell Int,2013,13(7):1 - 6.
[36]Luo H N,Wang Z H,Sheng Y,etal. miR - 139 targets CXCR4 and inhibits the proliferation and metastasis of laryngeal squamous carcinoma cells[J]. Medical Oncology,2014,31(1):1 - 11.
[37]Wei Q,He W,Yao J,etal. Identification and characterization of microRNAs expressed in human breast cancer T - 47D cells in response to prolactin treatment by Solexa deep - sequencing technology[J]. Biochemical and Biophysical Research Communications,2013,432:480 - 487.
[38]Peter Mouritzen M N,Peter S Nielsen,Nana Jacobsen,etal. ProbeLibrary:A new method for faster design and execution of quantitative real - time PCR[J]. NATURE METHODS,2005,2(4):313 - 316.
[39]Wu R,Wood M,Thrush A,etal. Real - Time PCR Quantification of Plant miRNAs Using Universal ProbeLibrary Technology[J]. BIOCHEMICA - MANNHEIM,2007(2):12 - 15.
[40]Stratford S,Stec S,Jadhav V,etal. Examination of real - time polymerase chain reaction methods for the detection and quantification of modified siRNA[J]. Analytical biochemistry,2008,379(1):96 - 104.
[41]Varkonyi - Gasic E,Wu R,Wood M,etal. Protocol:a highly sensitive RT - PCR method for detection and quantification of microRNAs[J]. Plant methods,2007,3(12):1 - 12.
[42]Morrison T B,Weis J J,Wittwer C T. Quantification of low -copy transcripts by continuous SYBR Green I monitoring during amplification[J]. Biotechniques,1998,24(6):954 - 958,960,962.
[43]Feng J,Wang K,Liu X,etal. The quantification of tomato microRNAs response to viral infection by stem - loop real - time RT - PCR[J]. Gene,2009,437(1 - 2):14 - 21.
[44]Merkiene E,Gaidamaviciute E,Riauba L,etal. Direct detection of RNAinvitroand in situ by target - primed RCA:The impact of E. coli RNase III on the detection efficiency of RNA sequences distanced far from the 3′ - end[J]. RNA,2010,16(8):1508 - 1515.
[45]Cardoso T C,Ferrari H F,Bregano L C,etal. Visual detection of turkey coronavirus RNA in tissues and feces by reverse - transcription loop - mediated isothermal amplification(RT - LAMP)with hydroxynaphthol blue dye[J]. Molecular and Cellular Probes,2010,24(6):415 - 417.
[46]Zhao Y,Zhou L,Tang Z. Cleavage - based signal amplification of RNA[J]. Nature Communications,2013,4:1493 - 1500.

