白肛海地瓜双酶水解物的制备及其对人皮肤细胞的生长和胶原蛋白合成的作用
,,
(宁波大学海洋学院,浙江宁波 315211)
白肛海地瓜也称东海海参,属于棘皮动物门,海参纲,芋参目,尻参科,海地瓜属,广泛分布于我国东部沿海,储量丰富。与日常食用的刺参相比,白肛海地瓜体壁肉质较硬,口感较差,利用率低,但就其营养成分而言,白肛海地瓜含有丰富蛋白质,几乎与刺参相当[1],体壁富含胶原蛋白,其水解肽更具有多种生物活性功效,同时白肛海地瓜含有一些皂苷和海参多糖[2]。
目前对于白肛海地瓜水解物的制备方法以及评价指标,多数采用的是酶解法、可溶性氨基态氮,侯付景[3]等以可溶性氨基态氮为指标,利用复合蛋白酶水解海地瓜,经过正交优化获得较高的氨基酸态氮。有研究表明双酶水解法比单酶水解可以获得更高的水解度[4 - 5]。近年,在细胞培养模式上研究海地瓜功能的相关报道很少,本文采用双酶水解法,以游离总氨基酸含量为评价指标,通过单因素实验以及正交实验确定酶解条件,利用超滤和冷冻干燥技术,获得不同分子量的水解物干粉,研究该水解物对人类皮肤纤维母细胞(CCD - 966SK)的增殖以及其细胞自身合成分泌胶原蛋白的影响,为白肛海地瓜应用于保健品、食品添加剂等方面提供参考,也为这种生物提供一种高值化利用的方向。
1 材料与方法
1. 1 材料与仪器
白肛海地瓜活体 浙江省象山隅山岛海域;人类皮肤纤维母细胞CCD - 966SK 台湾食品工业研究所;总氨基酸试剂盒(T - AA) 中国南京建成生物工程研究所;中性蛋白酶(20万U/g)、动物蛋白水解酶(20万U/g) 中国广西庞博生物工程有限公司;MEM细胞培养液(Minimum Essential Medium,Earle’s)、胎牛血清、非必需氨基酸、丙酮酸钠 Invitrogen公司;二甲基亚砜 Sigma公司;WST - 1(水溶性四唑盐) Abnova公司;胶原检测试剂盒 Biocolor公司。
水浴锅DKS - 11 中国宁波江南仪器;Minispin小型高速离心机 德国Eppendorf公司;TG16 - WS台式高速离心机 中国成都市苏净科学器材有限公司。
1. 2 实验方法
1. 2. 1 海地瓜体壁酶解条件
1. 2. 1. 1 单因素实验 将白肛海地瓜解剖去除内脏,清洗干净,取体壁。用绞肉机粉碎,混匀用于以下酶解实验。
采用中性蛋白酶与动物蛋白酶,酶浓度为2%,酶比例1∶ 1(w/w,g/g),液料比3∶ 1(v/w,mL/g),酶解温度分别为30、40、45、50、55、60和70℃,水解2h,然后100℃灭酶活5min,冷却后4500r/min离心20min,取上清检测游离总氨基酸含量,考察酶解温度对酶解效果的影响;在最佳酶解温度的前提下,酶浓度为2%,酶比例1∶ 1,液料比3∶ 1,分别酶解1、2、3、4、5h,灭活方法、离心方法同上,取上清检测游离总氨基酸含量,考察酶解时间对酶解效果的影响;在最佳酶解温度、酶解时间的前提下,酶比例1∶ 1、液料比3∶ 1,分别在酶浓度为0. 5%、1%、2%、3%、4%下酶解,灭活方法、离心方法同上,取上清检测游离总氨基酸含量,考察酶浓度对酶解效果的影响;在最佳酶解温度、酶解时间、酶浓度的前提下,液料比3∶ 1,酶的比例设定1∶ 1、1∶ 2、1∶ 3、2∶ 1、2∶ 3、3∶ 1、3∶ 2,灭活方法、离心方法同上,取上清检测游离总氨基酸含量,考察酶比例对酶解效果的影响;在最佳酶解温度、酶解时间、酶浓度、酶比例的前提下,液料比0. 125∶ 1、0. 25∶ 1、0. 5∶ 1、1∶ 1、2∶ 1、3∶ 1、4∶ 1、5∶ 1,灭活方法、离心方法同上,取上清检测游离总氨基酸含量,考察液料比对酶解效果的影响。
1. 2. 1. 2 正交实验 将单因素实验中得出的酶比例、料液比作为固定值,探讨加酶量、温度、时间这3个因素,按照正交实验进行酶解,并测定总氨基酸含量。实验设计中的水平及编码表见表1。

表1 正交实验因素水平编码表Table 1 Factors and levels of orthogonal experiment
1. 2. 2 超滤制备不同分子量的酶解产物 将最适条件下制备的白肛海地瓜体壁酶解液8000r/min离心10min,上清液利用超滤膜(MILLIPORE,美国)获得分子量为1、5、10ku的样品[6 - 7]。
1. 2. 3 细胞功能实验
1. 2. 3. 1 细胞的增殖 细胞培养:将人类皮肤纤维母细胞CCD - 966SK,以MEM培养基(其中含10%FBS、1%青 - 链霉素、1%非必需氨基酸以及1%丙酮酸钠)在5%CO2、37℃条件下培养,每2 ~ 3d换液[8 - 9]。
对细胞增殖的作用:按照每孔1×104个CCD -966SK细胞接种于96孔板,并加入样品(以含10%胎牛血清的MEM全培养液配制),每孔总体积100μL。48h后,每孔加8μL的水溶性四唑盐WST - 1,2h后于450nm处测吸光值,并计算细胞相对存活率:
细胞相对存活率(%)=(A样品- A空白)/(A对照-A空白)× 100
1. 2. 3. 2 胶原蛋白的合成 胶原蛋白的含量采用胶原蛋白检测试剂盒[10 - 11](Sircol Collagen assay)测定。取20μL细胞的上清培养液(以相同量的培养液作为对照组),依次加入20μL的0. 5mol/L的醋酸以及100μL的染色液于1. 5mL的离心管中,室温下混合反应30min。以15000r/min,4℃离心20min后,去除上清液。再加入100μL的碱试剂,振荡1min左右使沉淀完全溶解。取100μL于540nm处测吸光值。将标准蛋白依次稀释成0、0. 03125、0. 0625、0. 125、0. 25、0. 5mg/mL的浓度,方法同上,制作标准曲线。
取96孔板,每孔接入6×104个CCD - 966SK细胞,并加入不同浓度的酶水解物样品(以不含胎牛血清的MEM培养液配制),每孔总体积120μL(不含胎牛血清)。72h测胶原蛋白含量。
取24孔板,每孔接入6×104个/mL的CCD -966SK细胞,并加入浓度为10mg/mL和0. 1mg/mL的样品(以无FBS的MEM培养液配制),每孔总体积1mL(不含胎牛血清)。空白组为不加胎牛血清的MEM培养液,对照组为含细胞的不加胎牛血清的MEM培养液。分别测定第0d、第2d、第4d、第8d、第12d的胶原蛋白浓度。
1. 3 数据分析方法
数据采用SAS软件(One - way ANOVA)、GraphPad Prism 5分析并绘制成图。
2 结果与讨论
2. 1 酶解温度对酶解效果的影响
图1a结果显示,随着温度的升高,游离总氨基酸含量逐渐升高,50℃时达到最大值,然后随着温度的升高,游离氨基酸含量逐渐减少,至60℃时,趋于平缓,这是因为过高的温度会使蛋白酶分子结构发生改变,酶活力降低或使酶失活。因此最适宜酶解温度选择50℃。
2. 2 酶解时间对酶解效果的影响
如图1b结果显示,随着酶解时间的延长,酶解液中的游离总氨基酸含量持续增加,但在4h时增加减缓趋势,所测定的游离总氨基酸含量与5h时基本持平,曲线趋于平缓,而两个时间段相差1h,出于时间因素考虑,选择4h为最适宜酶解时间。
2. 3 酶浓度对酶解效果的影响
如图1c所示,总酶浓度在0. 5%到2%时,酶解液中的游离总氨基酸含量持续增加,之后开始出现减缓趋势,3%与4%时的游离总氨基酸含量基本持平,基于成本因素考虑,选择酶浓度为3%。
2. 4 酶的比例对酶解效果的影响
研究结果如图1d。动物蛋白酶与中性蛋白酶的质量比为1∶ 3时的游离总氨基酸含量最少,而在3∶ 2时的酶解液游离总氨基酸含量最高,平均249. 649μmol/mL。两者的数据差异明显,一方面可能是由于动物蛋白酶可以特异性水解的肽键在白肛海地瓜内含量较多,使得动物蛋白酶可以水解较多的底物,而相对的中性蛋白酶可以特异性水解的肽键较少,这使得当动物蛋白酶与中性蛋白酶的酶比例最小为1∶ 3时,所得的酶解效果最差;另一方面,游离氨基酸含量是最终两种酶共同作用于底物的结果,其中的酶解机制复杂,酶比例为3∶ 2时恰恰使两种酶作用下获得最佳水解效果,相比之下,酶比例为1∶ 3时的酶解效果最差。因此选择含量最高的3∶ 2作为动物蛋白酶与中性蛋白酶的质量比。
2. 5 液料比对酶解效果的影响
结果见图1e所示,游离总氨基酸含量随着液料比的增加逐渐提高,而水与海地瓜的比例为0. 25∶ 1时游离氨基酸总量要显著高于其他7组,随后随着液料比的增加,游离氨基酸含量逐渐降低,其中5∶ 1组含量最少,这可能是由于加水量过多和过少易使酶与海地瓜碎块接触的面积减少,使酶解不彻底[4]。因此最适宜液料比选择0. 25∶ 1。
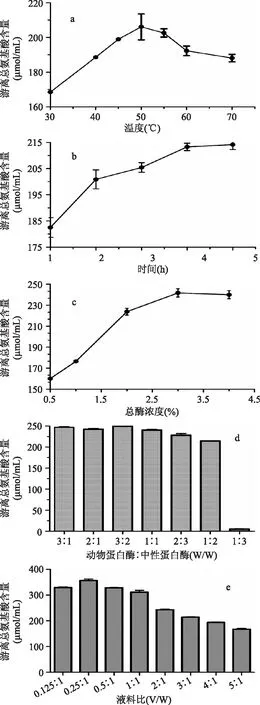
图1 单因素实验结果Fig. 1 Results of single - factor experiments
2. 6 正交实验优化设计结果
基于上述单因素实验结果,在动物蛋白酶与中性蛋白酶的质量比为3∶ 2,液料比为0. 25∶ 1的条件下,采用L9(34)正交实验设计探讨温度、时间、加酶量对游离总氨基酸含量的影响,以确定最适宜酶解反应条件。从表2中可以看出,极差R以温度最高,因此三个因素中酶解温度对样品产生游离总氨基酸的影响最大,其次是加酶量、酶解时间。正交表中得出的最适宜酶解条件为A3B2C2,即加酶量4%、温度50℃、时间4h,与单因素实验分析结果基本一致。
2. 7 超滤结果
在最适条件下制备白肛海地瓜体壁酶水解物,利用超滤截留小于1、5、10ku的多肽,再加上未用超滤处理的酶解液原液,总共4个样本,依次标为CP1、CP2、CP3、CP4,并将这4个样本冷冻干燥获得干粉。
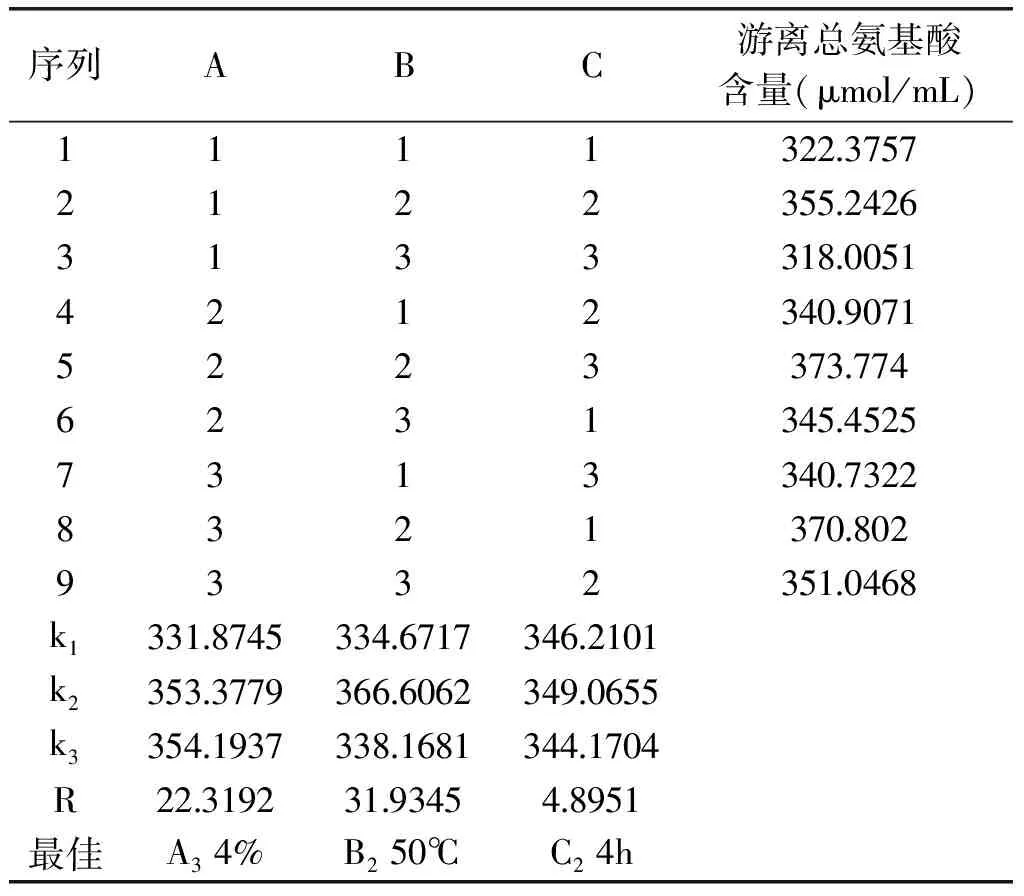
表2 正交实验表分析结果Table 2 Results of orthogonal experiment
2. 8 对CCD - 966SK细胞增殖的影响
由图2可以看出,在细胞接种量为1×104个/孔、共培养48h的条件下,除了浓度为1mg/mL的样品CP4在相对存活率上没有显示出增殖的效果外,其他样品均显示出促进CCD - 966SK细胞增殖的能力。其中添加了0. 1mg/mL CP3的实验组,它的相对存活率(156. 232%)显著高于其他组。而在高浓度1mg/mL时,CP1、CP2、CP3、CP4均显示出较低的细胞相对存活率。可能由于加入高浓度的样品使细胞的渗透压发生改变,从而在一定程度上抑制了细胞的增殖,CP4又是未用超滤处理的酶解产物原液,所含的大分子物质较多,也使浓度为1mg/mL时的CP4样品组呈现出抑制细胞增殖的现象。周怡昆[12]等对外周神经雪旺细胞的研究发现短期高糖可通过高渗透压抑制RSC96雪旺细胞的增殖。有研究显示一些水解物在一定条件下可提高细胞活力,促进细胞增殖。Kwon[13]等将含大豆蛋白水解物的无血清培养基培养家蚕细胞,结果表明含0. 5%水解物的无血清培养基可使家蚕细胞的密度提高至1. 1×107细胞/mL。

图2 白肛海地瓜酶水解物对CCD - 966SK的增殖作用Fig. 2 Effects of A. Leucoproata enzymatic hydrolysates on proliferation function of CCD - 966SK
2. 9 促进CCD - 966SK细胞合成胶原蛋白
皮肤组织中的胶原蛋白是维持皮肤弹性的主要因子之一,同时也主导细胞与细胞间黏着、细胞增殖及分化。皮肤纤维母细胞具有分泌胶原蛋白及胞外基质以维持皮肤弹性的功能,并且可分泌胶原蛋白至胞外,在此基础上,可研究皮肤细胞胶原蛋白的合成情况。
传统的培养基通常含有血清,可以为细胞提供多种营养物质,促进细胞的生长,还可保护细胞使其免受一些损伤,但也有一些缺点,如批次间差异大、成分不明确等,在某些程度上加大了实验的误差。本研究中的胶原蛋白实验采用无血清培养基,排除了血清对细胞合成胶原蛋白的影响,也更加体现出白肛海地瓜酶水解物对于促进CCD - 966SK细胞合成胶原蛋白的作用。
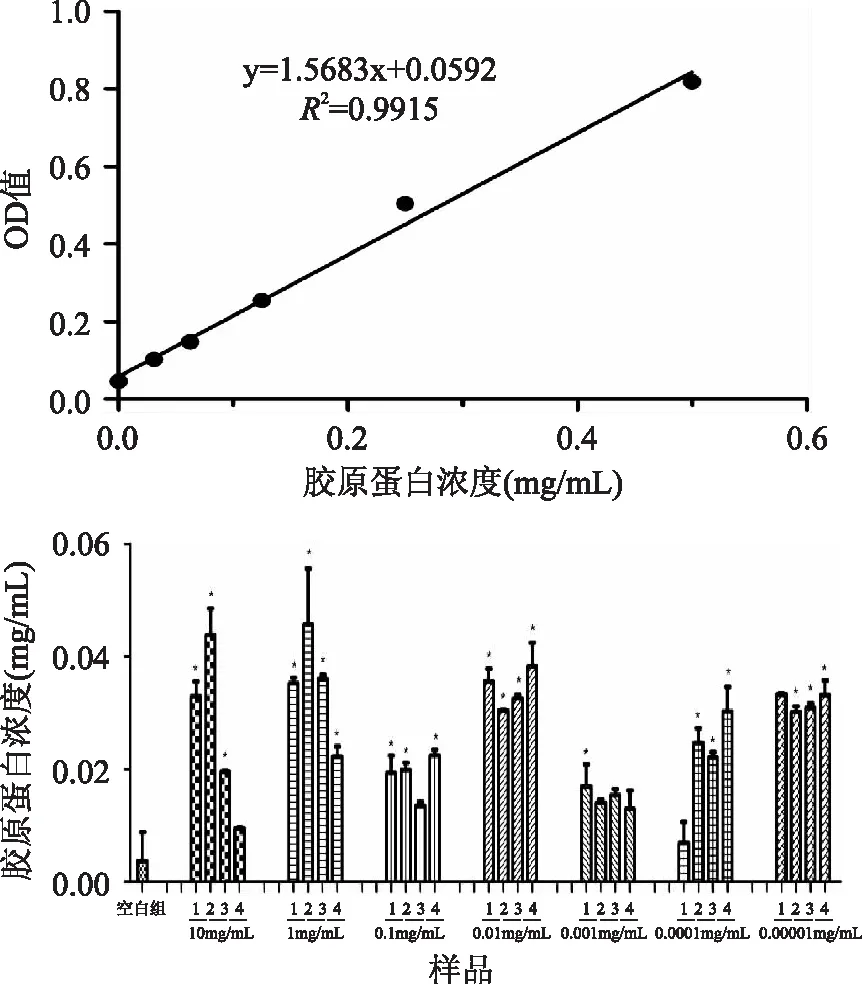
图3 不同浓度的白肛海地瓜酶水解物对CCD - 966SK细胞合成胶原蛋白的影响Fig. 3 Effects of different concentration of A. leucoproata enzymatic hydrolysates on stimulating collagen protein synthesis of CCD - 966SK cells注:1、2、3、4分别代表酶水解液样品CP1、CP2、CP3、CP4;*:与空白组比较有显著性差异(p<0. 05)。
图3中的直线图为胶原蛋白标准曲线,y=1. 5683x+0. 0592,R2=0. 9915,柱状图显示了不同浓度的白肛海地瓜酶水解物对CCD - 966SK细胞合成胶原蛋白的情况。图3表明在细胞浓度为6×104个/孔,培养72h后,酶水解物明显促进了CCD -966SK细胞合成胶原蛋白,浓度为1mg/mL和0. 01mg/mL的组中所测得的胶原含量相对较高,其中尤其以加了1mg/mL CP2组的胶原量最为明显,与空白组相比差异显著。穆源浦[14]等研究一种深海鱼类中精制提炼的鱼蛋白提取物对人体皮肤水分、油分的调节作用,结果显示该提取物具有保持皮肤水分作用,可在一定程度上改善人体的皮肤状况。由图4可以得出,在第8d,实验组表现出明显的促进作用,各组细胞培养上清液中的胶原蛋白含量要显著高于其他时间组。在CP1、CP2、CP3、CP4四个样品中,无论是浓度1mg/mL还是0. 01mg/mL,CP4所测得的胶原蛋白含量与其他组相比都是最少的,其次是CP3,而加了CP2组的胶原量最高。因此,相对其他分子量范围而言,在5ku以内的水解产物对CCD - 966SK细胞胶原蛋白合成分泌的影响最大。
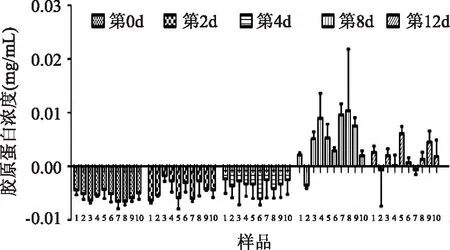
图4 白肛海地瓜酶水解物对CCD - 966SK细胞胶原蛋白合成的影响Fig. 4 Effects of A. leucoproata enzymatic hydrolysates on stimulating collagen protein synthesis of CCD - 966SK cells注,1、2、3、4、5、6、7、8、9、10分别代表空白组、对照组、1mg/mL的CP1、1mg/mL的CP2、1mg/mL的 CP3、1mg/mL的CP4、0. 01mg/mL的CP1、0. 01mg/mL的CP2、0. 01mg/mL的CP3、0. 01mg/mL的CP4。
3 结论
通过单因素实验及正交实验,确定在动物蛋白酶与中性蛋白酶的质量比为3∶ 2、液料比(水:海地瓜碎块)为0. 25∶ 1的条件下,双酶水解海地瓜体壁碎块的最适宜工艺条件为:加酶量4%、酶解温度50℃、酶解时间4h。将在此最适宜工艺条件下制成的酶解液制成不同分子量范围的粉末状水解物,这些水解产物对CCD - 966SK细胞无毒性,均可在一定浓度范围内促进细胞增殖、增加胶原蛋白的合成,同时,相对其他分子量范围而言,在5ku以内的粉末状水解产物对CCD - 966SK细胞胶原蛋白合成分泌的影响最大。白肛海地瓜水解物的制备工艺简单,原料价格低廉,在食品相关领域具有一定的开发前景。
[1]徐彩云,苏秀榕,李妍妍,等. 海地瓜的营养成分及其降血脂功能[J]. 营养学报,2009,31(4):384 - 387.
[2]蔡彬新,吴成业,刘淑集. 海地瓜多糖提取条件的优化和脱蛋白的研究[J]. 食品工业科技,2009,30(10):194 - 196.
[3]侯付景,苏秀榕,李妍妍,等. 海地瓜的酶水解液的抗氧化活性研究[J]. 食品科技,2009,31(7):181 - 184.
[4]王霞,苏秀榕,丁进锋,等. 响应面法优化双酶水解黄鳍金枪鱼胰脏的工艺研究[J]. 现代食品科,2010,26(11):1229 - 1233.
[5]洪鹏志,杨萍,曾少葵,等. 黄鳍金枪鱼头蛋白酶解条件的研究[J]. 食品科技,2007(3):100 - 103.
[6]李锦生,傅晓琴,李冰,等. 功能性生物活性物质超滤分离纯化技术的研究现状与进展[J]. 中国食品学报,2010,10(2):174 - 179.
[7]宋永相,孙谧,王跃军,等. 海洋活性胶原肽的抗氧化性及对酪氨酸酶的抑制作用于初步分离研究[J]. 中国食品学报,2009,9(5):7 - 13.
[8]Schneider L A,Dissemond J,Brenneisen P,etal. Adaptive cellular protection against UVA - 1 - induced lipid peroxidation in human dermal fibroblasts shows donor - to - donor variability and is glutathione dependent[J]. Archives of Dermatological Research,2006,297:324 - 328.
[9]Molinari J,Ruszova E,Velebny V,etal. Effect of advanced glycation endproducts on gene expression profiles of human dermal fibroblast[J]. Biogerontology,2008,9:177 - 182.
[10]Rodríguez - Rodríguez P,Arribas S M,López de Pablo A L,etal. A simple dot - blot - Sirius red - based assay for collagen quantification[J]. Analytical and Bioanalytical Chemistry,2013,405:6863 - 6871.
[11]Abreu E L,Arribas S M,Murray M M. Storage conditions do not have detrimental effect on allograft collagen or scaffold performance[J]. Cell and Tissue Banking,2009,10:333 - 340.
[12]周怡昆,薛耀明. 高糖通过高渗透压改变PAX3基因表达抑制RSC96雪旺细胞增殖[J]. 昆明理工大学学报:自然科学版,2013,38(4):60 - 64.
[13]Kwon M S,Dojima T,Park E Y. Use of plant - derived protein hydrolysates for enhancing growth of Bombyx mori(silkworm)insect cells in suspension culture[J]. Biotechnology and Applied Biochemistry,2005,42(1):1 - 7.
[14]穆源浦,李晓瑜,包大跃. 鱼蛋白对皮肤水份、油份的调节作用研究[J]. 中国食品卫生杂志,2000,12(3):6 - 8.

