PI3K-Akt-mTORC1信号途径在细胞生长增殖中的调控作用
黎 丽, 韩春春, 刘秀云
(1. 成都农业科技职业学院, 成都611130; 2. 四川农业大学 动物遗传育种所, 成都611130; 3. 山东省安丘市青云学府, 山东 安丘 262100)
PI3K-AKT-mTORC1信号途径在细胞生长、增殖和蛋白合成中起着重要的作用。PI3K-Akt-mTORC1途径广泛存在细胞中,PI3K作为联系胞外信号与细胞应答效应的桥梁分子,在一系列上游或旁路信号分子的影响下,作用于下游的信号分子Akt及mTORC1对细胞的生长和增值起非常重要的调节作用。
1PI3K-Akt对细胞生长增殖的调节
PI3K是细胞内的磷脂激酶家族成员之一,属于胞内的磷脂酰肌醇激酶,具有磷脂酰肌醇激酶的活性及丝氨酸/苏氨酸激酶的活性。PI3K的两个亚基p85和p110,分别具有调节功能和催化功能,是细胞内重要的信号介导物质;AKT是PI3K的主要下游信号分子,是一种丝氨酸/苏氨酸蛋白激酶,处于PI3K/Akt/mTOR信号通道的核心地位。PI3K-Akt信号通路能够通过调控细胞周期实现对细胞增殖的调节。PI3K能够激活细胞周期依赖性蛋白激酶-4(CDK4)和CDK2,使细胞进入S期并诱导DNA的合成[1]。PI3K特异抑制剂LY294002能够抑制PI3K通路导致细胞阻滞在G1期,同时激活的Akt对P27和P21进行负调节,使它们不能进入细胞核发挥正常功能,影响细胞周期进程[2]。有研究发现mdm2是Akt通路下游的一个作用底物,Akt磷酸化可以活化mdm2,从而使细胞质中的Akt-mdm2复合物迅速解离,mdm2进入细胞核并与p53结合,进而促进p53降解,而p53则可以通过多种通路影响细胞周期的进行[3]。在卵巢癌中的研究发现,PI3K可通过Akt和mTOR将有丝分裂信号传递给p70S6K1(核糖体蛋白S6激酶1),使细胞周期主要蛋白如cyclin(细胞周期蛋白)的翻译上调,促进G1期进展,使细胞周期加速,而抑制PI3K活性可以明显降低cyclinD1、CDK4的表达,导致细胞G1期阻滞,抑制细胞周期进展[1]。
PI3K-Akt信号通路在细胞的生长分化中也起重要调控作用(图1)。研究表明,PI3K可以通过激活E2钙粘蛋白调节的细胞连接调节细胞间信号传导,从而调控肠上皮细胞的分化[4]。在对脂肪来源的MSC成内皮分化研究中,加入PI3K抑制剂LY294002可以抑制MSC向内皮的分化[5]。对PI3K信号通路起着负向调控的PTEN缺失时,则可导致ES细胞增殖明显加快。Akt至少有3种形式:Akt1、Akt2和Akt3,它们对于调控细胞的大小、生长和增殖都起着十分重要的作用。其中,Akt1促进细胞增殖,Akt2参与胰岛素调节的代谢过程,而Akt3则对细胞的生长分化起着重要的调节作用[6]。此外,有研究表明PI3K可以通过GSK3β(糖原合成酶激酶3β)负反馈调节来影响P53的功能, 进而实现对维持干细胞原始性的重要基因Nanog功能调节[7]。
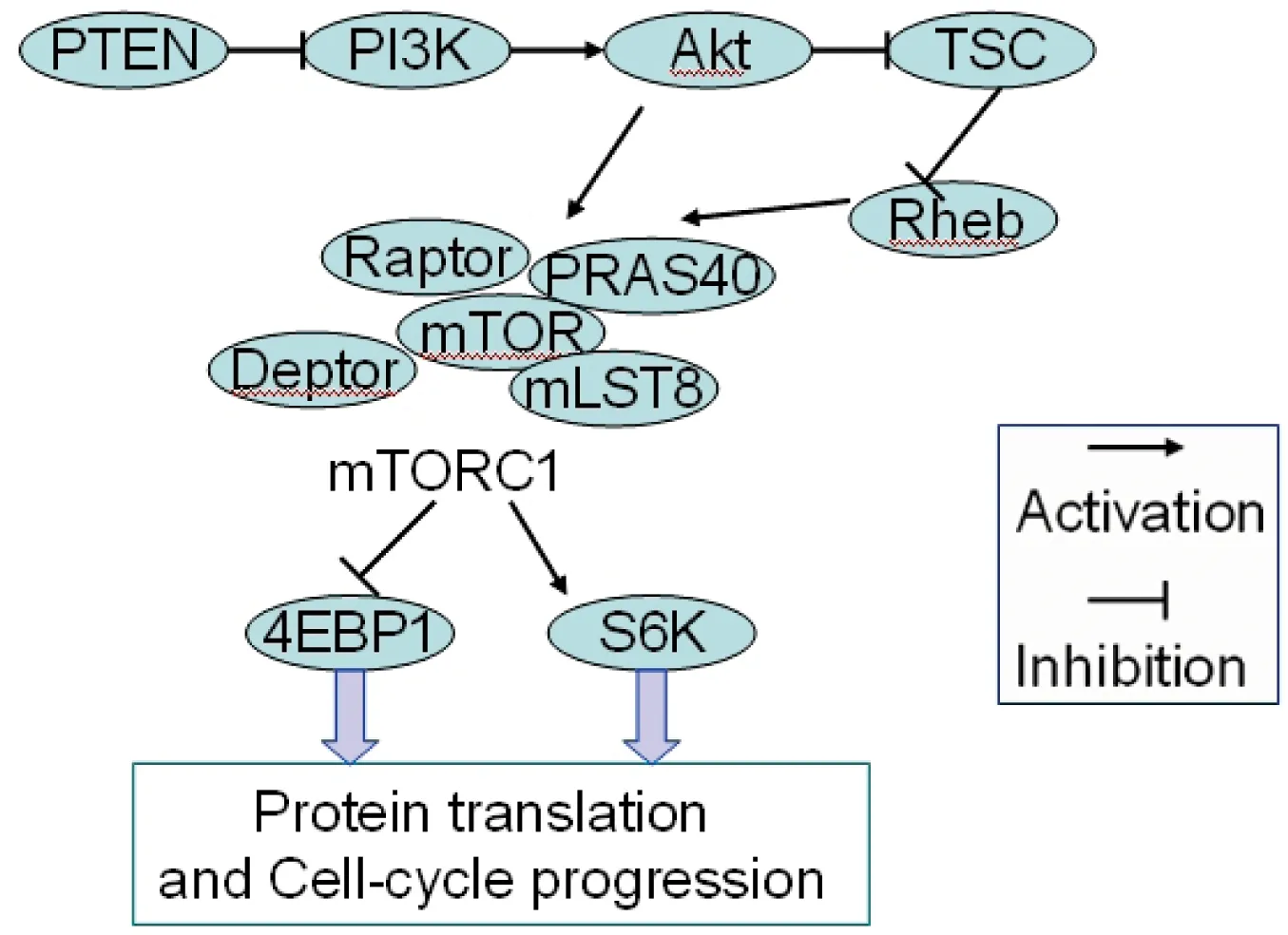
图1 PI3K-Akt-mTORC1信号途径对细胞生长增殖的调控
2 mTORC1对细胞生长增殖的调节
mTOR对于动物的生长和发育都是必不可少的,mTOR基因敲除的小鼠死于胚胎早期,mTOR敲除可以导致ES细胞的生长阻滞[8]。mTORC1复合物能够被雷帕霉素(rapamycin)强烈的抑制,而mTORC2不受其影响,因此雷帕霉素作为mTOR1的特异性抑制剂,在实验和临床中都有广泛的应用[9]。mTORC1特异性抑制剂雷帕霉素可通过降低CDK和cyclin复合物激酶的活性导致细胞进程被抑制,阻止细胞周期的转换,抑制细胞增殖。mTORC1能通过cyclin D1介导肝细胞的增殖分化。在原代肝细胞中过表达cyclinD1的表达能够促进肝细胞生长,相反,cyclinD1基因水平的降低与肝细胞分化能力的降低紧密相关[10]。雷帕霉素作用骨髓瘤细胞系细胞后mTOR及cyclinD1 mRNA表达水平均下调,因此mTORC1信号途径能通过下调cyclinD1的表达诱导细胞周期阻滞[11],在HL-60细胞中的研究结果得出了类似的结论[12]。mTORC1信号传导至下游至少两个独立靶蛋白,即S6K和4EBP1,在调节哺乳动物细胞大小时控制翻译(图1)。将大鼠禁食后重新饲喂能够促进肝细胞生长增殖,同时伴随着S6K和4EBP1磷酸化的增加,用雷帕霉素能够通过激活S6K翻译抑制这种诱导作用[13]。在大鼠妊娠期间的子宫肌层增殖中,活化的mTOR与磷酸化的P85亚基以及磷酸化S6K蛋白表达变化一致[14]。mTORC1的抑制剂能降低S6K和4EBP1的活性,并且导致细胞周期关键因子表达量的降低和活性的改变[15]。
除了对细胞增殖起作用外,mTORC1信号途径对于分化同样相当重要,mTORC1信号途径能够明显促进肝细胞分化[16]。mTORC1信号途径抑制剂雷帕霉素能有效抑制肝脏部分切除后肝细胞的生长增殖,并且使G0/G1细胞受到抑制。mTORC1信号通路能够诱导脂肪前体细胞3T3L1的分化,在3T3L1脂肪分化过程中,应用mTORC1特异性抑制剂雷帕霉素可以阻碍其分化。有研究证实通过雷帕霉素抑制mTORC1后发现促进成肌分化,揭示mTORC1信号通路抑制骨骼肌的分化。mTORC1信号通路的活化在成骨前体细胞的分化过程中也是必需的,应用雷帕霉素阻断该通路在成骨细胞中的活化,观察到成骨细胞的分化明显受到抑制[17]。mTORC1通过诱导DNA转录调节因子Id1和Id2的不同活性来影响上皮细胞的增殖和分化,研究表明雷帕霉素正是通过和Id1和Id2的相互作用而影响细胞的增殖和分化进而影响肿瘤细胞的形成[18]。
3小结
PI3K-Akt-mTORC1途径的过度活化能够引起细胞过度增殖,当通路过度激活时引起与增殖相关基因mRNA的大量转录,合成生长增殖所需蛋白,加速细胞的增殖;Akt激活后阻碍cyclin D1的降解,使细胞周期G1/S转换加快。在多数肝癌中都发现有mTOR 和S6K (mTOR复合物1的作用底物) 的过度表达[19]。通过雷帕霉素及其衍生物在小鼠模型和临床的研究,证实mTORC1信号通路在许多肿瘤中都扮演重要角色,雷帕霉素抑制mTORC1可以通过抑制血管生成等途径发挥强烈的抗癌作用[20];PI3K/mTORC双重抑制剂NVP-BEZ235通过引起细胞周期阻滞下调T细胞急性成淋巴细胞性白血病中PI3K-Akt-mTORC信号途径的异常活化[21]。另外,肝脏中Akt的活性与脂肪肝的发生紧密相关[22, 23]。因此,PI3K-Akt-mTORC1信号途径与正常细胞分化密切相关,但这条通路的异常活化在肿瘤发生过程中起着重要的作用。
参考文献:
[1]Gao N, Flym D C, Zhang Z, et al. G1 cell cycle progress ion and the expression of G1 cyclins are regulated by PI3K /AKT /mTOR /p70S6K1 signaling in human ovarian cancer cells[J]. Am J Physiol Cell Physiol, 2004, 287(2):281-291.
[2]Gera J F, Mellinghoff I K, Shi Y J, et al. AKT activity determines sensitivity to mammalian target of rapamycin (mTOR) inhibitors by regulating cyclin D1 and c-myc expression[J]. J Biol Chem, 2004, 279 (4):2737-2746.
[3]Mayo L D, Donner D B. A phosphatidylinositol 3-kinase /Akt path way promotes translocation of mdm2 from the cytoplasm to the nucleus[J]. Proc Natl Acad Sci USA, 2001, 98(20):11598-11603.
[4]Laprise P, Chailler P, Houde M, et al. Phosphatidylinositol 3-kinase controls human intestinal epithelial cell differentiation by promoting adherens junction assembly and p38 MAPK activation[J]. J Biol Chem, 2002, 277 (10) :8226-8234.
[5]Cao Y, Sun Z, Liao L, et al. Human adipose tissue-derived stem cells differentiate into endothelial cells in vitro and improve postnatal neovascularization in vivo[J]. Biochem Biophys Res Commun, 2005, 332 (2):370-379.
[6]Rosen N, She Q B. AKT and cancer-is it all mTOR [J] Cancer Cell, 2006, 10 (4):254-256.
[7]Storm M P, Bone H K, Beck C G, et al. Regulation of Nanog expression by phosphoinositide 3-kinase-dependent signaling in murine embryonic stem cells[J]. J Biol Chem, 2007, 282 (9): 6265-6273.
[8]Takahashi K, Murakami M, Yamanaka S. Role of the phosphoinositide 3-kinase pathway in mouse embryonic stem (ES) cells[J]. Biochem Soc Trans, 2005, 33 :1522-1525.
[9]Wu P, Hu Y Z. PI3K/Akt/mTOR pathway inhibitors in cancer: a perspective on clinical progress[J]. Curr Med Chem, 2010, 17(35):4326-4341.
[10]Zhang F, Shu R, Wu X, et al. Delayed liver injury and impaired hepatocyte proliferation after carbon tetrachloride exposure in BPOZ2-deficient mice[J]. Toxicol Lett, 2009, 188(3):201-207.
[11]师佳佳, 贾晓辉, 李晓红, 等. 雷帕霉素对骨髓瘤细胞RPMI8226增殖、凋亡及趋化因子受体CXCR4表达的影响[J]. 中国实验血液学杂志, 2009, 17: 385-389.
[12]崔亚兰, 曹诗运. 雷帕霉素对HL-60 细胞增殖和凋亡的影响[J]. 南华大学学报:医学版, 2008, 36: 316-319.
[13]Anand P, Gruppuso P A. Rapamycin inhibits liver growth during refeeding in rats via control of ribosomal protein translation but not cap-dependent translation initiation[J]. J Nutr, 2006, 136:27-33.
[14]Jaffer S, Shynlova O, Lye S. Mammalian target of rapamycin (mTOR) is activated in association with myometrial proliferation during pregnancy[J]. Endocrinology, 2009, 150 (10): 4672-4680.
[15]Guigon C J, Fozzatti L, Lu C, et al. Inhibition of mTORC1 signaling reduces tumor growth but does not prevent cancer progression in a mouse model of thyroid cancer[J]. Carcinogenesis, 2010, 31(7):1284-1291.
[16]Chen P, Yan H, Chen Y, et al. The variation of AkT/TSC1 TSC1/mTOR signal pathway in hepatocytes after partial hepatectomy in rats[J]. Exp Mol Pathol, 2009, 86(2):101-107.
[17]Isomoto S, Hattori K, Ohgushi H, et al. Rapamycin as an inhibitor of osteogenic differentiation in bone marrow-derived mesenchymal stem cells[J]. J Orthop Sci, 2007, 12 (1): 83-88.
[18]Jankiewicz M, Groner B, Desrivieres S. Mammalian target of rapamycin regulates the growth of mammary epithelial cells through the inhibitor of deoxyribonucleic acid binding Id1 and their functional differentiation through Id2[J]. Mol Endocrinol, 2006, 20 (10):2369-2381.
[19]Sieghart W, Fuereder T, Schmid K, et al. Mammalian target of rapamycin pathway activity in hepatocellular carcinomas of patients undergoing liver transplantation[J]. Transplantation, 2007, 83(4) :425-432.
[20]Semela D, Piguet A C, Kolev M, et al. Vascular remodeling and antitumoral effects of mTOR inhibition in a rat model of hepatocellular carcinoma[J]. J Hepatol, 2007, 46(9):840-848.
[21]Chiarini F, Grimaldi C, Ricci F, et al. Activity of the novel dual phosphatidylinositol 3-kinase/mammalian target of rapamycin inhibitor NVP-BEZ235 against T-cell acute lymphoblastic leukemia[J]. Cancer Res, 2010, 70(20):8097-107.
[22]Ono H, Shimano H, Katagiri H, et al. Hepatic Akt activation induces marked hypoglycemia, hepatomegaly, and hypertriglyceridemia with sterol regulatory element binding protein involvement[J]. Diabetes, 2003, 52: 2905-2913.
[23]Leavens K F, Easton R M, Shulman G I, et al. Akt2 is required for hepatic lipid accumulation in models of insulin resistance[J]. Cell Metab, 2009, 10: 405-418.
——雷帕霉素

