6种无机絮凝剂对布朗葡萄藻的絮凝效应
郭婷婷,娄永江
(宁波大学 海洋学院, 浙江 宁波 315211)
布朗葡萄藻(Botryococcusbraunii,俗称油藻),是一种适应性较强的单细胞绿色微藻,大小在30~500 μm左右[1,2]。布朗葡萄藻富含胞外多糖、维生素和多不饱和脂肪酸等物质,有较强的产烃能力,其产烃量最高可达细胞干重的86%,远远高于其它微生物的产烃量(几乎都低于1%),在食品生产和水产养殖中应用较为广泛,是近年在保健食品生产及鱼、虾育苗等领域应用较佳的经济藻类[3-7]。布朗葡萄藻作为二十碳五烯酸(EPA)、二十二碳六烯酸(DHA)等高度不饱和脂肪酸和可再生、无毒的生物质液体燃料的新来源日益受到国内外科研工作者的重视[8,9]。目前由于布朗葡萄藻采收困难,导致其生物质采收费用要远大于其养殖的费用[7,10],已严重阻碍布朗葡萄藻产业的发展,因此研究布朗葡萄藻的沉降及采收具有较大的价值。无机絮凝剂絮凝沉降法具有高效、易控制、廉价等优点,在微藻的采收上应用广泛。林喆、黄振英[7,10]等研究表明通过无机絮凝剂可以在保持藻体的活性下使藻类沉淀,从而达到浓缩的效果,便于采收。而关于无机絮凝剂对布朗葡萄藻的絮凝效应的研究未见报道。为此,本文采用单因子试验方法,研究了不同浓度的硫酸铝、硫酸铝铵、硫酸铝钾、硫酸镁、硫酸铁、氯化铁对布朗葡萄藻絮凝效果的影响,旨在确定其絮凝最佳无机絮凝剂及浓度,以期为布朗葡萄藻的采收提供理论依据和科学指导。
1 材料与方法
1.1 材料
试验用布朗葡萄藻由宁波大学生物饵料培养实验室提供。用于微藻培养的海水均经脱脂棉过滤、煮沸消毒,采用MAV[11]培养液。培养条件:温度(25±1)℃,自然光照,不充气培养15~30 d。
1.2 方法
1.2.1 布朗葡萄藻测定波长确定
采用光谱扫描法[12, 13]。选取同一批不同细胞密度的藻液,以MAV培养液作为空白对照,在620~700 nm间每隔5 nm进行光谱扫描,绘制吸收曲线,选择吸光值较高且平稳的波长为其测定波长。
1.2.2 布朗葡萄藻细胞密度标准曲线绘制
采用光密度法[12, 13],以细胞密度表征布朗葡萄藻的生物量。配制不同细胞密度的布朗葡萄藻藻液,采用血球计数板法[14]测定布朗葡萄藻藻液的细胞密度。最佳测定波长下测定不同细胞密度藻液的吸光值,绘制吸光值与细胞密度的标准曲线。
1.2.3 无机试剂絮凝效应测定
以沉降高度和沉降率表征絮凝效应,设不同浓度的硫酸铝、硫酸铝铵、硫酸铝钾、硫酸镁、氯化铁和硫酸铁溶液。藻液pH值为8的条件下,将6种无机絮凝剂分别添加到75 mL(容器半径为1.3 cm,最高高度为14.4 cm)布朗葡萄藻藻液中进行絮凝试验。藻液初始细胞密度为ρ0(万个/mL),初始藻液高度h0(cm)。在10、25、40、60、120 min时测量沉降后下层藻液高度h1(cm),计算沉降高度h沉降(cm);在40、60、120 min时记录上清藻液OD680,根据1.2.2所绘标准曲线计算上清藻液细胞密度ρ1(万个/mL),计算其沉降率P沉降(%);沉降高度和沉降率计算公式如下:
h沉降=h0-h1
(1)
P沉降=(ρ0-ρ1)/ρ0×100
(2)
2 结果与讨论
2.1 布朗葡萄藻测定波长确定
图1为不同细胞密度布朗葡萄藻藻液的光谱扫描结果。在试验设定的不同波长中,所测得的不同细胞密度的藻液均在680 nm±5 nm处存在相对较大且平稳吸收峰,与黄美玲[12]等报告的小球藻及沈萍萍[13]等报告的15种微藻的最佳测定波长相同,最佳测定波长与其色素种类组成及含量有关,说明布朗葡萄藻与大部分微藻含有相似的色素。为此,以OD680表征布朗葡萄藻的吸光值。

图1 不同细胞密度布朗葡萄藻光谱扫描图
2.2 680 nm条件下吸光值与细胞密度之间的关系
同一批不同细胞密度的布朗葡萄藻藻液,血球计数板计数法(n=5)测定细胞密度,采用光密度法,绘制吸光值与藻细胞密度之间的吸收曲线。图2表明,在680 nm的波长下,吸光值与细胞密度线性相关度达R2=0.9918,可用OD680表征布朗葡萄藻的细胞密度。
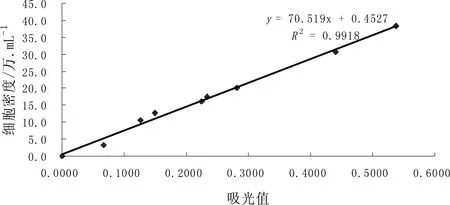
图2 680 nm波长下藻液吸光值与细胞密度标准曲线
2.3 无机絮凝剂絮凝效应
2.3.1 絮凝效应的表征及絮凝时间
实验发现,沉降高度反映沉降后布朗葡萄藻藻液含水量,即富集度,沉降高度越高,富集度越好;沉降率反应沉降后布朗葡萄藻的得率,沉降率越高,得率越高;因此以沉降高度和沉降率综合表征絮凝效应。同时布朗葡萄藻经6种无机絮凝剂絮凝处理,60 min后沉降高度和沉降率趋于稳定,以60 min絮凝处理后的沉降高度、沉降率表征6种无机试剂对布朗葡萄藻的絮凝效应。
2.3.2 铝(Ⅲ)盐絮凝效应
从图3(a)中可以看出,随着硫酸铝添加量的增加,沉降高度呈现上升趋势,但在60 min后并无显著差异(P>0.05)。藻液在絮凝60 min后,不同浓度的硫酸铝的沉降高度在11.88~12.24 cm之间(P>0.05);从图3(b)中可以看出,硫酸铝对藻液的沉降率在絮凝60 min后趋于稳定,不同浓度的硫酸铝对藻液的沉降率有显著差异(P<0.05),当添加量为1.1 g/L时出现最大值为91.2%。
从图4(a)絮凝结果可以看出,硫酸铝铵的添加量在0.5~0.7 g/L时,不同浓度的硫酸铝铵对沉降高度的影响并不显著(P>0.05)。沉降60 min藻液稳定后,硫酸铝铵的添加量为1.1 g/L时,沉降高度出现最大值为12.42 cm。但是,当硫酸铝铵浓度大于0.7 g/L时,藻体部分死亡变白,硫酸铝铵浓度大于1.2 g/L时,藻体全部死亡。因此硫酸铝铵的最适添加量应为0.5 g/L,絮凝60 min后沉降高度为12.06 cm,沉降率为83.2%(图4b)。
不同浓度的硫酸铝钾对藻液的沉降高度及沉降率有显著差异(P<0.05),藻液的沉降高度和沉降率随硫酸铝钾浓度的增加呈现上升趋势(图5)。从图中可以看出,沉降60 min后,沉降高度与沉降率趋于稳定,此时藻液的沉降高度最大为12.06 cm(图5a),沉降率为93.5%(图5b)。硫酸铝钾浓度大于0.5 g/L时,藻体部分死亡变白,因此硫酸铝钾的添加量应小于0.5 g/L。在添加量为0.45 g/L,沉降60 min后,藻液的沉降高度为10.08 cm,沉降率为93.5%。
3种铝(Ⅲ)盐对布朗葡萄藻的絮凝效应不同,是由于在pH值为8条件下3种盐中的铝离子强度的不同,离子强度越强,铝离子对细胞壁上多糖的络合力就越强,吸附效率越高,絮凝效应越好[15,16];高浓度硫酸铝铵对布朗葡萄藻之所以有致死作用,主要是铵离子对藻体有胁迫作用,抑制丛粒藻烯的合成,后期造成不可逆的毒害作用[17];而硫酸铝钾其本身有一定毒性,需在食品和藻类中慎加,对布朗葡萄藻藻体的细胞壁有不可逆的毒害作用,易造成藻体死亡。

图3 不同浓度硫酸铝对布朗葡萄藻的絮凝效应

图4 不同浓度硫酸铝铵对布朗葡萄藻的絮凝效应

图5 不同浓度硫酸铝钾对布朗葡萄藻的絮凝效应
2.3.3 镁(Ⅱ)盐絮凝效应
从图6(a)中可以得出,随着硫酸镁添加量的增加,藻液沉降高度呈显著的上升趋势(P<0.05),在絮凝时间高于60 min后,沉降高度趋于稳定。对于沉降率(图6b),有相同的趋势。但是,硫酸镁浓度≥1.0 g/L时,藻体部分死亡变白,硫酸镁浓度≥1.3 g/L时,藻体全部死亡。因此,硫酸镁对藻液絮凝作用的最适添加量为0.8~0.9 g/L,沉降高度和沉降率分别为10.80 cm和81.0%。
高浓度的硫酸镁溶液之所以对布朗葡萄藻有致死作用,主要是因为镁离子对布朗葡萄藻有胁迫作用[18],易引起布朗葡萄藻死亡变白。

图6 不同浓度硫酸镁对布朗葡萄藻的絮凝效应
2.3.4 铁(Ⅲ)盐絮凝效应
以硫酸铁为絮凝剂对布朗葡萄藻的絮凝作用见图7。从图7(a)中可以看出,随着添加量的增大,藻液的沉降高度呈显著变化(P<0.05)。60 min后,硫酸铁的添加量为1.2 g/L时,有最高的沉降高度为10.8 cm,此时藻液的沉降率为47.9%(图7b);对于藻液的沉降率,在整个絮凝过程中随硫酸铁的添加量的增加呈显著的上升趋势(P<0.05),硫酸铁的添加量为1.4 g/L时,其最大值为65%(图7b)。
图8为不同浓度的氯化铁对布朗葡萄藻絮凝效应的影响。藻液的沉降高度随絮凝时间增加显著的上升(P<0.05),在60 min后趋于稳定(图8a);在絮凝剂的添加量高于0.7 g/L后,絮凝高度有明显的上升过程;从氯化铁对其絮凝结果中可以看出(图8b),絮凝剂的浓度对沉降率并无显著作用(P>0.05),并且在絮凝60 min后趋于稳定。添加量为0.9 g/L时,藻液的沉降高度和沉降率达到最大值,分别为10.62 cm、88.0%。
两种铁(Ⅲ)对布朗葡萄藻絮凝效应的差异,主要是因为在碱性条件下两种铁盐的离子强度:氯化铁>硫酸铁,氯化铁更易与藻体形成絮凝而沉降[15,16]。

图7 不同浓度硫酸铁对布朗葡萄藻的絮凝效应

图8 不同浓度氯化铁对布朗葡萄藻的絮凝效应
3 结论
本研究采用光密度法测定布朗葡萄藻的生物量,确定了布朗葡萄藻的最佳测定波长为680 nm,得出了OD680与藻液细胞密度的相关性标准曲线,说明光密度测定生物量的可行性,以此间接测定布朗葡萄藻的絮凝效应。
根据絮凝单因素试验,发现6种无机试剂对布朗葡萄藻均有明显的絮凝效应,但硫酸铝铵、硫酸铝钾、硫酸镁超过一定添加量会造成藻体死亡;同时发现硫酸铝、硫酸铝钾、氯化铁3种无机试剂的絮凝效果较其它3种无机试剂明显;根据试验得出:絮凝时间控制在60 min;硫酸铝浓度控制在1.1 g/L,沉降高度为12.24 cm,沉降率为91.2%;硫酸铝钾浓度控制在0.45 g/L以内,沉降高度为10.08 cm,沉降率为93.5%;氯化铁浓度控制在0.9 g/L,沉降高度为10.62 cm,沉降率为88.0%。
参考文献:
[1]徐 玲, 刘春朝, 李华钟.布朗葡萄藻的培养基选择及其产物代谢规律[J].生物加工过程,2010,8(6):40-45.
[2]许常虹, 俞敏娟.成油藻-布朗葡萄藻的研究[J].水生生物学报,1988,12(1):90-93.
[3]Brown C, Knights B A. Hydrocarbon content and its relationship to physiological state in the green algaBotryococcusbraunii[J]. Phyotchemsitry, 1969, 8(3):543-547.
[4]Tran H L, Kwon J S, Kim Z H, et al. Statistical optimization of culture media for growth and lipid production ofBotryococcusbrauniiLB572[J]. Biotechnology and Bioprocess Engineering, 2010, 15(2):277-284.
[5]Moheimani N R, Matsuura H, Watanabe M M, et al. Non-destructive hydrocarbon extraction fromBotryococcusbrauniiBOT-22(race B)[J]. Journal of Applied Phycology, 2013:1-11.
[6]吴夏芫,李 环,韦 萍.能源微藻—葡萄藻生物学特性的研究进展[J].安徽农业科学,2008,36(17):7378-7379.
[7]林 喆,匡亚莉,郭 进,等.微藻采收技术的进展与展望[J].过程工报,2009,9(6):1242-1248.
[8]Talukdar J, Kalita M C, Goswami B C. Characterization of the biofuel potential of a newly isolated strain of the microalgaBotryococcusbrauniiKtzing from Assam, India[J]. Bioresource Technology, 2013, 149:268-275.
[9]Tran H L, Hong S J, Lee C G. Evaluation of extraction methods for recovery of fatty acids fromBotryococcusbrauniiLB 572 andSynechocystissp. PCC 6803[J]. Biotechnology and Bioprocess Engineering, 2009, 14(2):187-192.
[10]黄振华, 柯爱英, 池 伟,等.7种试剂对3种饵料微藻絮凝效应的研究[J].安徽农业科学,2010,38(15):7734-7736; 7741.
[11]蒋霞敏, 郑亦周.14种微藻总脂含量和脂肪酸组成研究[J].水生生物学报,2003,27(3):243-247.
[12]黄美玲,何 庆,黄建荣,等.小球藻生物量的快速测定技术研究[J].河北渔业,2010,(4):1-3.
[13]沈萍萍,王朝晖,齐雨藻,等.光密度法测定微藻生物量[J].暨南大学学报:自然科学与医学版,2001,22(3): 115-119.
[14]周群英,高延耀.环境工程微生物学[M].北京:高等教育出版社,2000:292-293.
[15]王 宪,徐鲁荣,陈丽丹,等.海藻生物吸附金属离子技术的特点和功能[J].台湾海峡,2003,22(1):120-124.
[16]王 宪,陈丽丹,徐鲁荣,等.海藻生物吸附金属离子的机理和影响因素[J].台湾海峡,2003,22(2):262-268.
[17]Ohmori M, Wolf F R, Bassham J A.Botryococcusbrauniicarbon/nitrogen metabolism as affected by ammonia addition[J]. Archives of Microbiology, 1984, 140(2/3):101-106.
[18]周洪英,王学松,李 娜,等.关于海藻吸附水溶液中重金属离子的研究进展[J].科技导报,2006,24(12):61-66.

