交让木内生真菌JR0203代谢产物抗氧化及抑菌活性研究
,,*,,,
(1.三峡大学化学与生命科学学院,湖北宜昌 443002;2.三峡大学天然产物研究与利用湖北省重点实验室,湖北宜昌 443002)
交让木(Daphniphyllummacropodum)是虎皮楠科的一种常绿乔木,高可达20m。主要产于长江流域以南各省地区及台湾[1],散生于海拔800~1500m的较湿润林中,常与木荷、楠木、杜英、丝栗栲、马尾松等混生。因其新叶集生枝顶端,老叶在春天新叶长出后齐落,故名“交让木”[2-3]。交让木在我国传统医药中有一定药用价值,药性辛、苦、凉,多有清热解毒、活血散瘀、祛风止痛、治疮疖肿毒等功效,牛耳枫子还有止痢的功效[4-5]。由于该属植物中含有很多结构复杂而奇特的多环生物碱,受到越来越多研究者的重视[6-7]。从 20世纪60年代对交让木开始进行生物碱成分研究至今,研究人员共从12种虎皮楠科植物中分离鉴定出13种骨架类型的生物碱128个,其中仅有少数生物碱对鼠淋巴瘤细胞株L1210表现出强的抑制活性,而其它大多数的虎皮楠生物碱的生物活性测试令人失望[8-9]。
内生真菌长期生活在植物体内的特殊环境中,并与寄主协同进化,根据内共生理论,内生真菌可能产生与宿主相同或相似的具有生物活性的次生代谢产物[10-12]。这些活性次级代谢产物具有抗菌、抗氧化、抗肿瘤等生物活性,如姜广策等[13]从中国南海红树中分离到的内生真菌的发酵液粗提物具有明显的抗菌活性。Huang等[14]从夹竹桃Neriurn oleander L中分离到42株内生真菌,75% 的内生真菌有抗氧化作用。目前尚未见对交让木内生真菌的代谢产物生物活性研究的报道。本实验采用牛津杯法测定交让木内生真菌JR0203代谢产物的各提取物的抑菌活性,并采用清除DPPH自由基(DPPH·)法和Fe3+的还原力法测定其各提取物的抗氧化活性,从而为进一步开发利用交让木这一药食两用资源提供研究基础。
1 材料与方法
1.1 材料与仪器
交让木JR0203内生真菌(Rhizoctonia. sp.JR0203),金黄色葡萄球菌(Staphylococcusaureus,ATCC 6538),大肠杆菌(Escherichiacoli,ATCC 8739),绿脓杆菌(PseudomonsaeruginosaATCC 9027),枯草芽孢杆菌(BacillussubtilisATCC 6633) 由三峡大学化学与生命科学学院微生物室提供。
DPPH(2,2-二苯基-1-苦肼基) Sigma公司;乙酸乙酯、甲醇、乙醇、石油醚、正丁醇、铁氰化钾、三氯乙酸、VC、磷酸二氢钠、磷酸氢二钠、三氯化铁 均为国产分析纯。
立式压力蒸汽灭菌锅 上海博迅实业有限公司医疗设备厂;GSP-9270MBE隔水式恒温培养箱 上海博迅实业有限公司医疗设备厂;EYELA旋转蒸发仪旋转蒸发器;超净工作台 上海博迅实业有限公司医疗设备厂;UV-3100型紫外可见分光光度计 上海美普达仪器有限公司。
1.2 实验方法
1.2.1 培养基的配制 PDA培养基:新鲜马铃薯洗净去皮,切成小方块,称取200g,加适量水煮沸30min后过滤得滤液,加蔗糖20g,加水至1000mL,自然pH,121℃灭菌30min。
牛肉膏蛋白胨固体培养基:10g蛋白胨,5g牛肉膏,10g NaCl,1.5%琼脂,加水溶解后,调pH至7.4,定容至1L,121℃ 灭菌30min。
1.2.2 种子液的制备 在无菌条件下,将JR0203菌种接种于固体PDA斜面上活化,28℃培养36h备用。配制1L种子液培养基,分装到500mL的锥形瓶中,其装液量为200mL,121℃灭菌30min。在无菌条件下,将PDA斜面上已活化的JR0203菌种挑取一环接种于种子液培养基中,在28℃,200r/min的摇床中培养5d左右。
1.2.3 发酵培养 待种子液培养完后,培养基中长出菌丝球,再配制4L液体发酵培养基,分装到500mL的锥形瓶中,装液量为200mL,121℃灭菌30min。在无菌条件下,将种子液接种于液体发酵培养基中,接种量为5%,在28℃、200r/min的摇床中培养观察,直至发酵液颜色和菌丝球大小密度稳定,即10d左右。
1.2.4 内生真菌HS0107次生代谢产物提取 待发酵培养完后,用纱布过滤发酵培养基,得到发酵滤液和菌丝体。在得到的滤液中加入等体积的乙酸乙酯进行萃取,反复萃取三次,旋蒸浓缩得滤液乙酸乙酯提取物1号样品,待用。
将晾干后的菌丝体剪碎后放入45℃烘箱中烘干,烘干后用研钵将其研碎,等分三份,分别加入甲醇、乙醇、乙酸乙酯提取,各提取剂反复提取三次,旋蒸浓缩分别得到菌丝体甲醇提取物2号样品、菌丝体乙醇提取物3号样品和菌丝体乙酸乙酯提取物4号样品,待用。
比较1号样、2号样、3号样和4号样的抗氧化活性和抑菌活性,发现滤液乙酸乙酯提取物1号样的抗氧化活性的DPPH IC50为0.16mg/mL,抗氧化活性高于与菌丝体各提取物,且1号样具有一定的抑菌活性。然后对1号样用蒸馏水分散,依次用石油醚、乙酸乙酯和正丁醇萃取得滤液石油醚部位5号样、滤液乙酸乙酯部位6号样、滤液正丁醇部位7号样和水萃余相浓缩物8号样,待用。
1.2.5 抗氧化活性的测定
1.2.5.1 DPPH自由基清除能力的测定 精确称取15.8mg DPPH,溶于100mL无水乙醇,配制成0.4mmol/L的DPPH母液。依次精确量取0.1、0.15、0.20、0.25、0.30、0.5、0.75、1mL的DPPH母液稀释至2.00mL,在517nm下测其吸光度,得标准曲线[15-16]。
将1.0mL粗样品溶液与1.0mL 0.15mmol/L的DPPH溶液加入同一试管中,摇匀,放置30min后用溶剂做参比,测定其吸光度Ai,同时测定1.0mL 0.15mmol·L的DPPH溶液与1.0mL溶剂混合后的吸光度A0,以及1.0mL粗样品溶液与1.0mL溶剂混合后的吸光度Aj按照下式计算清除率,清除率越大,抗氧化能力越强。
清除率(S)=[1-(Ai-Aj)/A0]×100
式中:A0:未加抗氧剂时溶液的吸光度;Ai:加抗氧剂后溶液的吸光度;Aj:样品在测定波长的吸光度。
1.2.5.2 Fe3+还原力测定 取2.5mL不同质量分数的样品溶液,加入0.2mol/L,pH为6.6的磷酸缓冲溶液2.5mL及1%的铁氰化钾2.5mL,50℃水浴反应20min后急速冷却,加入10%三氯乙酸溶液2.5mL,再用微孔过滤器过滤,取上清液5mL,加蒸馏水4mL,及0.1% FeCl31mL,混合均匀,10min后于700nm处测定吸光值,吸光值越大则还原力越强。同时以VC作为阳性对照[17-18]。
1.2.6 抑菌活性的测定 制备菌悬液和各样品:在无菌操作台内,用灭菌的接种环取一环供试菌种,转入备好的40mL无菌水中,充分振荡以使菌细胞或菌丝分散。用血小球计数板测菌液的浓度,然后调配使其浓度为1.0×105cfu/mL。JR0203代谢产物的8种提取物用无菌蒸馏水稀释定容到10mg/mL。
牛津杯法[19]:先配制好1L的牛肉膏蛋白胨培养基,121℃灭菌30min,然后在无菌条件下,用取0.1mL指示菌菌悬液于PDA培养基表面用涂布器涂布均匀,放置15min,然后取4个牛津杯均匀放置在每个平皿上,用移液枪向每个牛津杯中加入样品50μL,每个样品重复2个平皿,然后37℃培养14~17h,测抑菌直径,计算其平均值。用无菌水做对照,测定JR0203代谢产物的提取物对四种指示菌的抑菌活性。

表1 JR0203代谢产物的提取物对DPPH·清除活性的IC50值Table 1 IC50 values of different extracts from the metabolites of JR0203 for scavenging DPPH free radicals

表2 抑菌圈直径的平均值(cm)Table 2 The inhibitory zone diameter of different extracts from the metabolites of JR0203 (cm)
1.3 数据处理
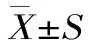
2 结果与分析
2.1 JR0203代谢产物的提取物对DPPH·清除能力的测定
按照实验方法1.2.5.1的(1)得到DPPH和A之间的标准曲线:Y=9.2637X+0.0427,R2=0.9981。由图1可知,JR0203代谢产物的提取物对DPPH自由基的清除率总体趋势是随浓度的增加而提高,但当浓度增加到一定值后,DPPH·清除率随浓度的增大不再明显提高,反而有所下降,主要原因是样品颜色加深和溶解性问题,使得空白吸光值较大。图1中,相同浓度的滤液乙酸乙酯提取物对DPPH·清除率效果明显高于菌丝体甲醇、乙醇、乙酸乙酯提取物,说明清除效果较好的物质主要集中JR0203发酵液中,其抗氧化活性物质主要分泌在胞外。比较滤液乙酸乙酯提取物的各萃取物对DPPH·清除率效果发现,各部位对DPPH·清除率与萃取剂的极性有一定的关系,其清除效果较好的物质主要集中于极性适中的乙酸乙酯部位中,其乙酸乙酯部位对DPPH·清除率效果最好,与VC相当;次之为正丁醇部位,当质量浓度达到1.25mg/mL,其清除率达到93.87%;再次之为水萃取物,当质量浓度达到2.5mg/mL,其清除率达到93.43%;活性最差的为石油醚部位,当质量浓度达到5mg/mL,其清除率仅为11.87%。

图1 JR0203代谢提取物对DPPH·清除率 Fig.1 Scavenging rates of different extracts from the metabolites of JR0203 against DPPH free radicals
2.2 JR0203代谢产物的提取物对DPPH·清除活性的IC50值的影响
由表1可知,JR0203代谢产物的提取物对DPPH·清除活性IC50值顺序为:5>3>2>4>8>7>1>6,即石油醚部位>菌丝体乙醇提取物>菌丝体甲醇提取物>菌丝体乙酸乙酯提取物>水相部位>正丁醇部位>滤液乙酸乙酯提取物>乙酸乙酯部位。IC50的值越小说明对DPPH·的清除效果越好。在各种提取物中,滤液的乙酸乙酯萃取物对DPPH·清除活性IC50明显小于菌丝体提取物三个样品,而滤液的乙酸乙酯萃取物的各个部位对DPPH·清除活性IC50值顺序值为:石油醚部位>水萃余物>正丁醇部位>乙酸乙脂部位。说明滤液的乙酸乙酯萃取物的乙酸乙酯部位的DPPH·清除活性最强,其IC50值为0.04 mg/mL,对DPPH·的清除活性与VC相当;次之为正丁醇部位较VC弱,IC50值约为VC的8倍;IC50值最大的为石油醚部位,达到811mg/mL,可认为对DPPH·没有清除活性。
2.3 JR0203代谢产物的提取物对Fe3+还原力的测定
还原力的测定,可检测化合物是否为良好的电子供应体,它所提供的电子可使Fe3+还原为Fe2+,从而使体系溶液颜色改变,即反映出体系中氧化还原状态的改变,吸光值越大,还原力越强,抗氧化效果愈佳[18,20]。由图2可以看出,在测定浓度范围内,各样品与VC溶液对Fe3+的还原为随浓度的增加而增加。各样品对Fe3+的还原力大小顺序为6>1>7>8>4>2>3>5,即乙酸乙酯部位>滤液乙酸乙酯提取物>正丁醇部位>水萃余物>菌丝体乙酸乙酯提取物>菌丝体甲醇提取物>菌丝体乙醇提取物>石油醚部位,这与样品对DPPH·的清除率大小顺序基本一致,滤液的乙酸乙酯萃取物的乙酸乙酯部位Fe3+的还原力比其他样品都强,略低于同浓度的VC溶液。

图2 JR0203代谢产物的提取物以及VC对Fe3+的还原力曲线 Fig.2 Ferric reducing power curves of different extracts from the metabolites of JR0203
2.4 JR0203代谢产物的提取物的抑菌活性
由表2可知,滤液乙酸乙酯提取物的乙酸乙酯部位和滤液乙酸乙酯提取物对金黄色葡萄球菌、枯草芽孢杆菌、大肠杆菌、绿脓杆菌均有抑菌活性;菌丝体乙酸乙酯提取物对四种指示菌均有抑菌活性;正丁醇部位对四种指示菌也有一定抑菌活性;而菌丝体甲醇提取物、菌丝体乙醇提取物、水萃取物和石油醚部位几乎没有抑菌活性。
3 结论
DPPH·是一种稳定的自由基,其在可见光区有特征吸收,比色测定简便、快捷。自由基清除剂存在,DPPH·的单电子被配对而使其颜色变浅,在最大吸收波长处的吸光度变小,且颜色变浅的程度与配对电子数是成剂量关系的,因此可用于天然抗氧化剂的筛选[21]。本文采用清除DPPH自由基(DPPH·)法和Fe3+的还原力法测定交让木内生真菌JR0203代谢产物各提取物的抗氧化活性,然后采用牛津杯法测定各提取物的抑菌活性,发现滤液乙酸乙酯提取物的乙酸乙酯部位有较强的抗氧化活性,其对金黄色葡萄球菌、大肠杆菌、枯草芽孢杆菌和绿脓杆菌具有抑制活性。
基于滤液乙酸乙酯提取物的乙酸乙酯部位具有良好的抗氧化和抑菌活性,可对其进行正向硅胶柱、反向硅胶柱和高效液相色谱等方法继续分离,可得到抗氧化和抑菌活性较好的单体化合物。交让木内生真菌JR0203可大规模液体发酵培养,培养基价格低廉,培养条件容易控制,为天然的抗氧化剂和防腐剂的开发提供了一种新的来源。
[1]中国科学院植物研究所. 中国高等植物图鉴[M].北京:科学出版社,1972:627.
[2]李晓征,郝日明,任燕.遮荫处理对不同苗龄交让木的生长和光合特性的影响[J].广西植物,2006,26(5):499-502.
[3]国家中医药管理局《中华本草》编委会.中华本草,第4卷,上海科学技术出版社,上海,1998,865.
[4]王奎武,张虹,沈莲清. 交让木属植物中生物碱类化合物的研究进展[J]. 林产化学与工业,2008,28(4):123-124.
[5]Zhan Z J,Yang S P,Yue J M. Paxdaphnidines A and B,novel penta and tetracyclic alkaloids from Daphniphyllum paxinum[J]. J Org Chem,2004,69:1726-1729.
[6]Sation S,Kubota G A,Fukushi E,etal. Calyciphylline C,a novel Daphniphyllum alkaloid from Daphniphyllum calycinum[J]. Tetrahedron Lett,2007,48:1587-1589.
[7]Morita H,Takatsu H,Shen Y C,etal. Daphniglancin C,a novel tetracyclic alkaloid from Daphniphyllum glaucescens[J]. Tetrahedron Lett,2004,45:901-904.
[8]李震宇,郭跃伟. 虎皮楠生物碱研究进展[J]. 有机化学,2007,27(5):574-575.
[9]国家中医药管理局《中华本草》编委会,中华本草,第4卷,上海科学技术出版社,上海,1998:865.
[10]孙力军,陆兆新,别小妹,等. 1株抗菌植物内生菌EJH-2菌株的分离和鉴定[J].中国微生态学杂志,2006,18(1):23-26.
[11]Afonso DL,Souza,Edson Rodrigues-Filho,etal.Koninginins,phospholipase A2 inhibitors from endophytic fungus Triehoderma koningii[J].Toxicon,2008,51(2):240.
[12]陈笑笑,于海宁.仙鹤草内生真菌的分离鉴定与抗菌活性[J].浙江工业大学学报,2011,39(1):39-43.
[13]姜广策,林永成,周世宁,等. 中国南海红树内生真菌No11403次级代谢物的研究[J].中山大学学报:自然科学版,2000,39(6):68-72.
[14]Huang WuYang,Cai YiZhong,Kevin D.Hyde,etal. Endophytic fungi from Nerium oleander L(Apocynaceae):main constituents and antioxidant activity[J].World J Microbiol Biotechnol,2007,23:1253.
[15]Cano MP,Hemandez A,Ancos BD. High pressure and temperature effects on enzyme inactivation in strawberry and orange produce[J].Food Sci,1997,62(1):85-88.
[16]Penasa E,Prestamoa G,Poloc F. Enzymatic proteolysis,under high pressure of soybean whey:Analysis of peptides and the allergen Gly in the hydrolysates[J]. Food Chemistry,2006,99(3):569-573.
[17]但飞君,鄢文芳,褚立军,等. 红毛七乙醇提取物和不同极性部位抗氧化活性的研究[J]. 食品工业科技,2011,32(1):68-74.
[18]邓靖,莫正昌,汲广全,等. 蛇菰提取物体外抗氧化活性研究[J].食品科学,2010,31(5):23-25.
[19]马养民,田从丽,张弘弛. 杜仲内生真菌的分离鉴定及抗菌活性筛选[J]. 时珍国医国药,2011,22(3):552-554.
[20]王雅,李家寅,赵春萌,等. 沙枣黄酮提取工艺、抗氧化及抑菌活性研究[J].食品工业科技,2013,34(4):273-276.
[21]Brand-Williams W,Cuvelier ME,Berset C.Use of a free radical method to evaluate antioxidant activity[J].Lebensm Wiss Techno1,1995,28(1):25-30.

