皮肤光老化动物模型的建立和超微结构观察
邵琼琰王 平任金平张小燕黎军英戎念杭
皮肤光老化动物模型的建立和超微结构观察
邵琼琰1王 平2∗任金平1张小燕1黎军英3戎念杭3
目的: 构建光敏剂结合UVA诱导的小鼠皮肤光老化模型。方法: ICR小鼠分为3组:模型组外用1%甲氧沙林溶液(8-MOP)后进行UVA照射、单纯UVA照射组和空白对照组。照射后观察皮肤外观表现、病理学变化和超微结构特点,确定各组诱导皮肤光老化进程的累积照射剂量和时间。结果: 单纯UVA照射组在第45天,UVA剂量约720 J/cm2时,肉眼观察皮肤外观、组织病理方面和超微结构都呈现比较典型的光老化表现;模型组(8-MOP/UVA)小鼠在第3天,UVA累积剂量约47 J/ cm2时,透射电镜下可见角质形成细胞和基底层黑素细胞的显著凋亡(核固缩);第5天,UVA累积剂量约78 J/cm2时,病理示:真皮层部分弹性纤维变性;随着照射剂量的增加,第6天UVA累积剂量达95 J/cm2时,出现典型的光老化表现,透射电镜下可清晰观察到弹性纤维和胶原蛋白束的病理改变。结论: 8-MOP/UVA可以快速诱导小鼠皮肤光老化模型的建立。
皮肤光老化; 动物模型; 超微结构
皮肤光老化是紫外线(尤其是长波紫外线)长期照射引起的慢性光损伤。1皮肤光老化不仅导致皮肤屏障破坏引起皮肤抵抗力降低,还可致色素沉着、皱纹明显等皮肤损容,特别是很多皮肤恶性肿瘤,如鳞状细胞癌、基底细胞癌或黑素瘤均与慢性光损伤有关。2动物模型是研究皮肤光老化的一种重要的客观工具。但造模方法没有统一标准,很多方法周期较长、且判断标准不一。因此,快速、客观达到具有典型皮肤光老化临床组织学改变的造模方法,对研究光老化具有实际意义。3本研究应用1%甲氧沙林溶液外用后重复长波紫外线(8-MOP/UVA)照射,观察不同剂量下临床病理学表现及超微结构变化,确定建立光老化动物模型的最佳照射剂量与时间点,为皮肤光老化研究提供一种快速、客观的动物模型标准。
1 材料和方法
1.1 实验动物 ICR小鼠(清洁级,购自浙江中医药大学实验动物中心,7~8周龄,合格证:SCXK(沪) 2008-0016,雌鼠36只,体质重20±5 g。
1.2 主要仪器和试剂 紫外线光疗仪(Sigma公司),长波紫外线辐照度监视计(Sigma公司),荧光显微镜(OLYMPUSBX51,日本奥林巴斯公司),数码摄像系统(DP72,日本奥林巴斯公司),甲氧沙林溶液(1%的8-MOP溶液,重庆华邦制药有限公司),环境透射电子显微镜(H-9500,Hitachi)
1.3 分组及处理 将ICR小鼠随机分为3组:模型组(8-MOP/UVA)、单纯UVA照射组和空白对照组,各12只。每只小鼠用电动剃发刀将背部毛剃干净,面积2 cm×2 cm。空白对照组不做特殊处理。模型组:将1%甲氧沙林溶液涂抹于小鼠背部皮肤暴露部位,1~2 h后,将装有实验小鼠的透明盒子放在紫外线光疗仪灯具正下方2 cm处,给予26 mW/cm2的UVA照射,每次10 min左右,总计6天(经用UVA辐射度监视器测得能量为1.1 mW/cm2,累积强度95 J/ cm2)。单纯UVA组小鼠裸露的背部不做特殊处理,直接用紫外线光疗仪照射,其余步骤同模型组,第6天和第45天辐射累积强度分别达95 J/cm2和720 J/ cm2左右时结束造模。
1.4 组织病理 造模结束后各组取皮肤组织做常规石蜡切片,HE染色,光镜观察皮肤表皮和真皮的组织结构。
1.5 透射电镜扫描 选取样本戊二醛和锇酸双固定,常规制作透射电镜样本。
2 结果
2.1 正常对照组 临床观察小鼠皮肤色泽正常、光滑、富有弹性(图1a),HE染色(图1b)示小鼠表皮组织结构完整,表皮细胞排列整齐,有明显的表皮突和真皮乳头;真皮层可见波浪状纤维组织,分布均匀,疏密有致。透射电镜下(图1c)可见密集的弹性纤维,形状细长均匀、线形分布,排列方向一致,被包裹在密集的胶原蛋白网中;整个真皮层可见胶原蛋白束,它们排列密集,横截面直径均匀。
2.2 单纯UVA照射组 第6天UVA剂量约95 J/ cm2时,临床无明显变化(图2a),皮肤色泽、质地正常。HE染色和透射电镜示皮肤结构基本正常,偶见弹性纤维断裂(图2b黑色箭头),表皮和真皮交界处的结构完整(图2c黑色箭头),真皮层弹性纤维疏密有秩(图2c)。第45天UVA剂量约720 J/cm2时,临床病理和超微结构呈现出比较典型的光老化表现,粗细不等的皱纹(图2d),胶原纤维模型变性,并可见无定型物质,弹性纤维变性(图2e黑色箭头),表皮层和真皮层交界处的结构完全破坏(图2f黑色箭头),弹性纤维排列紊乱、断裂、破碎(图2f黄色箭头)。
2.3 模型组 第3天UVA剂量约47 J/cm2时,临床仅表现局部色素沉着(图3a)。组织病理HE染色可见弹性组织变性开始于真皮网状层和乳头层交界处4(图3b黑色箭头),出现破碎、断裂、扭曲等现象。透射电镜下可见表皮基底层黑素细胞轻度核异质(图3c黄色箭头)、黑素细胞核浓缩(图3c黑色箭头)现象;真皮层弹性纤维和胶原蛋白束未见明显改变。
第5天UVA剂量约78 J/cm2时,小鼠背部照射区域的皮肤出现进行性弹性丧失、干燥、细小皱纹(图3d黑色箭头)。组织病理HE染色示表皮和真皮层明显增厚,表皮结构基本完整,真皮乳头突出不明显,弹性纤维变性、破坏,不规则增厚、杂乱无章(图3c)。透射电镜下可见表皮基底层黑素细胞中度核异质(图3f黄色箭头),部分弹性纤维扭曲、排列紊乱,散乱分布在胶原蛋白网中,部分胶原蛋白束分离、散乱、大小不一(图3f黑色箭头);表皮层和真皮层交界处的结构基本完整。
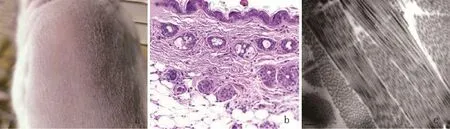
图1 空白对照组
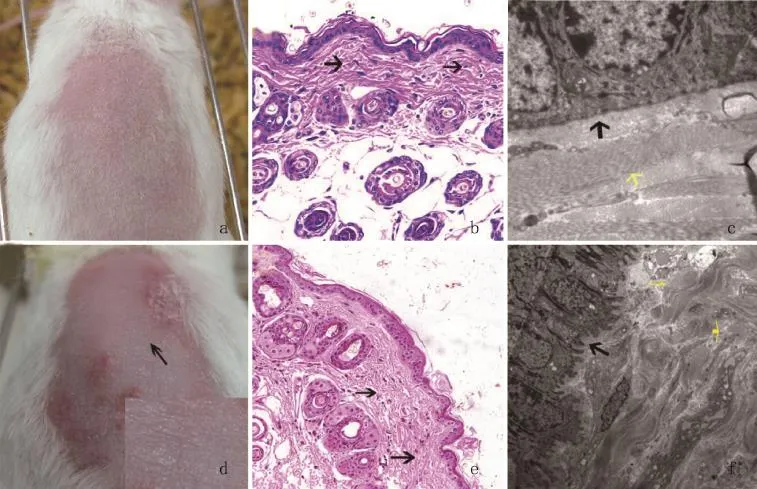
图2 单纯UVA照射组
随着剂量进一步增加,第6天达到95 J/cm2时小鼠背部照射区域的皮肤出现粗大的横向皱纹(图3g)。组织病理HE染色(图3h)示表皮萎缩,波浪形状异常,甚至平行;真皮层的弹性纤维发生大范围破坏和变性,部分出现均质化,排列紊乱,分布不均匀或稀疏,并伴有炎性细胞浸润。透射电镜可见明显的弹性纤维散乱,它们从胶原蛋白束中分离出来,分布不规则,周边被一些无定型的物质包裹,可能是一些黏多糖物质;大量破碎的胶原纤维,散乱肿胀,轮廓不清呈团块状,部分呈均质化改变,分布在弹性基质中(图3i黑色箭头);表皮和真皮层交界处的结构异常,黑素细胞出现显著的核异质(图3i黄色箭头)。
3 讨论
皮肤光老化的临床迹象为光暴露部位斑驳的色素沉着,皮肤松弛、出现粗细不等的皱纹,呈皮革样,色泽灰黄等外观,5产生的原因是环境对皮肤日积月累的破坏作用,其中紫外线辐射是主要因素。紫外线根据波长和能量的不同分为长波紫外线(UVA,320~400 nm)、中波紫外线(UVB,290~320 nm)和短波紫外线(200~290 nm),照射到地球表面主要是UVA和UVB,两者对生物体影响是不同的。6UVB大多在表皮吸收,主要影响表皮细胞,即角质形成细胞;与UVB相比较,UVA可以更深入地渗透皮肤,同时影响到表皮角质形成细胞和真皮成纤维细胞,引起机体的免疫抑制、光老化、眼部损害和皮肤癌等。7-9
国内外皮肤光老化试验研究动物模型的造模方法以及检验模型的成功与否仍没有统一的标准。目前文献上报道一般是用大鼠、小鼠或者豚鼠作为动物模型,我们选ICR小鼠建模的原因为,其价格低廉,适用性广,而且通过适当的方法造模后,可以出现典型的光老化特征。建模方法较常用的是UVA联合UVB造模,这种方法可能更加客观,但造模时间较长,一般需要8~12周,10,11或者单纯使用高剂量UVA,至少6周。12与单纯使用高剂量UVA相比,8-MOP/UVA除了时间的优势以外,在临床表现方面,皮肤照射损害相对较小,皱纹却更加明显。有文献报道8-MOP/ UVA作用可引起体外培养成纤维细胞迅速出现细胞衰老的改变,13通过8-MOP/UVA可以快速诱导小鼠皮肤光老化模型的建立。在初步研究中使用数量有限的小鼠,通过光老化组织学方面的验证,以实现合理的具有成本效益的实验评估。

图3 模型组
组织病理学是评估皮肤光老化比较经典的实验方法,但在早期不典型的临床表现中,电镜下超微结构能够更加客观反映紫外线照射皮肤产生的渐进性光老化组织病理变化。14我们观察到在早期阶段表皮增厚,可能是一种皮肤对外界抵抗性的自我保护反应,而晚期表皮则出现萎缩;真皮层弹性纤维一般是从网状层和乳头层交界处开始变性,随着照射剂量的增加,弹性纤维从小范围到大面积变性。电镜下观察到黑素体在角质细胞中分布不规则,黑色素增加,出现黑素细胞核异质现象;15,16真皮与表皮结合处的结构破坏,出现像手指样突起的异常结构。17以上这些观察结果与其他作者的报道类似,且都强调并认为真皮弹性组织变性是动物经过紫外线反复照射建立皮肤光老化模型最为显著的组织学特征。14,18
目前临床皮肤光老化的发病机制尚不明确,我们通过8-MOP/UVA更加经济、快速的建立动物光老化模型对研究光老化机制和治疗光老化有着重要的意义。
1 Battie C,Verschoore M.Cutaneous solar ultraviolet exposure and clinical aspects of photodamage.Indian JDermatol Venereol Leprol,2012,78(Suppl 1):S9-S14.
2 BurnettME,Hu JY,Wang SQ.Sunscreens:obtaining adequate photoprotection.Dermatol Ther,2012,25(3):244-251.
3 Liang H,Li J,Zhang L.Establishment ofmus skin photo-damagemodel by 8-MOP plus UVA irradiation.JHuazhong Univ Sci Technolog Med Sci,2007,27(6):742-744.
4 Berneburg M,Plettenberg H,Krutmann J.Photoaging of human skin.Photodermatol Photoimmunol Photomed,2000,16(6):239-244.
5刘玮.皮肤光老化.临床皮肤科杂志,2003,7:424-426.
6 Tuchinda C,Srivannaboon S,Lim HW.Photoprotection by window glass,automobile glass,and sunglasses.JAm Acad Dermatol,2006,54(5):845-854.
7Markova A,Weinstock MA.Risk of skin cancer associated with the use of UV nail lamp.J Invest Dermatol,2013,133(4):1097-1099.
8 Bens G.Sunscreens.Adv Exp Med Biol,2008,624:137-161.
9 Yam JC,Kwok AK.Ultraviolet light and ocular diseases.Int Ophthalmol,2014,34(2):383-400.
10郭鲁义,李春雨,张宁,等.实用光老化动物模型建立方法的探讨.中国美容医学,2008,2:235-237.
11杨汝斌,万屏,刘玲,等.SD大鼠皮肤光老化动物模型建立方法的探索.中国皮肤性病学杂志,2011,3:199-202.
12杨斌,刁庆春,钟白玉,等.番茄红素对长波紫外线照射大鼠皮肤中丙二醛形成和基质金属蛋白酶表达的抑制作用.中华医学美学美容杂志,2006,6:358-361.
13 Borlon C,Debacq-Chainiaux F,Hinrichs C,et al.The gene expression profile of psoralen plus UVA-induced premature senescence in skin fibroblasts resembles a combined DNA-damage and stress-induced cellular senescence response phenotype.Exp Gerontol,2007,42(9):911-923.
14Haftek M,Mac-Mary S,Le Bitoux MA,et al.Clinical,biometric and structural evaluation of the long-term effects of a topical treatmentwith ascorbic acid and madecassoside in photoaged human skin.Exp Dermatol,2008,17(11):946-952.
15 Feng Y,Zhao J,Gold MH.Skin rejuvenation in asian skin: the analysis of clinical effects and basic mechanisms of intense pulsed light.JDrugs Dermatol,2008,7(3):273-279.
16Hughes MC,Bredoux C,Salas F,et al.Comparison of histological measures of skin photoaging.Dermatology,2011,223 (2):140-151.
17 Amano S.Possible involvement of basementmembrane damage in skin photoaging.J Investig Dermatol Symp Proc,2009,14 (1):2-7.
18 Peres PS,Terra VA,Guarnier FA,et al.Photoaging and chronological aging profile:Understanding oxidation of the skin.JPhotochem Photobiol B,2011,103(2):93-97.
(收稿:2013-09-27 修回:2013-11-12)
An animalmodel for photoaging induced by photosensitizer p lus ultraviolet A irradiation:pathologic and ultrastructure study
SHAO Qiong-yan,WANG Ping,REN Jin-ping,et al.Zhejiang University of Traditional Chinese Medicine,the Second Clinical Medical College,310053
Objective:To construct amice photoagingmodel induced by photosensitizer combined with ultraviolet A(UVA).Methods:The ICRmice were divided into three groups:In group one themice were treated with topical 1%methoxypsoralen(8-MOP)solution plus repeated UVA exposure,(8-MOP/UVA);In group two,only repeated UVA irradiation was used and group threewas blank control group.After irradiation,by observing the clinical,pathological and ultrastructural features in different stage,photoaging processwere correlated with cumulative radiation dose and time.Results:In group two when the UVA dosewas about720 J/cm2at the day 45,the clinicalmanifestations,pathology and ultrastructure showed typicalmanifestation of photoaging.In group one(8-MOP/UVA group)at the time of the day 3,with UVA dose about47 J/cm2,although no clinical changeswere found,mild broken and twisted elastic fibers at the superficial dermisand also numerous apoptotic keratinocytes and melanocytes were seen under both lightmicroscope and transmission electron microscope(TEM).Clinical changes occurred at day 5 with accumulated UVA dose about 78 J/cm2,presented with dull skin,fine lines,mottled pigmentation,accompanied by obvious degeneration of elastic fibers in the dermis.On day 6 with UVA dose about95 J/cm2,typical clinical feature of photoaging with coarse transverse wrinkles,and pathologically large proportion ofelastic fibers degenerated were presented,especially under TEM.Conclusion:An animalmodel for photoaging can be quickly induced by 8-MOP/UVA.
skin photoaging;animalmodel;ultrastructure
浙江省自然科学基金项目(编号:Y208112)
杭州市医学重点专科专病项目(编号:20100733Q08)
1浙江中医药大学第二临床学院,杭州,310053
2杭州市第三人民医院皮肤科,浙江,310009
3浙江大学电镜中心生物分中心,310012
∗通信作者

