人乙醛脱氢酶2的原核表达及条件的优化
黄 娟,张小骥,刘传青,向玲娟,陈孝平,吴元欣
(武汉工程大学绿色化工过程教育部重点实验室,湖北武汉430073)
当人过量饮酒时,酒精的代谢产物乙醛不能及时被氧化,就会在体内积累,容易诱发肝癌[1],同时会损伤机体细胞,加速人体衰老。因此,乙醛的清除对于细胞的保护意义重大,人体主要依靠乙醛脱氢酶(包括ALDH1和ALDH2)来完成。酒精在体内的代谢过程为乙醇→乙醛→乙酸[2],乙醛脱氢酶参与酒精的代谢过程时,通过将酒精的代谢产物乙醛转化为二氧化碳和水[3],从而减少体内乙醛的含量。由于ALDH2对乙醛的活性是ALDH1活性的50倍[4],因此肝脏细胞中的ALDH2对于乙醛的清除极为重要[5]。
目前,商品化的乙醛脱氢酶主要是从动物肝脏的肝细胞线粒体中提取,资源很有限且价格昂贵,大规模生产困难[6]。为此,科研工作者试图通过微生物发酵来大量获取乙醛脱氢酶。研究发现,毕氏酵母分泌表达ALDH2时,由于表达过程中酵母的生长周期较长,ALDH2虽然得到表达,但分泌的蛋白失活现象严重[7],活性很低甚至无生物活性。赵锦等[8]也尝试在酵母中表达乙醛脱氢酶,分离纯化后的人乙醛脱氢酶液的酶活为0.994U·mL-1。裘丽珍[9]利用原核表达系统得到大量的乙醛脱氢酶,但都是没有活性的包涵体,通过变性复性得到的蛋白活性也很低。作者所在实验室在前期工作中利用原核表达系统得到大量的乙醛脱氢酶,大部分也是以包涵体的形式存在,不利于后序的工艺流程。在此,尝试利用带融合蛋白标签GST的载体pGEX-4T-1来提高目的蛋白ALDH2的可溶性表达。
1 实验
1.1 材料、试剂与培养基
宿主菌E.coli DH5α、E.coli BL21(DE3),质粒PUC57-ALDH2、质粒pGEX-4T-1,自行保存;限制性内切酶SalⅠ、EcoRⅠ、PstⅠ、XhoⅠ、T4DNA连接酶、DNA分子量标准、蛋白质分子量标准,TaKaRa公司;SDS、TEMED,Sigma公司;丙烯酰胺、N,N-亚甲基双丙烯酰胺,天更生物公司。
细菌裂解液:0.2mol·L-1NaCl,1mmol·L-1EDTA,25mmol·L-1Tris-HCl,pH值8.0。
LB液体培养基:蛋白胨10g·L-1,酵母浸粉5g ·L-1,氯化钠10g·L-1。
1.2 原核表达重组质粒的构建
将质粒PUC57-ALDH2和表达载体pGEX-4T-1分别用限制性内切酶SalⅠ和EcoRⅠ进行双酶切,用低熔点胶回收酶切产物后,再用T4DNA连接酶16℃过夜连接,将连接产物转化至E.coli DH5α,转化的菌种涂布于含氨苄青霉素的平板,培养12h后挑取单菌落,用煮沸法挑选重组质粒,再进行酶切鉴定及DNA测序验证。
1.3 重组蛋白的诱导表达及表达条件的优化
将纯化的重组质粒pGEX-4T-1-ALDH2转化至E.coli BL21(DE3)感受态细胞,涂布于含氨苄青霉素的平板,挑取阳性单菌落接种于3~5mL LB液体培养基中,37℃过夜培养12h,然后以1∶100比例接种到新鲜的LB液体培养基中,于37℃、200r·min-1培养至OD600=0.6时,分别加入终浓度为0mmol· L-1、0.1mmol·L-1、0.5mmol·L-1、1.0mmol· L-1的IPTG诱导3h,收集菌体离心,用10%SDSPAGE电泳检测。
为得到较多的可溶性目的蛋白,采取了降低温度和降低IPTG浓度的方法:28℃下,分别用0mmol· L-1、0.05mmol·L-1、0.1mmol·L-1、0.5mmol· L-1的IPTG诱导10h后收集菌体。将收集的菌体重悬于预冷细菌裂解液中,超声破碎25min(超声破碎仪功率300W,开2s,停4s),再于4℃、1 200r· min-1离心30min,分别取上清和沉淀进行10%SDSPAGE电泳,分析表达产物的可溶性。
2 结果与讨论
2.1 原核表达重组质粒的构建
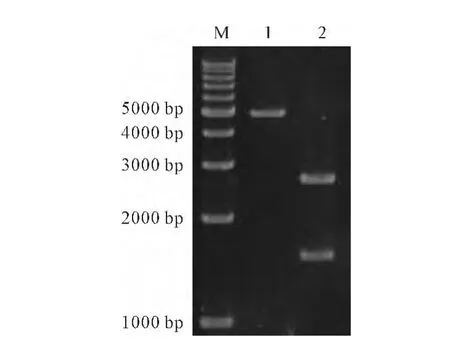
图1 PUC57-ALDH2和pGEX-4T-1酶切鉴定Fig.1 Enzyme identification of PUC57-ALDH2and pGEX-4T-1
将质粒PUC57-ALDH2用限制性内切酶SalⅠ和EcoRⅠ进行双酶切,凝胶电泳检测结果显示有1 500 bp的目的条带(图1)。将含有目的基因的DNA片段定向插入经SalⅠ和EcoRⅠ双酶切的含有融合蛋白标签GST的pGEX-4T-1表达载体(图1)中,构建重组质粒pGEX-4T-1-ALDH2(图2)。在含有氨苄青霉素的平板上挑取单菌落过夜摇菌,用煮沸法提取质粒进行凝胶电泳,初步鉴定为阳性的克隆过夜摇菌提取质粒,分别用SalⅠ和EcoRⅠ、EcoRⅠ和EcoRⅤ进行双酶切,切出与预期大小一样的条带(图3)。将验证的质粒进行DNA测序分析,与NCBI上公布的ALDH2序列一致,表明重组质粒pGEX-4T-1-ALDH2构建成功。
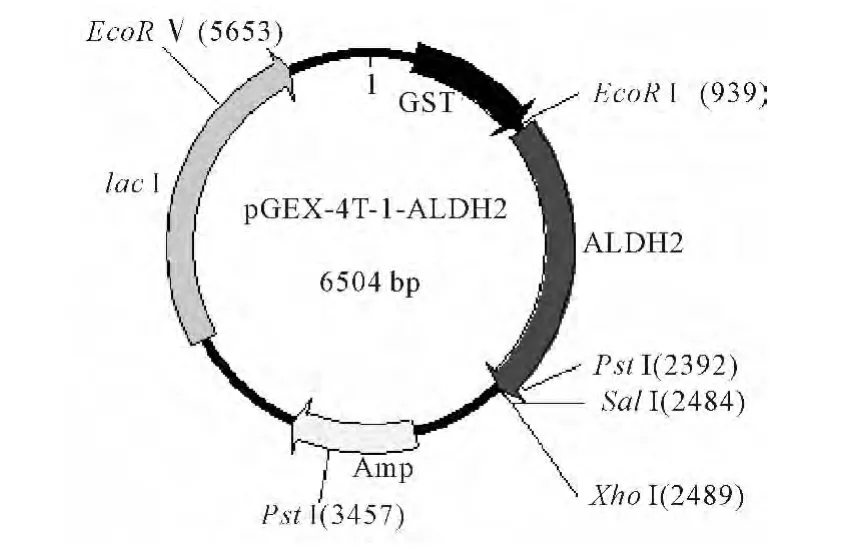
图2 pGEX-4T-1-ALDH2重组质粒Fig.2 The recombinant plasmid pGEX-4T-1-ALDH2

图3 重组质粒pGEX-4T-1-ALDH2酶切鉴定Fig.3 Enzyme identification of pGEX-4T-1-ALDH2
2.2 重组蛋白的诱导表达及条件优化结果
按1.3方法进行重组蛋白的诱导表达,10%SDSPAGE电泳分析结果见图4。
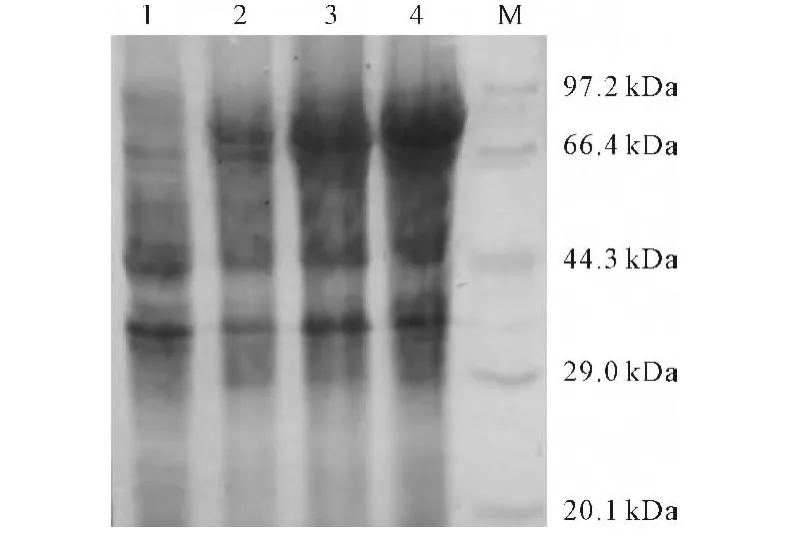
图4 融合蛋白诱导表达的SDS-PAGE分析Fig.4 SDS-PAGE Analysis of fusion protein expressed
由图4可知,没有诱导的菌体蛋白未出现目的条带,而经IPTG诱导的菌体蛋白在81kDa均出现目的条带。这是因为,载体上融合蛋白标签GST的分子量约为26kDa,目的蛋白ALDH2的分子量约为55 kDa,因此表达的蛋白分子量约为81kDa。此外,随着IPTG浓度的增大,目的蛋白的表达量也相应增加。
按1.3方法进行目的蛋白可溶性表达条件的优化,结果见图5。

图5 目的蛋白可溶性表达条件的优化Fig.5 Optimization of soluble expression of the purpose protein
由图5可知,28℃下,以终浓度0.1mmol·L-1的IPTG诱导表达10h,得到可溶性的目的蛋白约占总蛋白的25%,是目的蛋白可溶性表达的最优条件。
2.3 讨论
大肠杆菌表达系统是生物技术和生物制药领域的常用工具,具有培养周期短、成本低、目的蛋白表达量高的优点。在大肠杆菌表达系统中,大部分表达载体采用诱导型启动子控制目的基因的表达。诱导型启动子能控制基因在特定时期、特定部位表达,既避免了目的基因在宿主细胞内高表达对宿主细胞生长的影响,又可减少菌体蛋白酶对目标产物的降解。
pGEX-4T-1是一种广泛采用的原核高效表达载体,其上带有融合蛋白标签GST,专为可诱导的、高效表达外源基因并使其成为融合蛋白而设计。融合蛋白谷胱甘肽转移酶和外源基因一同表达,不仅能增加融合表达蛋白的可溶性,而且在保护融合蛋白免受蛋白酶降解时也起着重要作用。诱导表达出的重组蛋白可以很容易地用谷胱甘肽亲和层析介质分离纯化。但标签蛋白会在一定程度上影响目的蛋白的生物活性,所以需要将其切下,可用有特异氨基酸识别位点的蛋白酶Thrombin进行切除。
融合蛋白的加入虽然能在一定程度上增加目的蛋白的可溶性,但实验结果显示可溶性蛋白仅占总蛋白的25%左右。研究发现,在低表达时很少形成包涵体,表达量越高越容易形成包涵体。低温和低浓度IPTG的条件可以降低大肠杆菌的代谢量,从而使目的蛋白得以缓慢表达,形成具有一定空间结构和一定生物活性的蛋白。因此,为了得到可溶性的乙醛脱氢酶,本研究在低温(28℃)下,利用不同浓度的IPTG进行诱导,以优化目的蛋白可溶性表达的条件。
3 结论
目的基因与载体通过双酶切后连接,再转化至E.coli DH5α,成功构建了原核表达重组质粒pGEX-4T-1-ALDH2。再将重组质粒转化至E.coli BL21(DE3)后经IPTG诱导,用SDS-PAGE电泳检测分析,结果显示重组蛋白得到大量表达。对可溶性表达条件进行探讨,发现在28℃下,以0.1mmol·L-1IPTG诱导表达10h可得到部分可溶性的重组蛋白。由于大肠杆菌大量表达融合蛋白,目的蛋白大部分还是以包涵体的形式存在,仍需进一步优化可溶性表达的条件。
[1] MIZOI Y,YAMAMOTO K,UENO Y,et al.Involvement of genetic polymorphism of alcohol and aldehyde dehydrogenases in individual variation of alcohol metabolism[J].Alcohol,1994,29(6):707-710.
[2] YOKOYAMA A,MURAMATSU T,OHMORI T,et al.Esophageal cancer and aldehyde dehydrogenase-2genotypes in Japanese males[J].Cancer Epidemiology,Biomarkers &Prevention,1996,5(2):99-102.
[3] ISHIKAWA H,YAMAMOTO H,TIAN Y,et al.Effects of ALDH2gene polymorphisms and alcohol-drinking behavior on micronuclei frequency in non-smokers[J].Mutation Research,2003,541(1-2):71-80.
[4] VASILIOU V,PAPPA A,PETERSEN D.Role of aldehyde dehydrogenases in endogenous and xenobiotic metabolism[J].Chem Biol Interact,2000,129(1-2):1-19.
[5] BUDAS G R,DISATNIK M H,MOCHLY-ROSEN D,et al.Aldehyde dehydrogenase 2in cardiac protection:A new therapeutic target?[J].Trends Cardiovasc Med,2009,19(5):159-164.
[6] 吴桂英,赵玉凤,吴元欣,等.酿酒酵母细胞破碎释放乙醛脱氢酶的研究[J].食品工业科技,2007,28(3):61-63.
[7] 黄锟,赵玉凤,赵锦,等.人乙醛脱氢酶2基因在毕赤酵母SMD 1168中的表达研究[J].中国医药生物技术,2010,25(1):44-48.
[8] 赵锦,赵玉凤,黄锟,等.人乙醛脱氢酶2基因在毕赤酵母中的高效表达[J].化学与生物工程,2010,27(2):50-52.
[9] 裘丽珍.人乙醛脱氢酶2基因的克隆及表达[D].杭州:浙江大学,2005.

