16706 例可疑医疗器械不良事件报告分析
卞蓉蓉 郑建立 徐厚明 孙骏
1 上海理工大学医疗器械与食品学院 (上海 200093)
2 江苏省药品不良反应监测中心 (南京 210002)
0.引言
医疗器械作为近代科学技术的产物已广泛应用于疾病的预防、诊断、治疗、康复和保健中,成为公众生活中不可或缺的一部分。随着科技水平的大幅提高,临床使用的医疗器械也日新月异,医疗器械的数量大幅增加,使用频率也日渐增高。近年来,随着医疗器械不良事件(Medical Device Administration Events,MDAE)开展及深入,其重要性和必要性逐步为人们所认识与关注,医疗器械不良事件的报告数量大幅增加。开展医疗器械不良事件监测和风险管理工作,是最大限度控制医疗器械潜在风险,保证医疗器械使用安全、有效的重要手段[1]。2012 年,江苏省药品不良反应监测中心共收到可疑医疗器械不良事件报告16706 例,通过对本组医疗器械不良事件的临床表现形式以及涉及品种等内容进行分析,为安全有效使用医疗器械提供参考,并进一步对医疗器械不良事件监测模式进行探索。
1.资料与方法
1.1 资料来源
2012 年1 月1 日~2012 年12 月31 日全年江苏省ADR 监测中心收集到的16706 例可疑医疗器械不良事件报告。
1.2 方法
采用描述性研究分析方法,同时依托江苏省ADR 病例数据库,采用国家食品药品监督管理局制定的《医疗器械分类目录》,对可疑医疗器械不良事件涉及的器械进行分类,对报告数量、报告来源、使用场所、不良事件主要表现等进行统计和分析。
2.结果
2.1 报告基本情况
2.1.1 报告来源
16706 份MDAE 报告表以使用“全国药品不良反应监测网络”在线呈报单位数为基数,按照使用单位、经营企业、生产企业分类统计,结果见表1。
2.1.2 报告质量
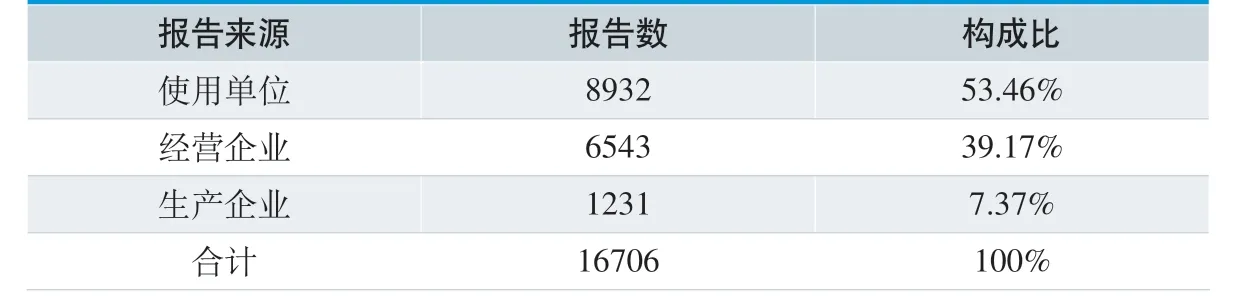
表1. 不同类别单位报告情况
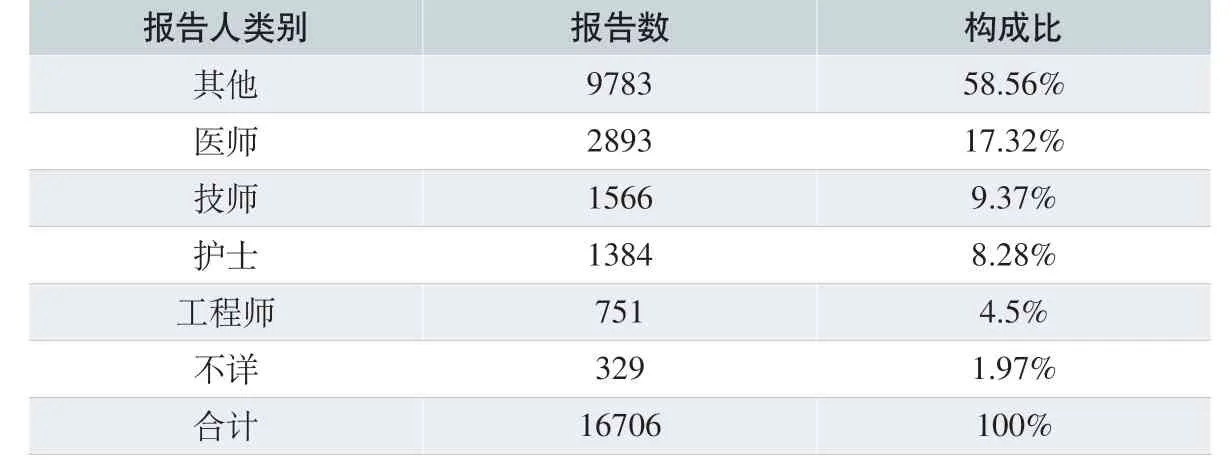
表2. 报告人的职业情况统计
通过对16706 例MDR 报告表信息缺失情况统计,结果显示:4145 份未填写医疗器械使用场所,6494 份未填写操作人员,743 份未填写产品管理类别。
2.1.3 报告人职业构成
对MDR 报告表中报告人的职业情况进行统计,医师和技师为参与报告的主要职业,分别占17.32%和9.37%,结果见表2。
2.2 涉及医疗器械具体情况
2.2.1 使用场所及操作人员情况
从医疗器械使用场所分析,医疗机构6777 例、家庭3817 例、其他场所1965 例。从器械操作人员情况分析,专业人员操作6678 例,占39.98%。具体见表3、表4。
2.2.2 医疗器械管理类别
从医疗器械管理类别分析,涉及III 类医疗器械的报告最多,共7420 份,占总报告数的44.41%;涉及II 类医疗器械报告共4826 份,占总报告数的28.89%。具体见表5。
2.2.3 医疗器械产品分类
从医疗器械产品分类分析,16706 份可疑医疗器械不良事件报告共涉及41 类产品,其中涉及植入材料和人工器官的报告最多,共3454 份,占总报告数的20.60%;医用卫生材料及敷料居其次,共2701 份,占总报告数的16.10%。按产品分类排名前十的具体见表6。
2.2.4 医疗器械名称
16706 份可疑医疗器械不良事件报告中,宫内节育器上报3996 例,占31.31%。其他列前十位的见表7。
2.3 可疑不良事件涉及患者的一般情况
在16706 份报表中,男性5289 人,女性8629 人,从比例上来看,女性略高。患者年龄最小1 月,最大超过100 岁。主要集中在31~40岁这一年龄段,共3431 例,占20.54%;其次为21~30 岁,占18.45%。(见表8、表9)
2.4 可疑不良事件的临床表现
2.4.1 医疗器械故障
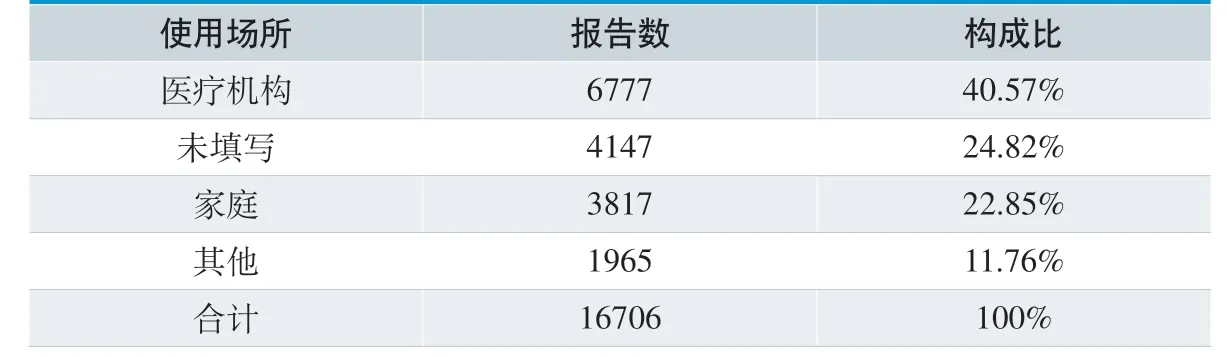
表3. 医疗器械使用场所情况
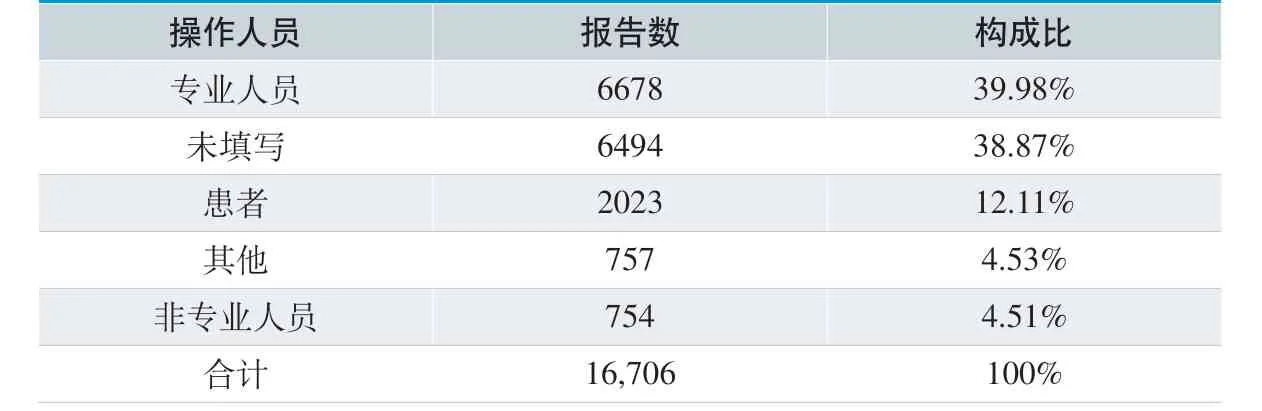
表4. 操作人员情况
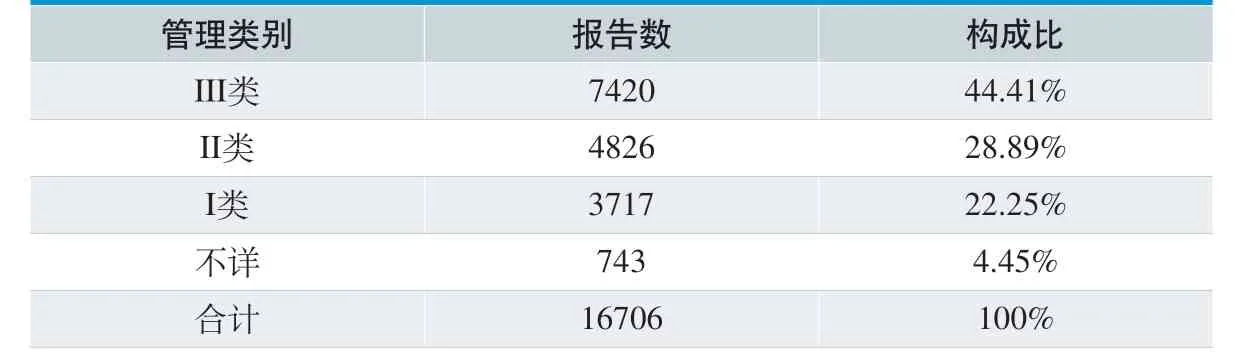
表5. 医疗器械管理类别情况
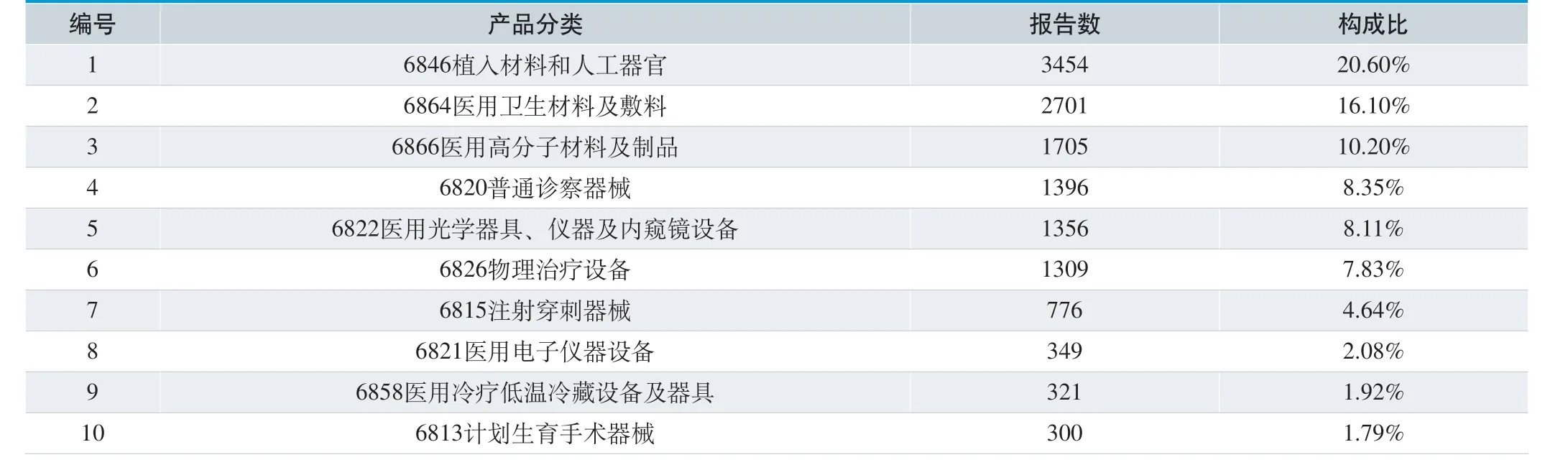
表6. 可疑医疗器械不良事件涉及产品分类情况
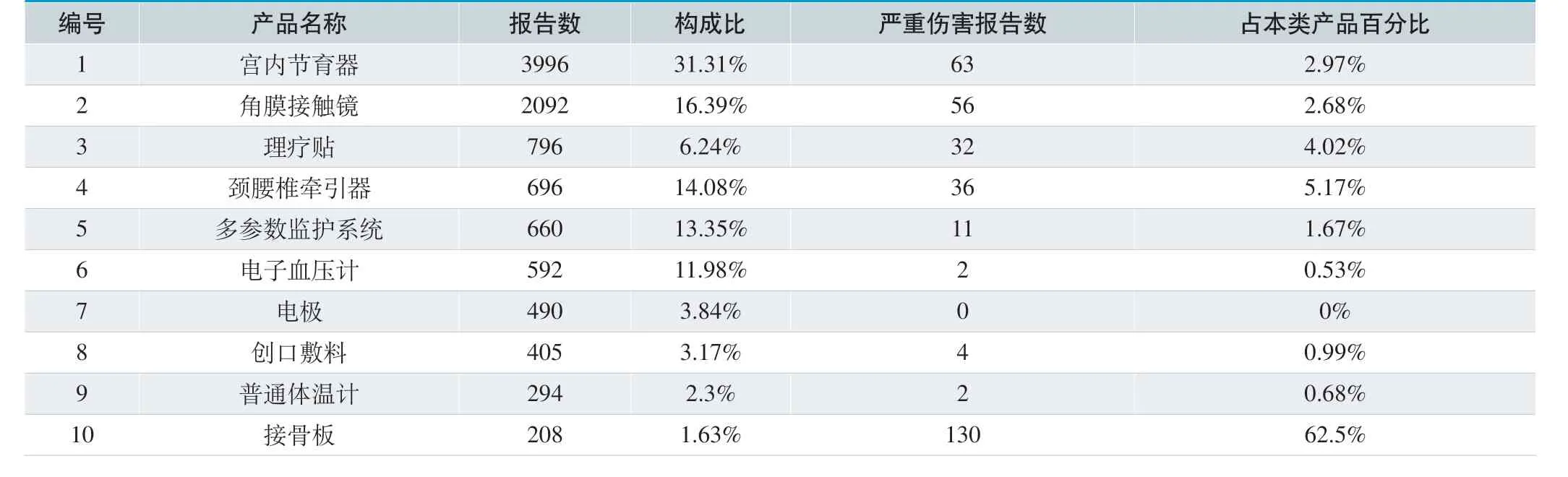
表7. 报告数量前十位医疗器械
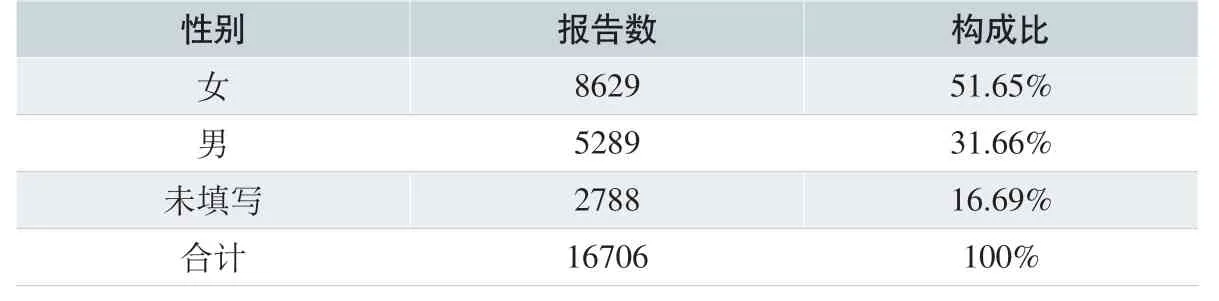
表8. 性别报告数分布
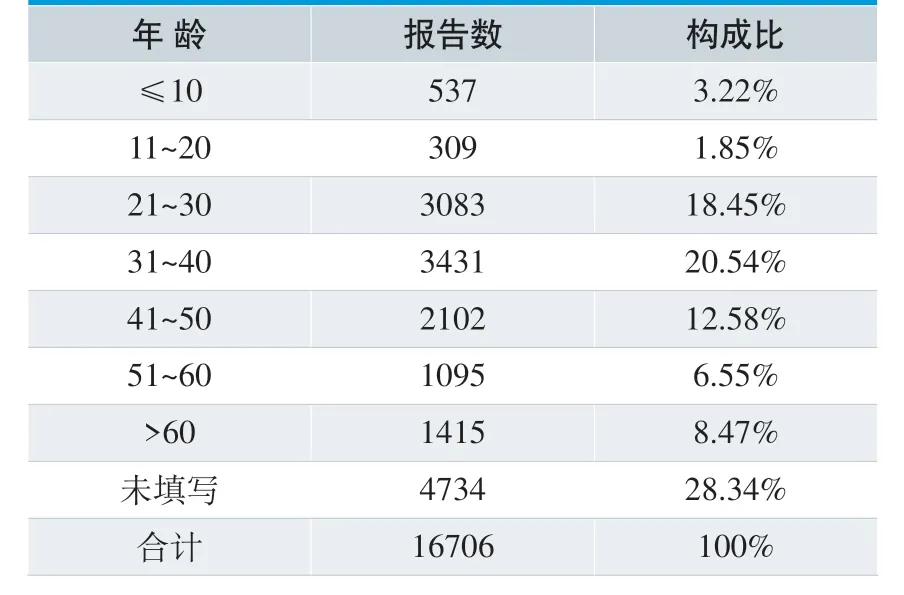
表9. 各年龄段患者分布情况
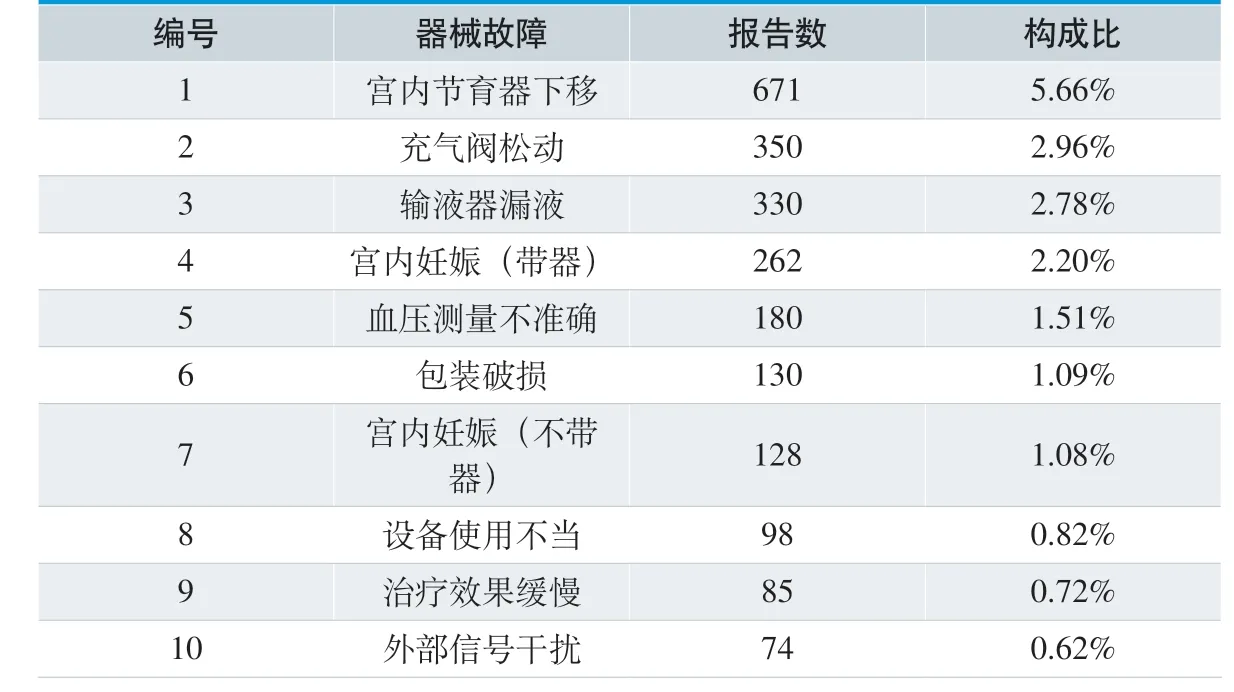
表10. 器械故障前十位
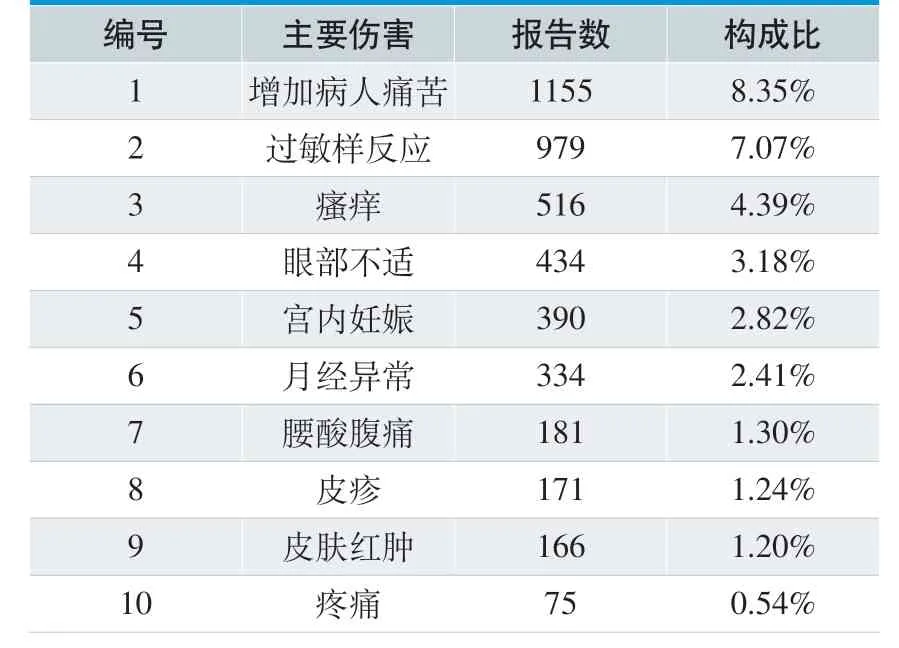
表11. 主要伤害前十位
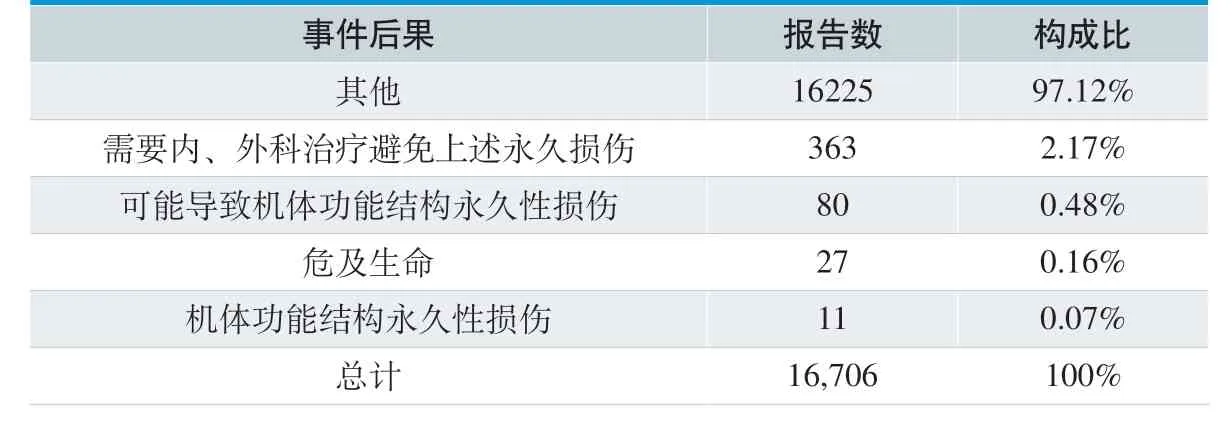
表12. 不良事件后果情况分布
16706 份可疑医疗器械不良事件报告,按医疗器械故障统计主要为宫内节育器下移、充气阀松动、输液器漏液等,具体排名见表10。
2.4.2 主要伤害
16706 份可疑医疗器械不良事件报告中,主要伤害表现为增加病人痛苦、过敏样反应、瘙痒等,排名前十的主要伤害具体见表11。
2.5 可疑医疗器械不良事件的后果
16706 份可疑医疗器械不良事件报告中,绝大多数为一般的报告。事件后果为需要内、外科治疗避免上述永久损伤的报告363 份,占总报告数的2.17%;无死亡报告。具体见表12。
3.讨论
3.1 医疗器械不良事件一般情况及报表质量分析
从报告来源分析,使用单位上报8939 份,占53.46%;生产企业上报1231 份,占7.37%,这说明报告主体中医疗机构作为使用单位上报数量较多,上报意识比较强,而生产企业上报数量较少,主动上报意识不强,对医疗器械不良事件监测工作的重要性和必要性认识不足。
从报告人职业及使用场所、操作人员分析,医生和技师为主要参与报告的主要职业,40.57%报告使用场所为医疗机构,39.98%报告由专业人员操作,这与医疗机构上报数量较多,器械主要使用场所多在医疗机构有关。
从管理类别分析,涉及III 类医疗器械的报告最多,占总报告数的44.41%,这与器械分类管理相一致,III 类医疗器械是指对人体具有潜在危险,对其安全性、有效性必须严格控制的医疗器械。
在16706 份报表中, 4145 份未填写医疗器械使用场所,6494 份未填写操作人员,743 份未填写产品管理类别。严重伤害报告481 份,仅占总报告数2.88%。报告数量较多的医疗器械产品为宫内节育器、角膜接触镜等。由此可见,MDR 报告内容填写不规范,漏填、误填、错填报告表较多,高风险产品报告表不多,MDR 报告表的质量有待进一步提高。
3.2 医疗器械不良事件临床分析
本组数据显示,16706 例报表中所涉及病种和临床表现较为复杂,其中宫内节育器、骨科植入材料、医用可吸收缝合线等属于植入材料和人工器官(产品分类号6846)不良事件发生比例较高,应纳入重点监测范畴。此类植入器材在使用时存在潜在危害,相对风险较高,一旦引起医疗器械不良事件,将对用械患者造成精神和肉体的双重危害[2],因此要求临床医生在使用时应规范操作,严格掌握植入手术指征,术后密切观察并加强健康宣教、定期随访。患者也应根据医嘱正确使用植入类医疗器械,发现异常及时就诊。医疗机构在采购此类植入材料时,要确认生产厂家的资质以及产品的合法性,并在运输及储存过程中按有关要求妥善处置。
3.3 江苏省医疗器械不良事件监测的现状及存在问题
2012 年,随着国家医疗器械不良事件监测系统投入使用,三级监测网络的健全,江苏省医疗器械不良事件监测工作迅速发展。2012 年全省共收到MDR 报告16706 份,每百万人口报告数达223.72 份,报告数量比2011 年增长26 倍。但在实际工作中,仍存在如下问题:
3.3.1 各省辖市监测工作发展不平衡
2012 年,MDR 报告数量超过1000 份的省辖市有7 个,占全省报告数量的84.05%,报告最多的为3217 份,最少的为218 份。从百万人口数量分布来看,我省平均为223.72 份。最高的为693.13 份,最低的为31.77 份。从报告参与单位分析,2012 年全省共有2445 家单位参与医疗器械不良事件报告,参与单位最多的为503 家,最少的为20 家。从MDR 报表的审核情况分析,2012 年各市审核的MDR 报表数量为13195 份,占报表总数的78.98%,审核最高比率为99.36%,最低为0。由此可见,各市医疗器械不良事件监测工作发展不平衡。各级监测机构人员配备严重不足。江苏省十三个地市级均成立药品不良反应监测中心,而医疗器械不良事件监测工作目前多在各市局医疗器械处,由医疗器械处工作人员兼职,没有专门的人员编制和设备配置。
3.3.2 生产企业参与度不高
16706 份报告表中生产企业上报1231 份,占报告表总数的7.37%。我省有2000 余家医疗器械生产企业,其中有366 家生产企业参与医疗器械不良事件报告,仅有15 家生产企业上报年度汇总报告。而按照《医疗器械不良事件监测和再评价管理办法(试行)》规定,第二类、第三类医疗器械生产企业应当在每年1 月底前对上一年度医疗器械不良事件监测情况进行汇总分析。当前作为医疗器械不良事件报告主体的生产企业受产品数量多、规模小、管理水平低、产品技术含量低、销售不畅等因素影响,往往重点关注产品的生产、销售而忽视产品上市后的安全性管理、忽略作为医疗器械不良事件监测“第一责任人”的职责。
3.4 建议与对策
3.4.1 完善相关的管理规范和技术指南
《医疗器械不良事件监测和再评价管理办法(试行)》极大地推动了我国医疗器械不良事件监测工作规范化进程,但对于复杂的医疗器械监测工作仍然不够,医疗器械不良事件监测工作的推进还需要进一步加强制度建设,完善从收集上报、分析评价到应急预警等方面的管理规范或技术指南,保证医疗器械不良事件监测工作的科学、合理、规范的推进。
3.4.2 加大监测人员的专业培训
医疗器械本身涉及多个学科,不良事件监测及其分析评价也是一个相当复杂的工作,监测机构工作人员不可避免地会面临自身专业知识局限性的困扰。要构建一支高素质医疗器械不良事件监测的专业队伍,还需要针对不同的需求开展持续的培训和专业的指导[3]。
3.4.3 给予监测机构足够的政策或财政支持
医疗器械不良事件监测工作是政府服务于公众用械安全的职能之一。目前各地办公经费依靠各单位自行提供,在开展面向公众宣传、严重事件调查、人员培训、分析评价等工作时,往往受单位经费的限制而形成严重瓶颈,而上报单位因缺乏行政推动或财力支持,积极性不高。需要国家从政策或财政上给予器械监测工作足够的支持和保障。
3.4.4 强化不良事件分析、评价和预警能力
开展医疗器械不良事件监测工作可以有效地预防和减少医疗器械不良事件发生。要加强对监测报告的分析评价,建立监测数据库,通过定期对收集到的数据进行统计分析,从中提取出有效的预警信号,为医疗器械上市后的安全性再评价提供数据支持,为医疗器械的安全使用提供依据[4]。只有建立一套健全的医疗器械不良事件监测网络及报告制度,才能有效地保障医疗器械使用的安全性,切实降低医疗器械不良事件发生的频率及危害后果,维护公众利益,切实保障广大人民群众用械安全。
[1] 王玲,王刚.医疗器械不良事件监测系统的建设与应用[J].中国医疗器械信息,2010,16(9):32-37.
[2] 赵胜利,钟露苗.湖南省2006 年可疑医疗器械不良事件报告分析[J].中国药物警戒,2007,4 (2):104-106.
[3] 刘爱萍,张黎明,闫炜,等. 医务工作者报告医疗器械不良事件的影响因素[J].中国医疗器械杂志,2008,32(1):47-49.
[4] 徐研偌 解读我国医疗器械新政[J].中国医疗器械信息,2013,19(8):55-59.

