重组腺病毒低氧诱导因子1α三突变体基因对兔缺血后肢血流灌注及血管渗透性的影响
何文凯,李明琰,崔永生,陈建威,王月刚,陈冬冬,吴平生
(1.南方医科大学附属南方医院心内科,广州510512;2.广州医科大学附属第一医院心内科,广州510120;3.广州医科大学附属第四医院心内科,广州511447;4.暨南大学附属华侨医院心内科,广州510630)
重组腺病毒低氧诱导因子1α三突变体基因对兔缺血后肢血流灌注及血管渗透性的影响
何文凯1,2,李明琰2,崔永生3,陈建威4,王月刚1,陈冬冬4,吴平生1
(1.南方医科大学附属南方医院心内科,广州510512;2.广州医科大学附属第一医院心内科,广州510120;3.广州医科大学附属第四医院心内科,广州511447;4.暨南大学附属华侨医院心内科,广州510630)
目的研究重组腺病毒低氧诱导因子1α三突变体基因(Ad-HIF-1α-trip)对兔缺血后肢血管渗透性的影响。方法18只新西兰大白兔建立左侧后肢急性缺血模型,随机分成3组,分别为生理盐水组、腺病毒空载体组(Ad-Null组)、Ad-HIF-1α-trip组,每组6只,分别在术后即刻肌注生理盐水、Ad-Null及Ad-HIF-1α-trip。在术后即刻及基因转染后7、14和28 d进行血管超声检查。术后7 d、14 d和28 d通过血管超声计算缺血侧髂内动脉血流量标化值,评价兔缺血后肢血流灌注改善情况。基因转染后28 d采用伊文思蓝(EB)染色法测定各组缺血肌肉组织中EB含量,评价Ad-HIF-1α-trip对缺血组织新生血管渗透性的影响。结果Ad-HIF-1α-trip组缺血侧髂内动脉血流量标化值增加大于其他2组,差异有统计学意义(P<0.05);Ad-HIF-1α-trip组缺血肌肉组织的EB含量略高于Ad-Null组及生理盐水组,但组间差异无统计学意义(P>0.05)。结论Ad-HIF-1α-trip能有效改善缺血肌肉组织的血流灌注,同时并未明显增加新生血管的渗透性。
重组腺病毒低氧诱导因子1α三突变体;血流灌注;渗透性
缺血性疾病的治疗现状和基因生物技术的发展,使治疗性血管生成成为近年来该领域实验和临床研究的热点。血管内皮生长因子(vascular endothelial growth factor,VEGF)促血管生成的离体和在体实验曾给缺血性疾患者带来希望,但在缺血性下肢疾病二期临床研究中却发现,接受VEGF治疗的患者水肿发生率较高[1],该现象引起了研究者的重视。单一VEGF的作用不足以引起结构和功能完整的新生血管形成可能是出现上述问题的原因。因此有必要寻找新的促血管生成基因,使血管生成过程更趋于生理状态,产生结构完整、通透性接近生理状态的新生血管,从而减少水肿及其他渗透性增加相关不良反应的发生。低氧诱导因子1α(hypoxiainducible factor-1α,HIF-1α)作为调控血管新生的上游基因近年来在缺血组织血管新生领域引起重视,尤其是其三突变体在理论上能更有效促进下游基因持久、稳定表达;从而诱发和促进接近生理状态的血管新生,减少新生血管明显渗透的发生。
本研究中我们建立兔急性后肢缺血模型,采用局部直接肌注进行基因转染,通过血管超声了解重组腺病毒低氧诱导因子1α三突变体基因(the recombinant adenovirus containing the triple-point mutantsHIF-1αgene,Ad-HIF-1α-trip)对兔缺血后肢血流灌注的影响,基因转染后28 d,采用伊文思蓝(Evans blue,EB)染色法测定各组缺血肌肉组织中EB含量,评价Ad-HIF-1α-trip对缺血组织新生血管渗透性的影响。
1 材料与方法
1.1 材料与动物
构建Ad-HIF-1α-trip,突变的3个位点分别为将HIF-1α氧依赖降解结构域第402位的脯氨酸密码子CCA突变为丙氨酸密码子GCA,第564位的脯氨酸密码子CCC突变为丙氨酸密码子GCA,将HIF-1α转录激活区第803位的天冬酰氨密码子AAT突变为丙氨酸密码子GCA[2]。Ad-HIF-1α-trip在HEK293A细胞中扩增,氯化铯密度梯度离心、透析纯化后滴度达到2.0×1013PFU/mL(本课题组完成)。DMEM-HG干粉培养基、新生牛血清、胰蛋白酶等(广州威佳);甲酰胺溶液、EB(美国Sigma公司);Sequoia512超声仪(德国Siemens公司);健康雄性新西兰大白兔18只,体质量2.5~3.0 kg(由南方医科大学实验动物中心提供)。动物实验方法符合伦理学要求。
1.2 方法
1.2.1 急性后肢缺血模型的制备:雄性新西兰大白兔18只,术前4 h禁食水,3%戊巴比妥钠溶液(50 mg/kg)经耳缘静脉麻醉。严格无菌操作,左后肢大腿腹股沟韧带中点下方做纵形切口,暴露并游离股动脉及其分支,将股动脉全长及其分支结扎、离断,远端至腘动脉和大隐动脉分叉处。建立兔后肢缺血模型。
1.2.2 基因转染:造模后即刻,随机分为3组:生理盐水组、腺病毒空载体组(Ad-null组)、Ad-HIF-1αtrip组,每组6只。取2×1010PFU病毒溶于0.5 mL生理盐水中,沿已离断股动脉内外侧肌群5点(内侧3点,外侧2点)分次肌肉注射进行基因转染,每次0.1 mL。生理盐水组按同样方法肌注生理盐水。
1.2.3 血管超声检查:在基因转染后7 d、14 d、28 d进行血管超声检查。通过二维超声显像测量兔后肢髂内动脉血管直径(内径),脉冲多普勒血流显像测量髂内动脉峰值平均血流速度(TApeak),计算髂内动脉血流量。每分钟血流量Q=0.57A×TApeak× 60,其中A为血管截面积,A=D2π/4,D为血管直径。为尽量减少个体差异对结果的影响,用术侧(1)和健侧(2)Q值之比即标准化的Q值,用Q1/2表示,Q1/2=(D12×TApeak1)(/D22×TApeak2),进行组间比较。
1.2.4 测定各组缺血肌肉组织中EB含量:实验兔基因转染后28 d,经耳缘静脉静推3%的戊巴比妥钠溶液进行麻醉。然后静脉注射2%EB溶液4 mL/kg。3 h后过量麻醉处死实验兔,同时为清除血管内EB,向左室灌注生理盐水直至右室流出澄清透明液体为止。取术侧股动脉内外侧肌群局部骨骼肌,电子天平称重取1 g置于3 mL甲酰胺中,60℃避光水浴24 h,1 500 r/min离心10 min,取上清用ND-1000紫外分光光度计测量其在620 nm波长处的光密度值,代入标准曲线计算EB含量(μg/mL)。
1.3 统计学方法
2 结果
2.1 血管超声检查结果
各实验组兔髂内动脉血流标化值Q1/2均表现为随时间而增加的趋势。组内不同时间点比较,结果显示:生理盐水组、Ad-Null组、Ad-HIF-1α-trip组不同时间点髂内动脉血流量标化值的差异均有统计学意义(P<0.05)。多重对比结果显示,生理盐水组与Ad-Null组在同一时间点比较差异无统计学意义(P>0.05),Ad-HIF-1α-trip组与其余2组在同一时间点比较差异均有统计学意义(P<0.05)。
2.2 EB测定评估血管通透性
2.2.1 标准曲线:将配制好的各浓度EB在紫外分光光度计620 nm波长进行比色测定各浓度EB的光密度值,绘制EB标准曲线:Y=49.568X-0.0401,R2= 0.9969(Y为EB浓度,单位为μg/mL;X为光密度),见图1。
2.2.2 肌肉组织中EB含量:经测量各样本在紫外分光光度计620 nm波长处所测得OD值,换算出EB含量。基因转染后28 d,生理盐水组、Ad-Null组和Ad-HIF-1α-trip组缺血肌肉EB含量分别为(8.428± 0.634)、(8.577±0.588)和(9.000±0.331)μg/mL,Ad-HIF-1α-trip组略高于其他2组,但3组间差异无统计学意义(F=1.779,P=0.203)。

表1 基因转染后不同时间点髂内动脉血流量标化值Tab.1 The normalized blood flow of internal iliac artery at different time points after gene transfection
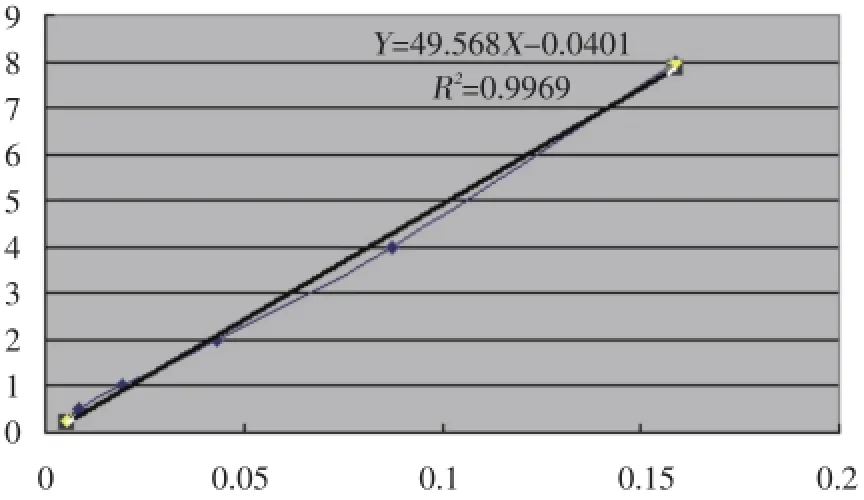
图1 EB标准曲线Fig.1 The standard curve of Evans blue
3 讨论
针对治疗性血管新生,相关实验和临床研究表明,新生血管渗透性的过度增加[1]和基因的异位表达是制约其临床应用的两大问题[3]。血管渗透性的增加使大量的血浆蛋白外漏,造成血浆和组织液胶体渗透压的梯度差,从而水分外渗造成局部水肿等不良反应。
VEGF是最早发现的引起血管通透性增加的促血管生成因子,曾被称为血管通透性因子。有研究报道,VEGF所引起的血管通透性极强,是组胺的5万倍,可有效促进大分子的循环[4],对血管新生起到有益的促进作用。并且认为VEGF在缺血性疾病治疗中增加血管渗透性,和促进内皮细胞的增殖及迁移同等重要。但后来越来越多的研究发现,新生血管通透性如果超过一定程度,会引起一些不容忽视的不良后果。具体为血管通透性增加伴随血浆和血浆蛋白的渗出,从而激活凝血系统导致纤维蛋白增多,引起局部水肿。此外,纤维蛋白在组织中的聚集,会引起新生血管和成纤维细胞的聚集等类似肿瘤和伤口愈合样反应[5],从而造成严重后果。近年来有关VEGF在血管新生领域的研究因此有所减少。
但在生理性血管生成过程中,VEGF同样起着重要作用,却未出现血管通透性增加的相关症状,如水肿的发生。可能原因在于血管生成是一个复杂的过程,需要多种细胞因子协同或拮抗作用,或彼此之间进行差异性互补。以较早应用于该领域研究的VEGF和碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)为例,VEGF造成的血管通透性增加对血管新生起极大的促进作用,但形成的血管不成熟,生理功能差。bFGF则可以促进构成成纤维细胞、平滑肌细胞和血管内皮细胞等血管主要成分的生成,从而在一定程度上弥补VEGF的不足。可见二者在血管生成过程中作用互补,缺一不可。已有研究者将二者联合应用,效果明显[6]。另有研究表明,血管生成素1(angiopoietin-1,Ang-1)和VEGF在血管生成的不同阶段起作用,VEGF在血管新生的初始阶段起重要作用,Ang-1在较晚期即血管的成熟阶段发挥作用[7]。可见,各种细胞因子在复杂的血管新生过程中即各司其职,又相互配合。
HIF-1α以其作为血管新生上游基因的优势引起研究者的重视。HIF-1α可调节和血管新生有密切关系的多种基因表达,如VEGF、Ang-1、bFGF等[8]。这些基因参与血管生成过程的重要阶段,包括血管内皮细胞的出芽、增殖、迁移、血管成熟等过程。多种因子的参与有望使血管新生过程趋于生理化,从而生成功能完整、生理缺陷小的血管。另外从基因治疗的观点来看,单一基因或多基因的联合治疗常难以控制最佳转染剂量,往往偏离生理所需。由HIF-1α诱导的下游多种促血管生成因子的表达则更接近生理状态,从而使治疗方案更加简单且而有效,血管生成过程趋于生理状态,新生血管的渗透性也应在一个生理范围,不至引起水肿等不良反应的发生。
以腺病毒为载体的HIF-1α突变体在缺血肢体改善血流、促进新生血管生成已有报道[9~11],对其促进生成的新生血管渗透性进行研究有重要意义。在本研究中,Ad-HIF-1α-trip对新生血管的渗透性通过EB法进行评价,为其应用于临床提高理论支持和实验依据。EB是一种常用的无毒生物染色剂,常用于动物血管有关蛋白质渗漏的研究[12]并且结果可靠。为避免肌肉组织微血管中残留EB对实验结果造成影响,我们在取材前用生理盐水充分进行心脏血管灌注,以保证微血管内无EB。本研究中各组实验兔在观察期间后肢均未发生水肿,EB测定结果显示,Ad-HIF-1α-trip组缺血肌肉组织的EB含量略高于Ad-Null组及生理盐水组,但组间对比差异无统计学意义。这种现象的可能解释为,HIF-1α诱导产生的下游多种促血管生长因子在缺血肌肉组织的表达量比例接近生理状态,在血管生成的过程中协调作用,故而Ad-HIF-1α-trip诱导下产生的血管网不仅密集,而且成熟度接近机体对缺血的自身反应,血管渗透性没有明显增加。该研究为Ad-HIF-1αtrip的临床应用提供了一定的理论支持。
[1]Baumgartner I,Rauh G,Pieczek A,et al.Lower-extremity edema associated with gene transfer of naked DNA encoding vascular endothelial growth factor[J].Ann Intern Med,2000,132(11):880-884.
[2]赖艳娴,刘城,王月刚,等.人3突变型低氧诱导因子1α真核表达载体和腺病毒表达载体的构建及鉴定[J].中国医科大学学报,2008,37(1):86-92.
[3]Thurston G,Rudge J S,Ioffe E,et al.Angiopoietin-1 protects the adult vasculature against plasma leakage[J].Nat Med,2000,6(4):460-463.
[4]Collins PD,Connolly DT,Williams TJ.Characterization of the increase in vascular permeability induced by vascular permeability factor in vivo[J].Br J Pharmacol,1993,109(1):195-199.
[5]Lee JS,Kim JM,Kim KL,et al.Combined administration of naked DNA vectors encoding VEGF and bFGF enhances tissue perfusion and arteriogenesis in ischemic hindlimb[J].Biochem Biophys Res Commun,2007,360(4):752-758.
[6]Jain RK.Molecular regulation of vessel maturation[J].Nat Med,2003,9(6):685-693.
[7]Karamysheva AF.Mechanisms of angiogenesis[J].Biochemistry(Mosc),2008,73(7):751-762.
[8]Ke Q,Costa M.Hypoxia-inducible factor-1(HIF-1)[J].Mol Pharmacol,2006,70(5):1469-1480.
[9]Xie J,Liao Y,Yang L,et al.Ultrasound molecular imaging of angiogenesis induced by mutant forms of hypoxia-inducible factor-1α[J]. Cardiovasc Res,2011,92(2):256-266.
[10]Li M,Liu C,Bin J,et al.Mutant hypoxia inducible factor-1α improves angiogenesis and tissue perfusion in ischemic rabbit skeletal muscle[J].Microvasc Res,2011,81(1):26-33.
[11]陈娓,李文强,付锐斌,等.大鼠下肢缺血模型中双位点诱变体HIF-1α的促血管新生作用[J].中国医科大学学报,2008,37(4):448-451.
[12]Saria A,Lundberg JM.Evans blue fluorescence:quantitative and morphological evaluation of vascular permeability in animal tissues[J].J Neurosci Methods,1983,8(1):41-49.
(编辑陈姜)
Effectsof Ad-HIF-1α-trip Gene on Blood Perfusion and Neovascular Permeability in Rabbit Hindlimb Ischemia
HEWen-kai1,2,LIMing-yan2,CUIYong-sheng3,CHENJian-wei4,WANGYue-gang1,CHEN Dong-dong4,WUPing-sheng1
(1.DepartmentofCardiology,Nanfang Hospital,Southern MedicalUniversity,Guangzhou 510512,China;2.DepartmentofCardiology,The FirstAffiliated Hospitalof Guangzhou Medical University,Guangzhou 510120,China;3.Department of Cardiology,The Fourth Affiliated Hospital of Guangzhou Medical University,Guangzhou 511447,China;4.DepartmentofCardiology,The FirstAffiliated HospitalofJinan University,Guangzhou 510630,China)
ObjectiveTo investigate the effects ofthe recombinantadenoviralexpression oftriple-pointmutantsHIF1-αgene(Ad-HIF-1α-trip)on the blood perfusion and neovascular permeability in the rabbit model of ischemic hindlimb.MethodsAfter ligation of left femoral artery,18 male New Zealand white rabbits were randomly divided into 3 groups:saline group(n=6),Ad-null group(n=6)andAd-HIF-1α-tripgroup(n=6),then the animals in different groups received saline,Ad-null andAd-HIF-1α-triprespectively by intramuscular injection.Vascular ultrasound was used to estimate the improvement of blood perfusion,the normalized blood flow of internal iliac artery of the hindlimb on the 7th,14th,and 28th day after gene transfection was calculated.On the 28th day after gene transfection,the permeability of the neovasculature in the ischemic skeletal muscle was evaluated by Evans blue(EB)uptake assay.ResultsVascular ultrasound revealed better blood perfusion inAd-HIF-1α-tripgroup than other groups(P<0.05).Quantification of the leakage levels of EB dye demonstrated that there were no obvious differences among three groups(P>0.05),although the level of EB in theAd-HIF-1α-tripgroup was a little higher than the other groups.ConclusionAd-HIF-1α-tripcan effectively improve the blood perfusion ofischemic limb,butdid notsignificantly increase the permeability ofthe neovasculature.
the recombinant adenovirus containing the triple-point mutantsHIF-1αgene;blood perfusion;permeability
R361
A
0258-4646(2014)03-0240-04
广东省自然科学基金(S2011010003151);广东省科技计划项目(2011B031800286)
何文凯(1972-),男,主任医师,博士.
吴平生,E-mail:1952449101@qq.com
2013-12-26
网络出版时间:

