蟾毒灵通过下调AKT的活性诱导乳腺癌MCF⁃7细胞凋亡
闫顺朝,刘云鹏,曲秀娟,焦昕,李凯,李午生,邹华伟
(1.中国医科大学附属盛京医院第一肿瘤科,沈阳110022;2.中国医科大学附属第一医院肿瘤内科,沈阳110001;3.沈阳市胸科医院呼吸一科,沈阳110044)
蟾毒灵通过下调AKT的活性诱导乳腺癌MCF⁃7细胞凋亡
闫顺朝1,刘云鹏2,曲秀娟2,焦昕3,李凯1,李午生1,邹华伟1
(1.中国医科大学附属盛京医院第一肿瘤科,沈阳110022;2.中国医科大学附属第一医院肿瘤内科,沈阳110001;3.沈阳市胸科医院呼吸一科,沈阳110044)
目的研究蟾毒灵(Bufalin)对乳腺癌MCF⁃7细胞增殖及凋亡的影响及其机制。方法采用MTT法测定细胞活力、流式细胞术检测细胞凋亡和线粒体跨膜电位的变化,Western blot法检测PARP、cleaved⁃PARP、AKT及p⁃AKT蛋白的表达。结果MTT结果显示:Bufalin以时间及剂量依赖的方式抑制MCF⁃7细胞增殖,24、48和72 h的IC50分别为317、50和32 nmol/L。流式分析结果显示:Bufalin可诱导MCF⁃7细胞发生G2/M期阻滞及凋亡。进一步研究发现Bufalin作用后会导致线粒体跨膜电位下调,从而导致线粒体内凋亡通路的活化。Western blot结果显示:Bufalin作用后会导致AKT的一过性活化,最终AKT的活性被灭活,PARP裂解,细胞发生凋亡。结论Bufalin可通过下调AKT的活性诱导乳腺癌MCF⁃7细胞凋亡。
蟾毒灵;AKT;乳腺癌;凋亡
乳腺癌是严重危害女性健康的恶性肿瘤之一,近年来发病呈上升趋势[1]。随着科技的发展,乳腺癌治疗水平已显著提高,但每年仍有40余万女性死于乳腺癌[2]。研究显示,大部分发生远处转移的患者对前期用药产生耐药,因此急需探索新的药物以提高乳腺癌的疗效。应用中药及其有效成分进行的综合治疗是近年来肿瘤领域的研究热点,可能为乳腺癌的治疗开辟新的途径。
蟾毒灵(Bufalin)是中药蟾酥的活性成分之一,既往研究发现Bufalin可抑制血液系统肿瘤、胃癌和肝癌细胞的增殖[3]。本研究拟探讨Bufalin对乳腺癌MCF⁃7细胞增殖和凋亡的影响及其机制。
1 材料与方法
1.1 材料
人乳腺癌细胞株MCF⁃7购自中国科学院上海细胞库。Bufalin、MTT、碘化丙锭(propidium io⁃dide,PI)均购自Sigma Aldrich公司(St.Louis,美国),一抗兔抗人anti⁃PARP、anti⁃actin、anti⁃AKT和anti⁃p⁃AKT购自Santa Cruze公司,二抗HRP标记的羊抗兔及羊抗鼠IgG均购自Santa Cruze公司。
1.2 方法
1.2.1 细胞培养:用含10%小牛血清的1640完全培养基,在37℃、5%CO2、100%湿度的培养箱中培养MCF⁃7细胞。待细胞刚刚长满培养瓶底部时,以0.25%胰蛋白酶(含0.02%EDTA)消化成单个细胞,继续传代,并取对数生长期细胞进行实验。
1.2.2 药物处理及分组:Bufalin用DMSO配制成终末浓度为1×10-2mol/L的无菌液-20℃保存,实验时根据需要再配制成不同浓度。将细胞随机分为药物溶剂对照组、单纯细胞对照组和实验组。
1.2.3 MTT法检测细胞活力:取对数生长期细胞,调整细胞浓度为3.5×104/mL,接种于96孔培养板内,每孔180 μL。24 h后加药,实验组加Bufalin,终浓度分别为0、5、10、20、40、80、160 nmol/L,单纯细胞对照组不加任何处理因素,药物溶剂对照组加等体积1640培养液。每组设3个平行孔,培养24、48、72 h后各孔加入20 μL MTT(5 g/L),孵育4 h后弃上清,加100 μL DMSO混匀震荡15 min后,用酶联免疫测定仪于570 nm波长条件下测定各孔的吸光度值(optical density,OD)。计算3孔平均值,按公式计算细胞增殖率,画出细胞生存曲线,求出IC50。以上实验重复3次。细胞生长的增殖率=(OD均值实验组-OD均值药物溶剂对照组)/(OD均值单纯细胞对照组-OD均值药物溶剂对照组)×100%。
1.2.4 流式细胞仪分析法检测细胞凋亡及周期:将乳腺癌MCF⁃7细胞接种于6孔板内,实验组加入50 nmol/L Bufalin,对照组加入等量Bufalin的溶剂,作用一定时间后分别收集对照组及实验组细胞,70%乙醇固定过夜,加入20 μg/mL RNase A,37℃孵育30 min,再加入20 μg/mL PI避光孵育15 min,用FAC Scan流式细胞仪进行细胞凋亡的检测及细胞周期分析。
1.2.5 线粒体跨膜电位(△ψm)检测:取对数生长期的细胞,常规胰酶消化制成单细胞悬液,6孔板接种细胞(3×105/孔),培养12 h后实验组加入50 nmol/L的Bufalin,对照组加入等量的培养液,24及48 h后分别收集对照组及实验组的细胞,冷PBS洗2次,加入20 nmol/L DiOC6于37℃避光孵育15 min,流式细胞仪检测DiOC6荧光强度。采用CELLQuest软件进行分析。
1.2.6 Western blot法检测PARP、β⁃actin、AKT、p⁃AKT蛋白的表达水平及活性:用4℃PBS洗涤MCF⁃7细胞,Bufalin作用0、3、6、12、24 h后,加入100 μL含有蛋白酶抑制剂的RIPA裂解液中,超声粉碎,4℃裂解40 min,4℃15 000 r/min离心30 min,取上清,以上步骤均于冰上操作。采用Lowry法进行总蛋白定量,以1∶2比例与3×样品缓冲液混匀,煮沸5 min,行10%SDS聚丙烯凝胶电泳2 h,通过湿式转印恒流60 mA、120 min,转印到硝酸纤维素膜上,50 g/L脱脂奶粉封闭2 h,按Marker标记的分子量剪裁转印膜,一抗4℃过夜,二抗室温孵育30 min。显色,图像采集及分析处理。
所有实验均重复3次。采用GraphPad Prism version 5.00软件计算Bufalin的IC50值。
2 结果
2.1 Bufalin对乳腺癌MCF⁃7细胞增殖的抑制作用和细胞周期的影响
MTT结果显示:Bufalin以时间及剂量依赖的方式抑制细胞增殖,24、48和72 h的IC50分别为317、50和32 nmol/L(图1A)。为明确Bufalin抑制MCF⁃7细胞增殖的机制,本研究进行了流式细胞仪分析检测,结果显示:24 h后,低浓度Bufalin主要诱导细胞发生G2/M期阻滞,而在高浓度Bufalin作用下大部分细胞发生凋亡(图1B)。
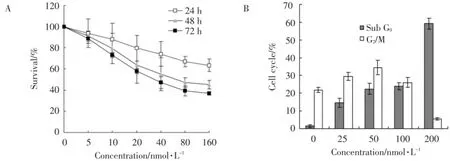
图1 Bufalin对乳腺癌MCF⁃7细胞增殖和细胞周期的影响Fig.1 Effects of bufalin on the proferation and cell cycle phase distribution of MCF⁃7 cells
2.2 Bufalin对MCF⁃7细胞形态和线粒体跨膜电位的影响
为检测Bufalin对MCF⁃7细胞形态学的影响,本研究选择了50 nmol/L(48 h IC50)的Bufalin进行进一步的实验,实验组加入50 nmol/L的Bufalin,对照组加入等量Bufalin的溶剂,在作用24 h后,苏木素—伊红染色,光学显微镜下观察细胞形态学变化。结果显示:与对照组相比,Bufalin作用24 h后部分细胞出现多核,核碎裂及凋亡小体,提示细胞发生了G2/M期阻滞和凋亡。Bufalin作用48 h后出现核碎裂及核小体的细胞明显增多,多核细胞比例减少,提示凋亡细胞比例升高,G2/M期阻滞细胞比例减少,与流式细胞仪检测结果一致。见图2。
为明确Bufalin诱导MCF⁃7细胞凋亡的机制,50 nmol/L的Bufalin处理细胞24、48 h后经DiOC6染色,流式细胞术检测线粒体跨膜电位变化,结果显示:50 nmol/L的Bufalin作用24 h后线粒体跨膜电位下降30.7%,作用48 h后下降45.1%,提示Bufalin可能是通过下调线粒体跨膜电位,活化线粒体凋亡通路,诱导MCF⁃7细胞凋亡。见图2。
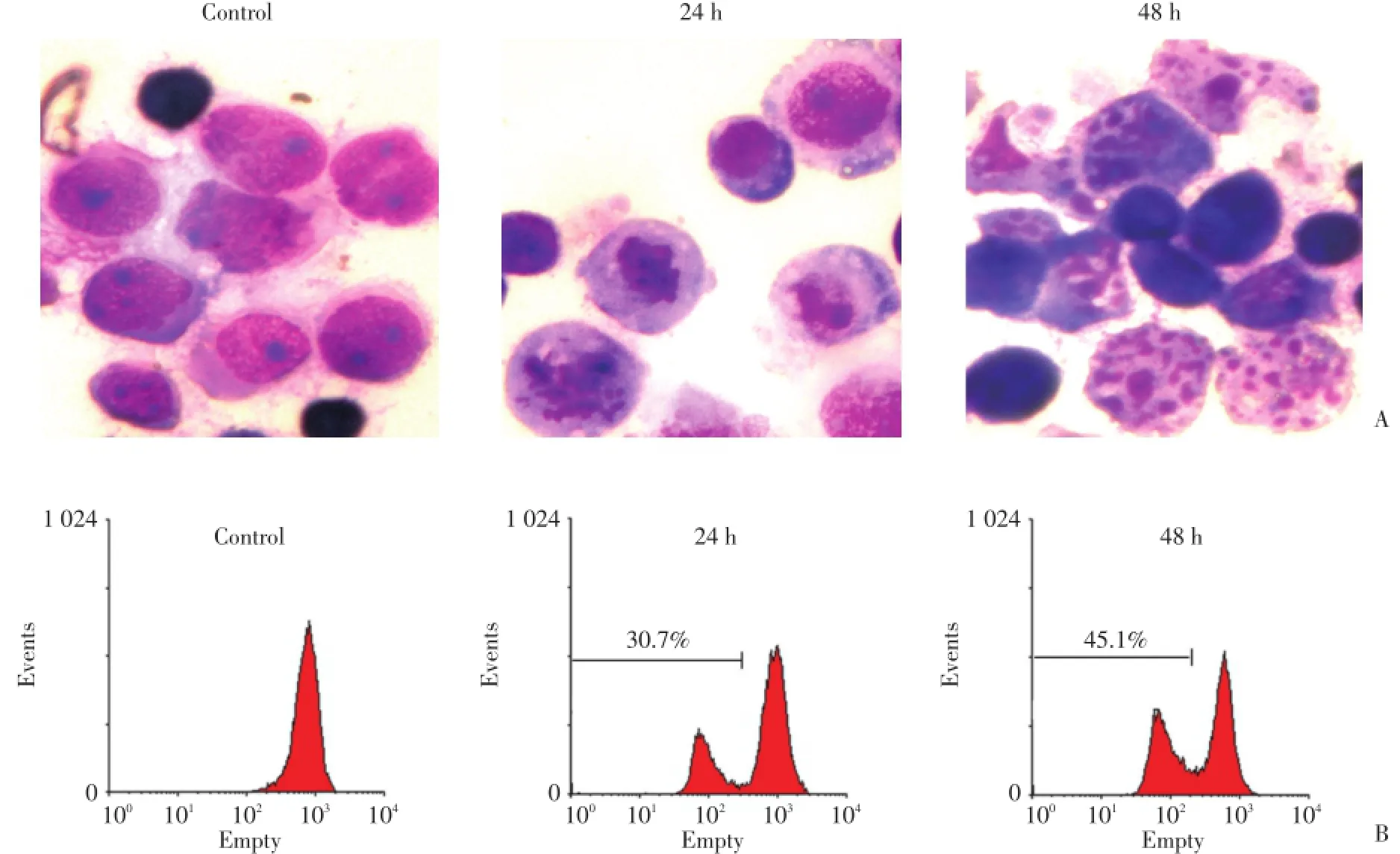
图2 Bufalin对MCF⁃细胞形态及线粒体跨膜电位的影响Fig.2 Effects of bufalin on cell morphology and mitochondrial transmembrane potential
2.3 Bufalin对AKT活性及凋亡底物蛋白PARP裂解的影响
为进一步研究Bufalin诱导乳腺癌MCF⁃7凋亡的机制,本研究检测了凋亡底物蛋白PARP的裂解情况及细胞内主要的增殖存活信号AKT活性的变化,Western blot结果显示:Bufalin作用3 h、6 h后,AKT活性明显升高,但在作用24 h后AKT活性下降至本底水平(对照组,即0 h组)以下,PARP裂解明显增强(图3)。提示Bufalin可能是通过抑制增殖存活信号AKT的活性,启动线粒体内凋亡通路,诱导乳腺癌MCF⁃7细胞凋亡。

图3 Bufalin(50 nmol/L)作用不同时间后PARP的裂解与AKT活性的变化情况Fig.3 MCF⁃7 cells were treated by 50 nmol/L bufalin for indicated times,and the expression of PARP and AKT was analysed by Western blot
3 讨论
乳腺癌是女性最常见的恶性肿瘤之一,我国乳腺癌的发病率正以每年3%的速率递增,每年约有13万人被诊断为乳腺癌。随着中药提纯技术的发展,目前中医中药在乳腺癌的基础研究与临床治疗方面均取得了一定的进展,在临床上成为恶性肿瘤有效的辅助治疗手段之一,弥补了现代医学的不足。蟾酥是我国的传统中药,是蟾蜍表皮腺体的分泌物,Bufalin是蟾酥的主要成分之一。既往研究显示,在实体瘤中,Bufalin可抑制子宫内膜癌、卵巢癌、胃癌、肝癌等细胞增殖[4],本研究结果发现,Bufa⁃lin可以时间及剂量依赖方式抑制乳腺癌MCF⁃7细胞增殖,提示临床上含Bufalin的中成药可能对乳腺癌的治疗有效。
Bufalin对细胞周期的影响在不同的细胞表现不同,Huang等[5]在膀胱癌T24细胞的研究中发现它能诱导细胞发生G0/G1期阻滞,Xie等[6]在结肠癌细胞研究中发现Bufalin可诱导细胞发生自噬性凋亡,Zhang等[7]在肝癌HepG2细胞的研究中发现,Bufalin可诱导细胞发生G2/M期阻滞和凋亡而发挥抗肿瘤作用。本研究发现Bufalin可诱导乳腺癌MCF⁃7细胞发生G2/M期阻滞和凋亡。
细胞发生周期阻滞和凋亡时会发生形态学变化,本研究结果显示:Bufalin作用24 h后,部分细胞发生了G2/M期阻滞,表现为细胞出现双核及停滞于分裂中期,同时部分细胞发生了凋亡,形态学可见典型的凋亡改变,表现为细胞膜完整,细胞质固缩,胞核固缩或碎裂,可见凋亡小体,Bufalin作用48 h后凋亡细胞比例明显升高,出现凋亡小体细胞比例升高。这与流式细胞仪检测结果一致,从形态学上验证了Bufalin是通过诱导细胞发生G2/M期阻滞和凋亡,从而抑制细胞增殖的。
细胞凋亡的发生机制目前认为主要有2条信号通路介导,一条是通过活化Fas/FasL或TNF/TNFR,激活下游信号通路的死亡受体通路,另一条是通过线粒体的信号通路,即通过下调线粒体跨膜电位,促进线粒体释放细胞色素C等信号分子,激活下游信号通路,介导细胞凋亡的发生[8]。Qi等[9]的研究发现Bufalin可通过活化Fas介导的死亡受体通路诱导肝癌细胞凋亡。本研究结果显示,Bufalin作用24 h后会导致线粒体跨膜电位下降,作用48 h后线粒体跨膜电位进一步下降,提示Bufalin是通过活化线粒体信号通路诱导MCF⁃7细胞凋亡。
细胞是“存活”还是“死亡”取决于细胞内存活信号与死亡信号之间的动态平衡,PARP是细胞内重要的底物蛋白,其活化裂解是细胞发生凋亡的必需条件,PARP的裂解情况是细胞发生凋亡的标志物[10]。Huang等[11]在多发性骨髓瘤的研究中发现Bufalin为一种新型的PARP1抑制剂,可通过导致PARP裂解下调PARP表达水平,诱导细胞凋亡。本研究结果显示:Bufalin作用24 h后,细胞内PARP裂解明显增强,提示细胞发生了凋亡。AKT是细胞内主要的存活及增殖信号,AKT的活化与肿瘤细胞的无限增殖与耐药密切相关,可通过影响下游凋亡相关蛋白的活化介导细胞的耐药[12]。下调AKT的活性可抑制细胞增殖,诱导细胞凋亡。AKT是肿瘤临床治疗的潜在靶点,在进展期肾细胞癌患者中AKT抑制剂Perifosine现已处于Ⅱ期临床试验阶段[13],但AKT信号在Bufalin诱导乳腺癌细胞凋亡过程中发挥的作用尚未见报道。本研究结果发现:在Bufalin作用短时间后,AKT的活性上调,提示AKT参与了细胞早期应激过程,但最终AKT被灭活,同时PARP发生裂解,线粒体跨膜电位下降,线粒体凋亡通路活化,细胞发生凋亡,提示AKT活性最终灭活可能是Bufalin诱导乳腺癌MCF⁃7细胞凋亡的“开关”。
总之,本研究结果发现:Bufalin能够以时间及剂量依赖的方式抑制乳腺癌MCF⁃7细胞增殖,可诱导细胞发生G2/M期阻滞和凋亡,并可能通过下调AKT的活性,导致线粒体跨膜电位的下调,启动线粒体凋亡通路,诱导细胞凋亡。
[1]Jemal A,Bray F,Center MM,et al.Golbal cancer statistic[J].CA Cancer J Clin,2011,61(2):69-90.
[2]Kamangar F,Dores GM,Anderson WF.Patterns of cancer inci⁃dence,mortality,and prevalence across five continents:defining pri⁃orities to reduce cancer disparities in different geographic regions of the world[J].J Clin Oncol,2006,24(14):2137-2150.
[3]曾欢,宋兴福,董自强.蟾蜍制剂诱导肿瘤细胞凋亡的研究进展[J].现代肿瘤医学,2012,20(4):865-867.
[4]Yin PH,Liu X,Qiu YY,et al.Anti⁃tumor activity and apoptosis⁃reg⁃ulation mechanisms of bufalin in various cancer:new hope for can⁃cer patients[J].Asian Pac J Cancer Prev,2012,13(11):5339-5343.
[5]Huang WW,Yang JS,Pai SJ,et al.Bufalin induces G(0)/G(1)phase arrest through inhibiting the levels of cyclin D,cyclin E,CDK2 and CDK4,and triggers apoptosis via mitochondrial signal⁃ing pathway in T24 human bladder cancer cells[J].Mutat Res,2012,732(1⁃2):26-33.
[6]Xie CM,Chan WY,Yu S,et al.Bufalin induces autophagy⁃mediated cell death in human colon cancer cells through reactive oxygen spe⁃cies generation and JNK activation[J].Free Radic Biol Med,2011,51(7):1365-1375.
[7]Zhang DM,Liu JS,Tang MK.Bufotalin from Venenum Bufonis in⁃hibits growth of multidrug resistant HepG2 cells through G2/M cell cycle arrest and apoptosis[J].Eur J Pharmacol.2012,692(1⁃3):19-28.
[8]Ouyang L,Shi Z,Zhao S,et al.Programmed cell death pathways in cancer:a review of apoptosis,autophagy and programmed necrosis[J].Cell Prolif,2012,45(6):487-498.
[9]Qi F,Inagaki Y,Gao B,et al.Bufalin and cinobufagin induce apop⁃tosis of human hepatocellular carcinoma cells via Fas⁃and mito⁃chondria⁃mediated pathways[J].Cancer Sci,2011,102(5):951-958.
[10]Boulares AH,Yakovlev AG,Ivanova V,et al.Role of poly(ADP⁃ri⁃bose)polymerase(PARP)cleavage in apoptosis.Caspase 3⁃resis⁃tant PARP mutant increases rates of apoptosis in transfected cells[J].J Biol Chem,1999,274(33):22932-22940.
[11]Huang H,Cao Y,Wei W,et al.Targeting poly(ADP⁃ribose)poly⁃merase partially contributes to bufalin⁃induced cell death in multi⁃ple myeloma cells[J].PLoS One,2013,8(6):e66130.
[12]Strozyk E,Kulms D.The role of AKT/mTOR pathway in stress re⁃sponse to UV⁃irradiation:implication in skin carcinogenesis by reg⁃ulation of apoptosis,autophagy and senescence[J].Int J Mol Sci,2013,14(8):15260-15285.
[13]Cho DC,Hutson TE,Samlowski W,et al.Two phase 2 trials of the novel Akt inhibitor perifosine in patients with advanced renal cell carcinoma after progression on vascular endothelial growth factor⁃targeted therapy[J].Cancer,2012,118(24):6055-6062.
(编辑王又冬)
Bufalin Induced Apoptosis of MCF⁃7 Breast Cancer Cells by Down⁃regulating the Activity of AKT
YAN Shun⁃chao1,LIU Yun⁃peng2,QU Xiu⁃juan2,JIAO Xin3,LI Kai1,LI Wu⁃sheng1,ZOU Hua⁃wei1
(1.Department of Oncology,Shengjing Hospital,China Medical University,Shenyang 110022,China;2.Department of Medical Oncology,The First Hospital,China Medical University,Shenyang 110001,China;3.Department of Respiratory Medicine,Shenyang Chest Hospital,Shenyang 110044,China)
ObjectiveTo investigate the effects of bufalin on the proliferation and apoptosis of MCF⁃7 cells,and explore the possible mechanism.MethodsCells proliferation was measured using MTT assay.Cells apoptosis and mitochondrial transmembrane potential were determined by flow cytometry.Expression of PARP,cleaved⁃PARP,AKT and p⁃AKT was analyzed by Western blot.ResultsBufalin could surppress the proferation of MCF⁃7 cells in a time and dose⁃dependent manner.The 24 h,48 h and 72 h IC50were 317 nmol/L,50 nmol/L and 32 nmol/L,respectively.Flow cytometry analysis showed that bufalin could induce G2/M cycle arrest and apoptosis of MCF⁃7 cells.Further analysis showed that bufalin treatment significantly down⁃regulated mitochondrial transmembrane potential.Western blot analysis demonstrated that bufalin treatment lead to a transiently activated of AKT signaling pathway and then completely inactivated it.Meanwhile,PARP was activated and cleaved.ConclusionBufalin induces apoptosisin MCF⁃7 cells through down⁃regulation of AKT activity.
Bufalin;AKT;breast cancer;apoptosis
R730.52
A
0258-4646(2014)07-0598-04
国家自然科学基金(81302313)
闫顺朝(1984-),男,主治医师,博士.
邹华伟,E-mail:zouhw@sj-hospital.org
2014-03-12
网络出版时间:

