氟虫腈为配基的亲和介质制备及鱼类GABA受体纯化
于广金 张博 杨姗 张元 任天瑞
上海师范大学生命与环境科学学院(上海 200234)
上海师范大学资源化学教育部重点实验室(上海200234)
技术进步
氟虫腈为配基的亲和介质制备及鱼类GABA受体纯化
于广金 张博 杨姗 张元 任天瑞
上海师范大学生命与环境科学学院(上海 200234)
上海师范大学资源化学教育部重点实验室(上海200234)
以琼脂糖凝胶(Sepharose)CL-6B为载体,衍生化的氟虫腈为亲和配基,制备亲和层析介质,对其进行FT-IR和XPS表征。用制备的亲和层析介质分离鱼类脑组织中的GABA(γ-氨基丁酸)受体,研究分离蛋白质的效率。结果表明,成功将氟虫腈作为配体偶联到亲和介质上,偶联量为36.68 μmol/g胶;SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)显示两条蛋白质条带,其相对分子质量约为44 kD和55 kD。
GABA受体氟虫腈亲和层析
γ-氨基丁酸(gama-aminobutyric acid,GABA)受体是昆虫和哺乳动物神经系统中主要的抑制性神经递质受体[1-2],它不仅是氟虫腈、阿维菌素和林丹等杀虫剂的作用靶标[3-4],还与人的癫痫、精神分裂症、失眠、帕金森综合症等神经性疾病密切相关[5-8]。因此,分离纯化GABA受体并研究其立体结构具有重要的科学意义。
亲和层析技术具有高收率、高纯度并能保持生物大分子的天然状态等优点,广泛应用于生物大分子的分离纯化。亲和配基是亲和色谱中最为关键的分子识别部分。亲和配基的选择与筛选是发展新的亲和色谱填料或构建一个新的亲和色谱体系所必须解决的首要问题。Sigel[9]、Sawyer[10]、Gavish[11]等用Ro7-1986/1作为亲和配基,从牛脑中成功分离出GABA/苯二氮卓受体复合物,纯化倍数分别为200倍、150~200倍、200倍。Taguchi等[12]用1012-S作为亲和配基,从大鼠脑中分离得到GABA/苯二氮卓受体复合物,蛋白回收率为33.4%,纯化倍数为60倍。Martini等[13]以地洛西泮作为亲和配基,纯化得到大鼠脑中的苯二氮卓受体,蛋白回收率为40%~50%,纯化倍数达5200倍。
氟虫腈作为一种芳基吡唑类杀虫剂,其作用机理是抑制GABA受体氯离子通道,但对蜜蜂和鱼类具有高毒性。本课题选用氟虫腈作为配基制备亲和层析柱,并从鱼脑中分离纯化GABA受体蛋白,对研究氟虫腈与GABA受体蛋白的相互作用,探索氟虫腈对鱼类的毒性机理具有重要意义。
1 实验部分
1.1 试剂与仪器
试剂:氟虫腈,江苏优士化学有限公司;琼脂糖凝胶(Sepharose)CL-6B,北京鼎国生物制品有限公司;4-二甲氨基吡啶(DMAP)、四丁基溴化铵(TBAB)、N,N-二甲基甲酰胺(DMF)、溴乙酰溴,均为分析纯,国药集团化学试剂有限公司;l,4-丁二醇二缩水甘油醚、蔗糖、醋酸镁、Triton X-100、磷酸钾(K3PO4)、牛血清蛋白(BSA)、蛋白质标记物,上海生工生化有限公司;鳙鱼,购于当地市场;超纯水、氟西泮,实验室自制。
仪器:Nicolet 6700傅里叶变换红外光谱仪,美国ThermoFisher公司;TU 21201型紫外可见分光光度计,北京普析通用仪器设备有限公司;S-4800场发射扫描电镜,日本日立公司;PHI-5000 Versaprobe II X射线光电子能谱仪(XPS),日本ULVAC-PHI公司;LC-10P高效液相色谱输液泵,大连江申分离科学技术公司;L-80XP超速离心机,美国Beckman公司;24-DN制胶器、DYY-3C电泳仪,北京六一仪器厂;WD-9413B凝胶成像分析仪、层析系统,上海沪西分析仪器厂;超滤管,美国Millipore公司;优普超纯水制造系统,成都超纯科技有限公司。
1.2 氟虫腈亲和配基的合成[14-16]
氟虫腈亲和配基的合成过程如图1所示。
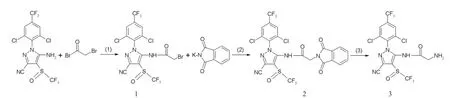
图1 氟虫腈亲和配体的合成路线
中间产物1的合成:向100 mL三口烧瓶中加入4.40 g(10 mmol)氟虫腈和30 mLCH2Cl2,在冰浴和氮气保护下加入1.2 g DMAP和4 mL三乙胺,搅拌30 min后,滴加溴乙酰溴4 mL(约46 mmol),室温下反应8 h。将反应液倒入40 mL冰水中,用CH2Cl2(20 mL×3)萃取,合并有机相,无水MgSO4干燥过夜,减压脱溶,经硅胶层析分离[石油醚∶乙酸乙酯=8∶1(体积比)]得到淡黄色固体1,产率为70%,m.p.(熔点)为167~169℃;1H NMR(CDCl3,600 MHz),δ: 9.22(s,1H,NH),7.73~7.80(s,2H,Ar-H),4.11~4.12(s,2H, CH2)。
中间产物2的合成:向100 mL三口烧瓶中加入2.32 g(0.004 mol)中间产物1、7.4 g(0.04 mol)邻苯二甲酰亚胺钾盐、0.8 g TBAB及40 mL DMF,80℃下反应6 h。将反应液倒入40 mL冰水中,用CH2Cl2(20 mL×3)萃取,合并有机相,无水MgSO4干燥过夜,减压脱溶,得中间产物2,产率为65%。
目标产物3(亲和配基)的合成:向100 mL三口烧瓶中加入26.23 g(0.01 mol)中间产物和30 mL乙醇,70℃下滴加1.18 g(0.02 mol)85%水合肼,滴加完毕后70℃下反应5 h。将反应液降温至室温,用乙醚(30 mL×3)萃取,合并有机相,用饱和食盐水洗至中性,无水Na2SO4干燥,减压脱溶,经硅胶层析分离[石油醚∶乙酸乙酯=6∶1(体积比)]得目标产物3,产率为40%,m.p.为197~199℃。1H NMR(600 MHz,CDCl3),δ:8.41(1H,s,NH),7.72~7.70(2H,d,Ar-H/ H’),3.10(2H,s,CH2),2.81(2H,s,NH2)。
1.3 琼脂糖凝胶CL-6B环氧活化
取20 mL琼脂糖凝胶CL-6B基质,在砂芯漏斗中用大量去离子水冲洗、抽干,转移至250 mL带塞磨口锥形瓶中,依次加入20 mL浓度为0.6 mol/L的NaOH溶液(含2 g/L NaBH4),20 mL 1,4-丁二醇二缩水甘油醚,30℃下在恒温振荡器中反应8 h。基质依次用20%乙醇、去离子水和20%乙醇洗涤,最后用大量去离子水洗涤后,于20%乙醇溶液中保存。
1.4 氟虫腈亲和配基与活化琼脂糖凝胶CL-6B的偶联
氟虫腈亲和配基与环氧活化琼脂糖凝胶CL-6B偶联反应过程如图2所示。具体过程如下:取环氧活化琼脂糖凝胶CL-6B 30 mL,在砂芯漏斗中用大量去离子水冲洗、抽干,转移到250 mL带塞磨口锥形瓶中。在锥形瓶中依次加入氟虫腈亲和配基、40 mL(pH=9.0)浓度为0.1 mol/L的碳酸钠缓冲液和10 mL DMSO,37℃下在恒温振荡器中反应12 h。将料液转移至砂芯漏斗中,去离子水淋洗至无配基检出,抽干,留取淋洗液备用。

图2 氟虫腈亲和配体对琼脂糖凝胶的修饰过程
在抽干的凝胶中加入1 mol/L乙醇胺,37℃振荡反应4 h;凝胶依次用去离子水、0.1 mol/L(pH=4.0)的乙酸-乙酸钠缓冲液(含0.5 mol/L NaCl)、去离子水和0.1 mol/L(pH=8.5)的硼酸-四硼酸钠缓冲液(含0.5 mol/L NaCl)洗涤,去离子水洗后抽干,于4℃下20%乙醇中保存备用。
1.5 环氧基及配体偶联密度的测定
活化载体上的环氧基测定采用Na2S2O3滴定法[17]。
配体偶联密度采用分光光度法测定,收集淋洗液并定容,用紫外光谱测定淋洗液在279 nm处的吸光度,从标准曲线上得到未偶联配基的浓度即可计算出配体的偶联密度。
1.6 鳙鱼脑内GABA受体的纯化
采用Sigel[9]的方法得到鳙鱼脑内含GABA受体蛋白粗提液。将氟虫腈亲和层析介质装入层析柱(1.0 cm×10 cm),用100 mL缓冲溶液A[pH=7.5,含10 mmol K3PO4、2 mmol醋酸镁、50 mmol KCl、蔗糖(质量浓度为11 mg/mL)、1 mmol EGTA、Triton X-100(质量浓度为0.3 mg/mL)]平衡后,将鳙鱼脑内含GABA受体蛋白粗提液加入柱中孵育15 min;使用缓冲溶液B[pH=7.5,含0.02 mmol K3PO4、蔗糖(质量浓度为11 mg/mL)、2 mmol醋酸镁、Triton X-100(质量浓度为0.3 mg/mL)]进行冲洗,设定流速为40 mL/h,洗出杂蛋白;使用缓冲溶液C[pH=7.5,含0.01 mmol K3PO4、10 mmol氟西泮、蔗糖(质量浓度为11 mg/mL)、2 mmol醋酸镁、Triton X-100(质量浓度为0.3 mg/mL)]洗脱,流速为20 mL/h,洗出目的蛋白。
2 结果与讨论
2.1 亲和层析介质的表征
2.1.1 亲和层析介质化学组成分析
图3为样品的XPS元素全谱扫描分析图谱,其中(a)和(b)分别为琼脂糖CL-6B和偶联氟虫腈后的亲和介质。由(a)中出现C1s、O1s、N1s、S2p,定量分析结果为C 37.74%、O 61.53%、N 0.53%和S 0.19%,可看出C和O为主要组成元素。(b)中元素定量分析的结果为C 37.55%、O 58.33%、N 2.37%、S 0.41%和F 1.33%。比较(a)和(b)可知,(b)中出现了F的峰,且元素含量为1.84%,同时N和S元素的含量大量增加。由以上分析可知,氟虫腈亲和配基已经成功偶联到琼脂糖CL-6B上。
2.1.2 亲和层析介质的红外分析
图4为琼脂糖CL-6B(a)和偶联氟虫腈后的亲和介质(b)的红外分析图谱。比较曲线(a)和(b)可看出,曲线(b)中增加了1650 cm-1处的—CONH—羰基峰、3 400 cm-1处的—NH—峰以及2 230 cm-1处的—CN峰等一系列氟虫腈衍生物的特征峰,这与XPS元素全谱扫描分析一致,均证明氟虫腈亲和配基已成功偶联到琼脂糖CL-6B上。
2.1.3 环氧基修饰密度和亲和氟虫腈配基偶联密度分析
Na2S2O3滴定法测定出琼脂糖凝胶上环氧基平均修饰密度为68.65 μmol/g胶;紫外分光光度法测出氟虫腈亲和配基的偶联密度为36.68 μmol/g胶。
2.2 氟虫腈亲和层析柱对鳙鱼脑内GABA受体的纯化
2.2.1 GABA受体亲和层析
利用氟虫腈亲和层析柱分离纯化鳙鱼脑内含GABA受体蛋白粗提液时(见图5),在1~2 h时间段,表示使用缓冲溶液B洗脱下的大峰为杂蛋白。在2.5~3.5 h时间段,表示使用含氟西泮的缓冲溶液C洗脱下的小峰为GABA受体。
2.2.2 蛋白质分子量分析
图6为GABA受体蛋白粗提液和经氟虫腈亲和柱纯化的受体蛋白的SDS-PAGE图。由条带A可看出粗提蛋白中有很多条带分布,说明粗提物中含有很多杂蛋白;而经氟虫腈亲和柱纯化的受体蛋白只有两个条带,其分子量分别为44 kD和55 kD。Johannes等[18]于1987年发现肺鱼GABA受体其中一个亚基的分子量为47 kD,早期报道中所述的GABA受体各亚基分子量在50 kD左右[19-20],Taguchi等[12]的实验证实了鱼的两个GABA受体亚基,分别是55 kD的β亚基和47 kD的α亚基。综上分析可知,本实验得到的55 kD的条带可能是鳙鱼GABA受体的β亚基,44 kD的条带可能是鳙鱼GABA受体的α亚基。由图6(b)也可看出,在相同上样量的前提下,使用氟虫腈衍生物亲和层介质得到的GABA受体条带比Taguchi实验中所得到的条带更宽,颜色更深,说明氟虫腈对鱼类GABA受体的亲和力较氟硝西泮强,间接说明氟虫腈对鱼类具有较强的毒害性。

图4 琼脂糖CL-6B(a)和偶联氟虫腈后的亲和介质(b)的红外分析图谱
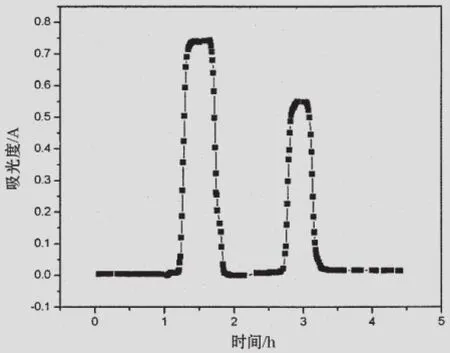
图5 氟虫腈亲和层析柱对鳙鱼脑内GABA受体蛋白的分离纯化
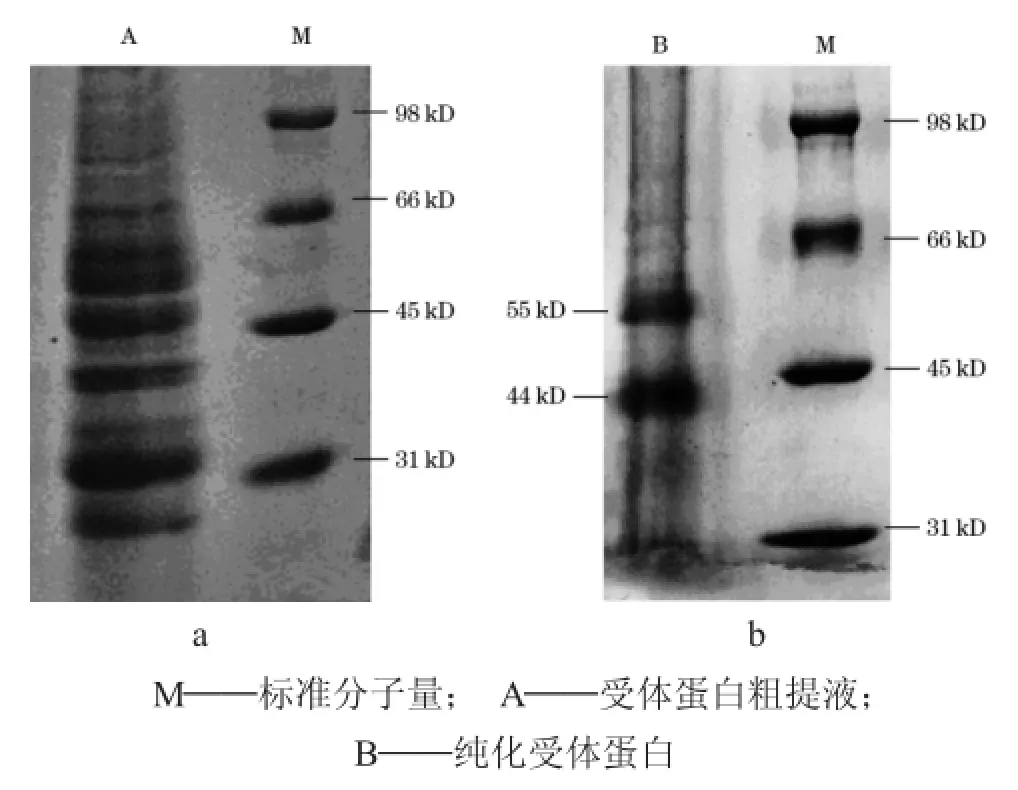
图6 鳙鱼GABA受体蛋白粗提液(a)和经氟虫腈亲和柱纯化的受体蛋白(b)的SDS-PAGE图
2.2.3 氟虫腈亲和柱对鳙鱼GABA受体分离纯化效果评价
氟虫腈亲和层析柱对鳙鱼GABA受体的各步分离纯化效果评价见表1。由表1可知,经过氟虫腈亲和层析这一纯化步骤,蛋白质回收率为3.27%。

表1 鳙鱼脑内GABA受体蛋白的纯化率
3 结论
本实验将氟虫腈偶联到琼脂糖凝胶上,得到了以氟虫腈为配基的亲和层析介质,偶联到琼脂糖凝胶上的氟虫腈密度为36.68 μmol/g胶。首次利用氟虫腈衍生物修饰的亲和层析柱分离纯化得到鳙鱼脑内的GABA受体。其SDS-PAGE图显示两个条带,分子量分别为44 kD和55 kD。利用该亲和层析介质对鳙鱼脑内GABA受体蛋白进行分离纯化是有效的,其蛋白回收率为3.27%。
[1]Klein R L,Harris R A.Regulation ofGABAAreceptor structure and function by chronic drug treatments in vivo and with stably transfected cells[J].Japanese Journal of Pharmacology,1996,70(1):1-15.
[2]张友军,张文吉,韩熹莱.杀虫剂分子靶标:γ-氨基丁酸A型受体[J].昆虫知识,1996(4):244-247.
[3]卢文才,何林,薛传华.昆虫γ-氨基丁酸受体研究现状[J].昆虫知识,2009,46(1):152-158.
[4]Casida J E.Insecticide action at the GABA-gated chloride channel:Recognition,progress,and prospects[J].Archives of Insect Biochemistryand Physiology,1993,22(1-2):13-23.
[5]王兴国,胡沙.突触外GABAA受体的药理学及构效关系研究[J].中外健康文摘,2010,7(23):386-388.
[6]李华,左伋.GABAB受体及其临床意义[J].中国临床神经科学,2001,9(1):96-98.
[7]郝艳丽,巨修练.GABAAR研究进展[J].武汉化工学院学报,2006,28(2):12-16.
[8]Prada C,Udin S B,Wiechmann A F,et al.Stimulation ofmelatonin receptors decreases calcium levels in xenopus tectal cells by activating GABACreceptors[J].Journal of Neurophysiology,2005,94(2):968-978.
[9]Sigel E,Mamalaki C,Eric A B.Isolation ofa GABA receptor from bovine brain using a benzodiazepine affinity column[J]. FEBSLetters,1982,147(1):45-48.
[10]Sawyer G W,Chiara D C,Olsen R W,et al.Identification of the bovine γ-aminobutyric acid type A receptor α subunit residues photolabeled by the imidazobenzodiazepine[3H] Ro15-4513[J].The Journal of Biological Chemistry,2002, 277(51):50036-50045.
[11]Gavish M,Snyder S H.gamma-Aminobutyric acid and benzodiazepine receptors:copurification and characterization[J]. Proceeding of National Academy of Sciences of the United States ofAmerica,1981,78(3):1939-1942.
[12]Taguchi J,Kuriyama K.Purification ofgamma-aminobutyric acid(GABA)receptor from rat brain by affinity column chromatography using a newbenzodiazepine,1012-S,as an immobilized ligand[J].Brain Research,1984,323(2): 219-226.
[13]Martini C,Lucacchini A.Isolation of putative benzodiazepine receptors fromrat brain membranes byaffinitychromatography[J].Journal of Neurochemistry,1982,38(1): 15-19.
[14]JU X L,Sayaka F,Hiroyuki H,et al.Synthesis and structure-activity relationship analysis of bicyclophosphorothionate blockers with selectivity for housefly gamma-aminobutyric acid receptor channels[J].SocietyofChemical Industry, 2010,66(9):1002-1010.
[15]Jiang D X,Lu X L,Hu S,et al.A newderivative of fipronil: Effect of adding a glycinyl group to the 5-amine of pyrazole on phloem mobility and insecticidal activity[J].Pesticide Biochemistryand Physiology,2009,95(3):126-130.
[16]Zheng X H,Jiang D X,Liu Z C,et al.Synthesis,characterization and bioactivity of Fipronil derivatives as a lead for newinsecticide[J].Indian Journal of Chemical Technology, 2010,17(3):215-219.
[17]Sundberg L,Porath J.Preparation of adsorbents for biospecific affinity chromatography:I.Attachment of group-containing ligands to insoluble polymers by means of bifunctional oxiranes[J].Journal of Chromatography,1974,90(1): 87-98.
[18]Johannes H,Waltraut F,Klaus-Ulrich L,et al.P.Qualitative variation of photolabelled benzodiazepine receptiors in different species[J].Neurochemistry International,1986,8 (2):267-271.
[19]周晓梅,黄炳球.γ-氨基丁酸受体及其抑制剂的研究进展[J].世界农药,1999,21(6):17-22.
[20]Gerschenfeld H M.Chemical transmission in invertebrate central nervous systems and neuromuscular junctions[J]. Physiological Reviews,1973,53(1):1-119.
Preparation of Affinity Medium with Fipronil Ligand
and Its Application in Purification of Fish GABA Receptors
Yu Guangjin Zhang Bo Yang Shan Zhang Yuan Ren Tianrui
Prepared the affinity chromatography medium with Sepharose CL-6B as affinity matrix and fipronil derivatives as affinity ligands,and characterized it with FT-IR and XPS.Separated and purified the GABA receptor in fish brain tissues with the affinity chromatography medium and evaluated the separation efficiency of protein.The results showed that the fipronil derivatives were successfully conjugated to the matrix,the conjugation amount was 36.68 μmol on one gram of Sepharose CL-6B.The SDS-PAGE showed two protein bands,the relative molecular weight was 44 kD and 55 kD respectively.
GABA;Receptor;Fipronil;Affinity chromatography
TQ450.1+1
2014年3月
陶氏携领先光热发电流体解决方案亮相2014中国光热发电高峰论坛
国家自然科学基金资助项目(21172147);国家科技支撑基金资助项目(2011BAE0CL-6B06-4);上海市科委基金资助项目(11ZR1426800)
于广金男1987年生高分子化学与物理专业在读硕士研究生
陶氏化学参加2014中国光热发电高峰论坛活动,为中国太阳能产业发展提供持续支持。作为本次峰会的赞助商之一,陶氏化学集中展示了面向光热发电(CSP)行业推出的各类创新型解决方案,其中包括全球领先的DOWTHERMTMA高温导热流体(HTTF),该产品已成功应用于超过35个世界级的大型CSP项目。

