芎䓖汤活血有效部位给药大鼠粪、尿排泄总体规律的HPLC指纹图谱*
周严严,赵睁睁,2,郭小藤,容蓉,吕青涛,巩丽丽,杨勇
(1.山东中医药大学药学院,济南 250355; 2.寿光市中医医院,山东潍坊 262700)
中药复方芎䓖汤出自《千金方》[1],由当归和川芎等组成,具有养荣活血的功效[2],主治妊娠伤胎、包衣不下、难产等证。当归、川芎合用为临床常用补血活血药对[3]。当归和川芎存在共同的有效成分,如藁本内酯、阿魏酸等。此外当归中还有当归多糖、挥发油、氨基酸、微量元素等[4–5];川芎中还有生物碱、川芎嗪、酚类物质、有机酸、苯酞内酯及其它成分[6]。由于中药及复方成分的复杂性,中药复方代谢规律的研究一直是个难点。目前的探究主要是针对其中一种或几种活性成分,研究其在体内的药代动力学及代谢规律。中药复方的药效作用是多成分协同作用的结果,故对芎䓖汤活血有效部位排泄规律的研究,亦应针对多成分考察其总体排泄趋势。指纹图谱技术能较全面地反映中药整体化学特征[7],测定给药动物排泄物的HPLC指纹图谱,将有助于掌握中药多成分的排泄信息。欧氏距离对于化学指纹图谱相似性具有较好的综合评价能力[8]。前期研究发现,芎䓖汤大孔树脂分离制备的40%乙醇洗脱部位(40% Ethanol Elution Part,简称EE40部位)中有效成分阿魏酸含量高[9],该部位可增强红细胞膜的流动性,改善急性期缺血的能量代谢障碍的状态,防止心肌的进一步坏死,是芎䓖汤主要活血有效部位[10]。笔者采用HPLC指纹图谱技术,测定芎䓖汤活血有效部位(EE40部位)给药前后大鼠尿样、粪样多成分的总体变化趋势,以期阐明芎䓖汤活血有效部位在大鼠体内的总体排泄规律。
1 实验部分
1.1 主要仪器与试剂
高效液相色谱仪:Agilent 1200型,附DAD检测器,四元低压梯度泵,柱温箱,美国安捷伦公司;
数控超声波清洗器:KQ–5200DB型,江苏省昆山市超声仪器有限公司;
CO2超临界萃取仪:Spe-ed SFE型,美国ASI公司;
电子分析天平:(1)FA1004B型,感量为0.1 mg,上海越平科学仪器有限公司;(2)AF240型,感量为0.1 mg,瑞士梅特勒公司;
旋转蒸发器:RE–52C型,上海亚荣生化仪器厂;
电动植物粉碎机:DWF–100型,河北省黄骅市科研机械厂;
匀浆器:SZ–1型,江苏金坛市国胜仪器厂;
当归、川芎饮片:批号分别为20100821,20100911,济南建联药店;
大孔吸附树脂:D101型,沧州宝恩吸附材料科技有限公司;
阿魏酸对照品:批号为0773–9910,中国药品生物制品检定所;
藁本内酯、洋川芎内酯A、正丁基苯酞对照品:批号分别为110773–200912,110773–201002,110773–201010,成都瑞芬思生物科技有限公司;
甲醇、乙腈:色谱纯,天津市科密欧化学试剂有限公司;
实验用水为市售纯净水;
实验所用其它试剂均为分析纯。
1.2 实验动物
SD大鼠:雄性,体重280~300 g,许可证号为SYXK(鲁)2011–0002,山东中医药大学实验动物中心。
1.3 实验方法
1.3.1 芎䓖汤活血有效部位灌胃溶液的制备
将当归、川芎药材粉碎,过0.85 mm(20目)筛,分别取250 g,混合,加12倍量70%乙醇回流提取3次,每次1.5 h,合并提取液,回收乙醇,浓缩至1 L,制得芎䓖汤醇提液(每毫升溶液相当于0.5 g生药材)。取醇提液,以1∶3(药材质量与树脂体积比)的比例过D101大孔树脂柱,分别用10倍量的水,20%,40%,60%,95%乙醇依次洗脱,收集不同浓度的乙醇洗脱液,减压回收乙醇,分别浓缩至500 mL(每毫升样品溶液相当于1 g生药材)。前期研究发现芎䓖汤活血有效部位主要集中在40%乙醇洗脱部分。取40%乙醇洗脱部分水浴低温浓缩至近干,加少许吐温80,用水溶解,超声使之分散均匀,定容至100 mL,得芎䓖汤活血有效部位灌胃药液[8](相当于原药材5 g/mL)。
1.3.2 色谱条件
色 谱 柱:ZORBAX SB–C18柱(250 mm×4.6 mm,5 μm);流动相:乙腈–0.5%乙酸混合液,流量为1.0 mL/min;进样体积:20 μL;柱温:35℃;检测波长:292 nm;参比波长:360 nm。
流动相梯度洗脱步骤见表1。
1.4 大鼠尿、粪样品采集与处理
1.4.1 灌胃给药
将SD大鼠12只置于代谢笼中,收集空白尿样和空白粪样;实验前禁食(不禁水)12 h,取芎䓖汤活血有效部位灌胃药液,以40 g/kg的剂量灌胃给药,收集给药后0~4 h,4~8 h,8~12 h,12~24 h,24~36 h,36~48 h,48~60 h,60~72 h,72~84 h,84~96 h各时间段的尿样和粪样。尿样记录体积,粪样称重,于–20℃冷冻保存。
1.4.2 尿样处理
取尿样400 μL,甲醇200 μL,乙睛1 mL,涡流30 s,以4 000 r/min转速离心10 min,取上清液1 mL,浓缩至干,加甲醇100 μL,溶解,以10 000 r/min转速高速离心,取上清液。
1.4.3 粪样处理
取粪样0.5 g (湿重,总质量不足0.5 g的则全取)于试管中,加入甲醇(粪样重量–甲醇体积之比为1∶4)后匀浆,超声、离心(转速为4 000 r/min)各10 min,取上清液400 μL,加入甲醇200 μL,乙腈1 mL,涡旋30 s,离心(转速为4 000 r/min)10 min,取上清液1 mL,浓缩至干,加甲醇100 μL溶解,以10 000 r/min高速离心,取上清液即得。
1.5 实验步骤
提取给药后尿、粪样品的HPLC指纹图谱中峰面积有明显变化的色谱峰和新增的色谱峰作为特征峰,以特征峰面积为指标,计算不同时间段收集的尿样、粪样给药前后HPLC指纹图谱的欧氏距离,考察给药前后不同时间段尿样、粪样的相似性。
2 结果与讨论
2.1 稳定性及精密度试验
取给药后12~24 h时间段采集的尿样,按照1.4.2方法处理后,在1.3.2色谱条件下进样测定,每隔2 h进样一次,10 h内连续进样5次,考察精密度和样品10 h内的稳定性。选择9个特征指纹峰进行考察,以5号峰为参比峰,各特征峰相对保留时间和特征峰面积为指标进行考察,结果见表2。由表2相关数据得知,特征峰的相对保留时间和峰面积相对标准偏差均小于1%,表明HPLC指纹图谱测定精密度良好,样品在10 h内稳定。
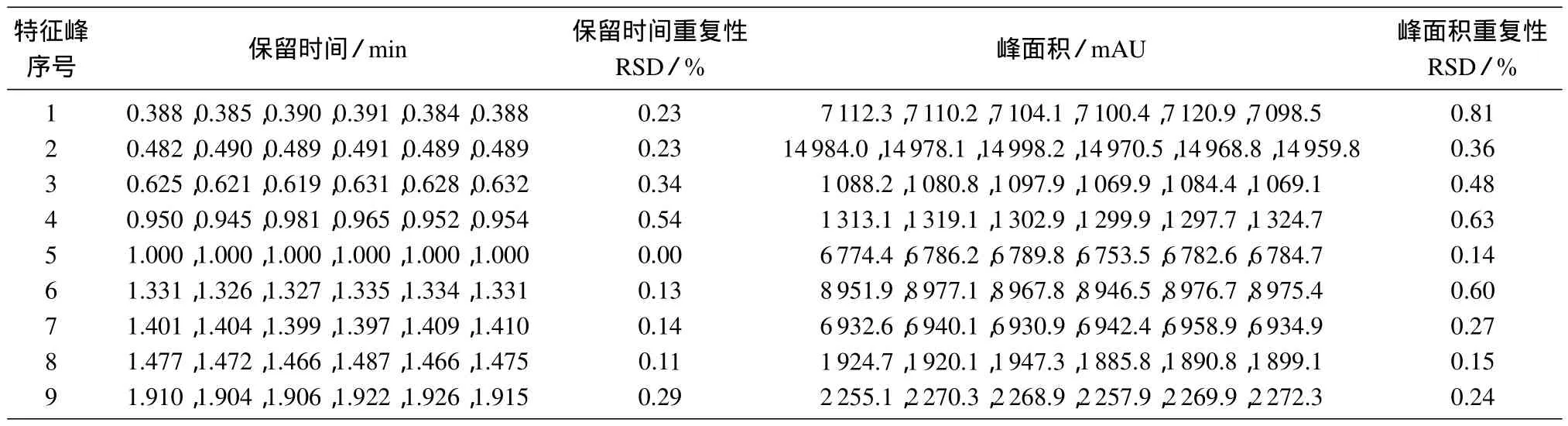
表2 EE40部位给药尿液指纹图谱特征峰稳定性及精密度试验数据
2.2 大鼠尿样HPLC指纹图谱
比较EE40部位给药前后不同时间段的大鼠尿样HPLC指纹图谱差异,将按照1.4.2处理所得尿样在1.3.2色谱条件下测定,色谱图见图1、图2。

图1 EE40部位给药前大鼠尿样HPLC指纹图谱

图2 EE40部位给药后大鼠尿样HPLC指纹图谱
2.3 大鼠粪样HPLC指纹图谱
比较EE40部位给药前后不同时间段的大鼠粪样HPLC指纹图谱差异,将1.4.3处理的粪样样品按1.3.2色谱条件进行测定,色谱图分别见图3、图4。
2.4 HPLC指纹图谱数据
EE40部位给药后尿样和粪样HPLC特征峰面积数据见表3、表4。

图3 EE40部位给药前大鼠粪样HPLC指纹图谱

图4 EE40部位给药后大鼠粪样HPLC指纹图谱
2.5 HPLC指纹图谱数据处理结果
聚类分析是用多元统计技术进行分类的一种方法。目前多维空间里的两样本距离的计算方法主要有欧氏距离、马氏距离、闵氏距离等,其中以欧氏距离最常用。对n个含m个指标的样本,可定义为m维空间的点,在m维空间中的任意两点,其相似性可用“距离”度量,定义为“dij”,若将任一样本看作一类,其类间相似性可用欧氏距离DE表示[11]。将给药后不同时间段采集的样品作为i样本、给药前样品作为j样本,以HPLC特征峰面积为指标,计算不同时间段收集的尿样、粪样给药前后HPLC指纹图谱的欧氏距离DE,以欧氏距离DE表征各样本指纹图谱间的相似性,考察样本中多成分的总体变化趋势。

表3 EE40部位给药后尿样的HPLC特征峰面积(n=6) mAU

表4 EE40部位给药后粪样的HPLC特征峰面积(n=6) mAU

式中:l—样本指标数,即特征峰个数l=1,2,3…m;
i,j——样本序号,即不同时间段采集的样本;
xil,xjl——样本各指标,即特征峰面积。
以DE为纵坐标、给药后的取样时间为横坐标绘图,DE数据见表5,尿样、粪样DE与取样时间关系分别见图5、图6。
由图5和图6可知,大鼠EE40部位给药后尿样在8~12 h内有显著变化,表明总体成分的肾脏排泄在此时间段达到高峰,60 h后排泄量很少,96 h基本排泄完全;粪样在12~24 h内有显著变化,证明总体成分的肠道排泄在此时间段达到高峰,72 h后排泄量很少,84 h基本排泄完全。该研究为临床制定更为合理的用药方案提供依据。

表5 EE40部位给药前后大鼠尿样、粪样的欧氏距离DE

图5 EE40部位给药后尿样HPLC指纹图谱特征峰欧氏距离变化曲线

图6 EE40部位给药后粪样HPLC指纹图谱特征峰欧氏距离变化曲线
3 结语
采用欧氏距离综合反映不同时间段给药动物尿样、粪样HPLC指纹图谱多个特征峰的整体变化,更加符合中药整体作用的特点;以色谱峰保留时间和峰面积为指标,通过与给药前空白尿、粪样品指纹图谱比较,发现给药后尿、粪样品的HPLC指纹图谱的色谱峰,部分与给药前样品相同,属内源性成分;部分为新增加的色谱峰,可能来自芎䓖汤活血药效部位的原成分及其代谢产物。这些成分的归属和结构确定有待于进一步研究。
[1] 王本祥.现代中药药理学[M].天津:天津科学技术出版社,1997.
[2] 王欢,唐于平,丁安伟.当归–川芎药对不同配比的中医应用数据分析[J].中国实验方剂学杂志,2009,15(11): 44–47.
[3] 黄美艳,尚尔鑫,唐于平,等.基于药物相互作用对当归-川芎配伍养血补血效应研究[J].中国中西医结合杂志,2013,33(4): 516–521.
[4] 陈慧珍.当归的研究进展[J].海峡药学.2008,20(8): 83–85.
[5] 李曦,张丽宏,王晓晓,等.当归化学成分及药理作用研究进展[J].中草药,2013,36(6): 1 023–1 028.
[6] 金玉青,洪远林,李建蕊,等.川芎的化学成分及药理作用研究进展[J].中药与临床,2013,4(3): 44–48.
[7] 孙国祥,毕开顺.中药指纹图谱学体系在中药创制中的作用[J].色谱,2008,26(2): 172–179.
[8] 程翼宇,陈闽军,吴永江.化学指纹图谱的相似性测度及其评价方法[J].化学学报,2002,60(11): 2 017–2 021.
[9] 赵睁睁,郭小藤,容蓉,等.芎䓖汤不同部位阿魏酸含量测定[J].食品与药品,2012,14(9): 334–336.
[10] 容蓉,杨勇,陈明强,等.芎䓖汤大孔树脂柱洗脱物对心肌缺血小鼠红细胞膜流动性的研究[J].时珍国医国药,2009,20(10): 2 435–2 437.
[11] 鲍明,管鲁阳,李晓东,等.基于欧氏距离分布熵的特征优化研究[J].电子商报,2007,25(3): 469–473.

