评析一道2014年广东高考化学试题
王文婷 衷明华
(韩山师范学院化学系,广东 潮州 521041)
题目:(2014广东高考化学,17分)H2O2是一种绿色氧化还原试剂,在化学研究中应用广泛。
(1)某小组拟在同浓度Fe3+的催化下,探究H2O2浓度对H2O2分解反应速率的影响。限选试剂与仪器:30% H2O2、0.1mol·L-1Fe2(SO4)3、蒸馏水、锥形瓶、双孔塞、水槽、胶管、玻璃导管、量筒、秒表、恒温水浴槽、注射器。
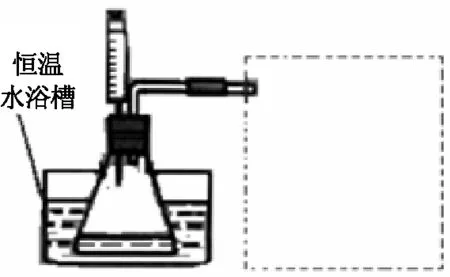
图1 实验装置
①写出本实验H2O2分解反应方程式,并标明电子
转移的方向和数目:____。
②设计实验方案:在不同H2O2浓度下,测定____。
(要求所测得的数据能直接体现反应速率大小)。
③设计实验装置,完成图1的装置示意图。
④参照下表格式,拟定实验表格,完整体现实验方案(列出所选试剂体积、需记录的待测物理量和所拟定的数据;数据用字母表示)。

物理量实验序号 V[0.1mol·L-1Fe2(SO4)3/mL]……1a……2a……
(2)利用图2(a)和2(b)中的信息,按图2(c)装置(连能的A、B瓶中已充有NO2气体)进行实验。可观察到B瓶中气体颜色比A瓶中的____(填“深”或“浅”),其原因是____。

图2 反应过程
1 命题意图分析
考查化学反应方程式的书写以及氧化还原反应中电子的转移表示方法(双线桥法)。源于教材,考查学生对化学反应速率的测定和灵活理解、化学实验设计(控制变量法)和热化学(吸热放热反应)、平衡移动原理以及绘图能力。
H2O2的分解实验源于化学必修2第二章第三节《化学反应的速率和限度》内容,教材中给出两个影响H2O2的分解速率的探究实验,“思考与交流”更进一步启发学生理解影响化学反应速率的因素。
2 试题解析
(1)①先写出H2O2在Fe3+的催化下分解的化学方程式,在根据电子得出情况用双线桥法标出。

②收集相同体积的氧气所需时间或者相同时间所收集氧气的体积。

④解法一:(不同浓度的H2O2分解在相同时间内产出的气体体积)。
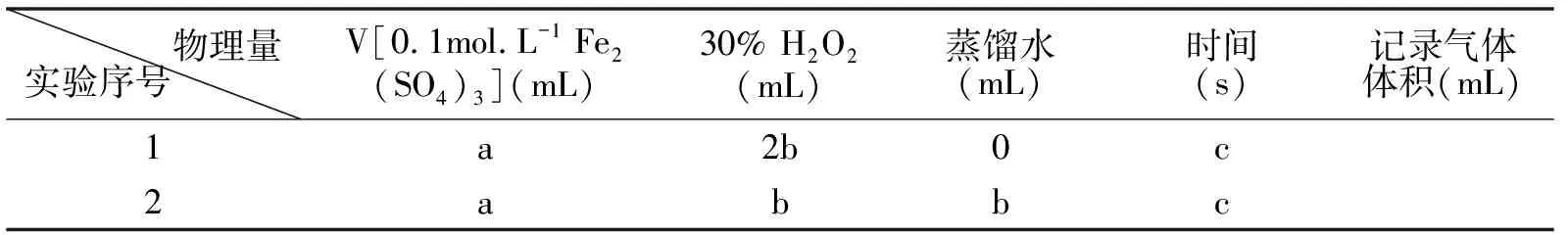
物理量实验序号 V[0.1mol.L-1 Fe2(SO4)3](mL)30% H2O2(mL)蒸馏水(mL)时间(s)记录气体体积(mL)1a2b0c2abbc
解法二:(不同浓度的H2O2分解产生的相同气体的体积)

物理量实验序号 V[0.1mol.L-1 Fe2(SO4)3](mL)30% H2O2(mL)蒸馏水(mL)时间(s)记录气体体积(mL)1a2b0d2abbd
(合理即可)
(2)深。原因是2NO2(红棕色)N2O4(无色),△H<0是放热反应,且双氧水的分解反应也是放热反应。当右边双氧水分解时放出的热量会使B瓶升温,使瓶中反应朝逆反应方向移动,即向生成NO2移动,故B瓶颜色更深。
3 教学启示
这道实验探究题考及考生薄弱能力——主观表述和实验设计能力。与以往实验探究题比较,今年实验探究题目对考生化学理论的学习能力和实验设计能力的要求有所提升。因此要求学生重视基础,回归教材,对教材的知识点要求理解透彻。在教学过程中,多加提问有针对性地训练学生的语言表达能力。此外,课本演示实验和有关的分组实验部分尽可能地让学生自主探究,尤其不能忽视新教改后的“思考与交流”部分实验设计能力。
[1]刘孝元.2013年全国新课标理综卷I化学试题“稳”“变”“新”[J].中学化学教学参考,2013,(7):54-56.

