烟台黑猪SLA-I重链基因末端生物素修饰及表达
烟台黑猪SLA-I重链基因末端生物素修饰及表达
刘筏 杨金刚 翟晓鑫 董宋鹏 高凤山
(大连大学生命科学与技术学院,大连 116622)
为构建烟台黑猪SLA-2重链基因偶合生物素化酶BirA底物肽(BirA substrate peptide,BSP)并研究其在pET-28a(+)中的表达,设计烟台黑猪SLA-2-BSP复合基因引物,PCR扩增烟台黑猪SLA-2-YTH-BSP复合基因,并克隆至pMD 19-T Simple Vectorp,经酶切鉴定后将SLA-2-YTH-BSP复合基因与表达系统pET-28a(+)链接,并转化到BL21(Rosseta)菌进行诱导表达,SDS-PAGE检测目的蛋白。表达蛋白经过Ni-NTA亲和纯化,并经SDS-PAGE检测蛋白纯化效果。PCR结果显示SLA-2-BSP大小为900 bp,并成功克隆到pMD 19-T Simple Vector,酶切鉴定大小为876 bp,该基因链接到 pET-28a(+)并转化到BL21(Rosseta)菌,经诱导表达和SDS-PAGE检测目的蛋白的大小为32.4 kD。目的蛋白以包涵体形式存在,纯化后蛋白纯度达到90%以上。成功构建烟台黑猪SLA-I重链偶合生物素化酶BirA底物肽(BSP)的pET-28a(+)的重组表达系,为下一步的SLA-I类分子四聚体研究鉴定基础。
烟台黑猪 SLA-2 重链基因 生物素化酶BirA底物肽 纯化
四聚体技术是目前国内外研究的热点,其核心技术就是在主要组织相容性复合体(Major histocompatibility complex,MHC)I类分子重链末端进行生物素修饰,以结合亲和素构建四聚体检测病毒CTL(cytotoxic T lymphocyte)表位,从而放大MHC I-peptide的检测信号,有利于精确检测病毒的CTL表位[1]。目前,国内外分别构建了人[2]、鼠[3]、鸡[4]等MHC I类分子四聚体,并筛选或证实了多种病毒
CTL表位。然而,目前关于猪MHC I四聚体链构建鲜有报道。猪的MHC I类分子也称为猪白细胞抗原(Swine leukocyte antigen,SLA)I类分子。课题组最近报道了我国荷包猪SLA-I末端生物素化的研究,并在pET-21成功进行了表达,从而开始了我国地方品系猪SLA-I重链生物素修饰及表达的研究[5]。由于我国有丰富的地方品系猪资源,有必要开展其他地方品系猪SLA-I的相关研究。烟台黑猪是我国山东省烟台地区的优质地方品系猪[6],其重链SLA-I基因已经克隆,并具有特征性[7]。本研究拟在前期研究的基础上,以国内品系烟台黑猪SLA-I类分子SLA-2功能基因为研究对象,采用分子克隆和基因工程手段在体外构建我国地方品系猪SLA-2偶合生物素化酶BirA底物肽的重组表达系,并在原核表达系统pET-28a(+)进行表达和纯化,为下一步构建SLA-I/肽复合物奠定基础。
1 材料与方法
1.1 材料
重组质粒SLA-2-YTH01/ pMD 18-T为大连大学分子免疫学实验室构建保存,克隆载体 pMD 19-T Simple Vector,表达载体pET-28a(+)及菌株Escherichia coli.BL21(Rosseta)来自于中国科学院微生物研究所;Escherichia coliTop10菌株为大连大学分子免疫学实验室保存。
低分子量蛋白Marker、DL2000 DNA Marker、NdeI、XhoI和DNA纯化试剂盒购于大连宝生物公司;IPTG、胰化蛋白胨、甘氨酸酵母提取物、丙烯酰胺氨苄青霉素、过硫酸胺、二甲基甲叉双丙烯酰胺、TEMED、三羟甲基氨基甲烷等购自上海生工。
1.2 方法
1.2.1 引物的设计 烟台黑猪SLA-I重链分子SLA-2四聚体链表达引物设计PS-21F:5'-GGAATTCCATA TGGGCCCGCATTCCCTGAGCTATTTC-3'(下划线部分为NdeI酶切位点);P21BSPR:5'-AGTCTCGAGTTAACGATGATTCCACACCATTTTCTGTGCATCCAGAATAT GATGCAGGCTGCCGTCCCATCTCAGGGTGAGGGGC-3'(下划线部分为XhoI酶切位点,斜体部分为BSP序列)。
1.2.2 SLA-2-YTH-BSP 亚克隆 以重组质粒为模板,以PS-21F/P21BSPR为引物对,扩增基因链SLA-2-YTH-BSP,PCR条件为94℃,5 min;94℃,30 s;56℃,45 s;72℃,90 s;30个循环,72℃延伸10 min,PCR结束后进行核酸电泳,琼脂糖凝胶浓度为1.0 %,电泳结束后在凝胶成像仪下检查PCR扩增产物,然后用DNA胶回收试剂盒回收目的片段。
回收之后SLA-2-YTH-BSP 产物连接 pMD19-T Simple并转化大肠杆菌Top10,37℃过夜培养。按照碱裂解法提质粒,酶切筛选阳性克隆并保存菌种,阳性克隆送到生物公司进行测序。
1.2.3 表达载体的构建 将筛选的阳性克隆提质粒,经NdeI、XhoI双酶切,凝胶纯化回收SLA-2-YTHBSP 基因 。将 SLA-2-BSP 与 pET-28a连接,转化至感受态细胞BL21(Rosseta),涂布到含有卡那霉素的平板中,在37℃培养箱中过夜培养,挑选菌落接种至LB培养基(含卡那),从培养的菌液中提取质粒,经NdeI、XhoI双酶切筛选阳性质粒,阳性质粒命名为pET-28a(+)/SLA-2-YTH-BSP,见图1,并送生物公司测序。

图1 构建pET-28a(+)/SLA-2-YTH-BSP重组质粒
1.2.4 SDS-PAGE检测SLA-2-YTH-BSP蛋白表达将阳性重组菌 100 μL接种5 mL LB液体培养基,37℃、170 r/min振荡培养直至OD600在0.4-0.6之
间。加入1 mol / L IPTG 5 μL,诱导5 h后,取菌液1 mL,12 000 r/min,2 min,去上清,菌体经TE溶解并经5×SDS样品buffer处理,SDS-PAGE测蛋白表达[8]。
1.2.5 SLA-2-YTH-BSP 蛋白纯化 SLA-2-YTH-BSP表达蛋白按照文献报道进行[9]。表达后的SLA-2-YTH-BSP重组菌(Rosseta)按 1%比例接种后扩大培养,IPTG 诱导重组蛋白表达,5 000 r/min,4℃离心收集细胞并洗涤后,冰浴超声裂解细胞,高速离心后分别取上清和沉淀进行 SDS-PAGE,检测重组蛋白表达形式。收集包涵体并用 1% Triton X-100洗涤后,用 8 mol/L 尿素溶解,离心收集上清液,透析过夜后,进行 Ni-NTA 亲和层析,用 60 mmol/L 咪唑充分洗去杂蛋白后,用 0.3 mol/L 咪唑洗脱目标融合蛋白,SDS-PAGE检测纯化蛋白。
2 结果
2.1 SLA-2-YTP-BSP链的PCR扩增
经PCR扩增和琼脂糖凝胶电泳检测到一条约900 bp的条带,与理论设计值898 bp大小相符,见图2。

图2 SLA-2-YTH-BSP的PCR扩增结果
2.2 SLA-2-YTP-BSP链亚克隆到pMD-19-T Simple Vector
经连接转化后,挑取单菌落培养,用NdeI、XhoI双酶切,电泳显示插入片段约900 bp,与目的片段876 bp相符合,见图3。
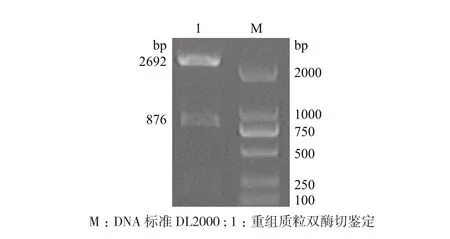
图3 pMD-19-T Simple Vector/SLA-2-YTP-BSP重组质粒双酶切鉴定
2.3 SLA-2-YTP-BSP链亚克隆到pET-28a(+)
将与pMD 19-T Simple载体链接的重组质粒经双酶切,回收后与 pET-28a(+)连接,转化至感受态细胞BL21(Rosseta),经双酶切鉴定发现插入片段大小为870 bp左右,与理论值876 bp相符,见图4。

图4 重组质粒pET-28a(+)/SLA-2-YTH-BSP双酶切鉴定
2.4 序列分析pET-28(+)/SLA-2-YTH-BSP
经序列测定分析,pET-28(+)/SLA-2-YTH-BSP与原序列100%同源,另外,序列末端含有BSP序列部分,见图5。
2.5 SDS-PAGE分析pET-28(+)/SLA-2-YTH-BSP中的表达
将经鉴定阳性的重组表达菌加入IPTG至1 mmol/L,然后再诱导培养5 h,SDS-PAGE检测目的基因的表达情况,结果发现重组菌诱导后,与对照相比表达出约30 kD的条带,与理论值32.4 kD相符,而且相对表达含量达到40%以上,见图6。
2.5 SLA-2-YTH-BSP蛋白纯化
SLA-2-YTH-BSP超声裂解后,检测主要以包涵体形式存在,包涵体经过 Ni-NTA柱纯化,SDSPAGE检测,结果(图7)显示纯化后的蛋白大小约为30 kD,与全菌表达蛋白大小一致。另外,蛋白的纯度达到90%以上,符合进行下一步蛋白结构和功能研究的要求。
3 讨论
本项目前期研究中,已经成功克隆了烟台黑
猪SLA-I类分子功能基因SLA-2,并已经在DDBJ/ EMBL/GenBank注册,获得序列号AB672508,为进行本研究奠定了基础[6]。经分析,所克隆烟台黑猪SLA-2共1 119 bp,其中75-896位属于胞外区,编码274个氨基酸残基(本研究为了提高SLA-2胞外区结合多肽的延展性,实际表达了275个氨基酸)。SLA-2抗原多肽结合区结合抗原多肽后在细胞表面与CD8+T淋巴细胞的T细胞受体(T cell receptor,TCR)结合,形成MHC I-peptide-TCR复合物。为了增加在体外检测的信号,需要借助生物素-亲和素结合原理构建MHC I四聚体[10]。为此,需要在SLA-2胞外区末端加含有17个氨基酸的生物素化酶BirA底物肽(BirA substrate peptide)[11],以结合生物素,而一分子亲和素能结合4分子的生物素,从而形成SLA I-peptide四聚体。四聚体主要用于检测
SLA I限制性的抗原多肽或TCR。需要指出的是,本研究中PCR扩增SLA-2-YTH-BSP的序列长度为898 bp,是包含了酶切位点和末端的保护性碱基,而酶切后插入片段的长度为876 bp。尽管PCR产物可以直接酶切,与pET-28a(+)连接,但连接的成功率一般不高。为了增加连接的成功率,采用先把插入片段克隆入克隆载体pMD 19-T simple的方法,经大量扩增后,再将酶切回收后的插入片段连接入pET-28a(+),经酶切后,显示插入片段存在,证明连接成功。但图中载体质粒显示有两条DNA带,其中下面的条带应当为未酶切完全的重组质粒,可能是酶量不足或质粒不纯所致,但并不影响主要结果。

图5 SLA-2-YTH-BSP序列

图6 SDS-PAGE分析pET-28(+)/SLA-2-YTH-BSP中的表达

图7 SLA-2-YTH-BSP蛋白纯化
本研究中采用pET-28a(+)载体,是由于尝试了其他表达载体后,发现pET-28a(+)更适合SLA-2-YTH-BSP的表达。前期研究中曾报道了我国另一地方品系猪荷包猪重链基因偶合底物肽及表达研究,其中用到了另一表达载体pET-21a(+)[5],二者具有相同的酶切位点NdeI和XhoI,不同的是pET-21a表达的外源基因不携带任何非相关序列,而pET-28a(+)表达的外源基因会在5'端携带6个His的标签,从而便于亲和纯化。本研究中经过SLA-2-YTH-BSP与pET-28a(+)重组后转化Escherichia coli.BL21(Rosseta),经诱导表达后表达蛋白大小为32 kD,与之前报道的大小一致[5]。另外,重组表达质粒不仅经过酶切鉴定,也经过了测序,序列分析结果表明插入序列与设计的SLA-2-YTH-BSP完全一致。目的蛋白的相对表达含量达到了40%以上,可以用于今后四聚体构建等需要大量表达蛋白的相关研究。另外,由于pET-28a(+)载体多克隆位点上游带有His标签,因此可以利用Ni-NTA进行亲和纯化。本研究中,重组蛋白SLA-2-YTH-BSP主要以包涵体形式存在,说明表达蛋白主要存在于细胞质内。收集包涵体蛋白,经过Ni-NTA亲和纯化,蛋白纯度达到了90%以上,可以用于今后进一步的蛋白结构和功能的研究。
4 结论
构建了烟台黑猪SLA-I重链基因末端生物素修饰的重组表达载体,并获得表达蛋白,为进一步构建SLA-I-肽复合物,并展开四聚体研究奠定基础。
[1] Lemke CD, Graham JB, Lubaroff DM, et al. Development of an MHC class I L(d)-restricted PSA peptide-loaded tetramer for detection of PSA-specific CD8+ T cells in the mouse[J]. Prostate Cancer Prostatic Dis, 2011, 14(2):118-121.
[2] Jiang X, Lu X, Liu R, et al. HLA Tetramer based artificial antigenpresenting cells efficiently stimulate CTLs specific for malignant glioma[J]. Clin Cancer Res, 2007, 13(24):7329-7334.
[3] Savage P, Millrain M, Dimakou S, et al. Expansion of CD8+ cytotoxic T cells in vitro and in vivo using MHC class I tetramers[J]. Tumour Biol, 2007, 28(2):70-76.
[4] Liu G, Wang Q, Tong T, et al. Construction and functional test of a chicken MHC-I(BF2*15)/peptide tetramer[J]. Vet Immunol Immunopathol, 2008, 122(1-2):1-7.
[5] 张香春, 冯磊, 张鑫, 等. 荷包猪SLA重链基因偶合底物肽及表达研究[J]. 生物技术, 2012, 22(5):17-20.
[6] 许刚璞, 许瑜伟. 烟台黑猪的调查报告[J]. 中国畜禽种业2011(6):61-62.
[7] 白婧, 李云岗, 张强, 等. 六品系猪SLA-2多肽结合区分子结构差异研究[J]. 宁夏大学学报, 2012, 33(3):274-278.
[8] 高凤山, 夏春, 张强, 等. 大肠杆菌表达的重组猪β2微球蛋白二级结构的圆二色谱分析[J]. 微生物学报, 2009, 49(12):1596-1600.
[9] 郑秋实, 段晨曦, 陶凤云. SMAP-29 抗菌肽的原核表达、纯化及活性检测[J]. 生物技术通报, 2013(3):144-148.
[10] Yokouchi H, Chamoto K, Wakita D, et al. Tetramer-blocking assay for defining antigen-specific cytotoxic T lymphocytes using peptide-MHC tetramer[J]. Cancer Sci, 2006, 97(2):148-154.
[11] Ouyang D, Wang X, He X, et al. Construction of soluble Mamub*1703, a class I major histocompatibility complex of Chinese rhesus macaques, monomer and tetramer loaded with a simian immunodeficiency virus peptide[J]. Cell Mol Immunol, 2009, 6(2):117-122.
(责任编辑 李楠)
Biotinylated the Carboxyl Terminal of Heavy Chain of SLA-I from Yantai Black Pig and Its Expression
Liu Fa Yang Jingang Zhai Xiaoxin Dong Songpeng Gao Fengshan
(College of Life Science and Technology,Dalian University,Dalian 116622)
To construct the heavy chain of SLA-2 conjugated with the BirA substrate peptide(BSP)and express the recombinant genes in pET-28a(+)for Yantai Black Pig(YTH), a pair of primers to express the recombinant SLA-2-YTH-BSP was designed and the recombinant SLA-2-YTH-BSP was amplified by PCR followed by sub-cloning the gene into pMD19-T Simple Vector. After identification by cleavage with Nde I and Xho I, the SLA-2-YTH-BSP was ligated to pET-28a(+)and the recombinant plasmids was transformed into BL21(Rosseta)to be induced to express followed by analysis of the expressing products by SDS-PAGE. The expressed interest of protein was purified by Ni-NTA column and detected by SDS-PAGE. The PCR results showed that the length of nucleotides of SLA-2-YTH-BSP was about 900 bp which was consistent with the calculated value. Then, the SLA-2-YTH-BSP with 876 bp was successfully inserted into the pMD-19-T Simple Vector identified by cleavage with Nde I and Xho I, and then the genes were inserted into pET-28a(+)and transformed into Escherichia coli BL21(Rosseta). After induction, SLA-2-YTH-BSP was successfully expressed with the interest of protein about 32.4 kD. After purification, the purity of the interest of the inclusion protein reached to 90%. It was concluded that the recombinant expressing system containing SLA-2 conjugated with BSP in pET-28a(+)was successfully constructed and the research would pave the base to construct tetramer in SLA class I.
Yantai black pig SLA-2 Heavy chain gene BirA substrate peptide Purification
2013-09-11
国家自然科学基金项目(31172304),辽宁省大学生创新项目(201311258009),大连大学本科生创新项目(2012029)
刘筏,女,研究方向:动物分子免疫学;E-mail:729652171@qq.com
高凤山,男,副教授,博士,研究方向:基因工程和动物分子免疫学;E-mail:gfsh0626@126.com

