三种霉菌产纤维素酶能力分析与培养条件优化
三种霉菌产纤维素酶能力分析与培养条件优化
胡翠英 李良智 赵建 钱玮 顾华杰
(苏州科技学院 化学生物与材料工程学院,苏州 215009)
对实验室现有3种真菌产纤维素酶能力的分析及培养条件优化。比较了3种菌在刚果红培养基上的透明圈大小、并分析产纤维素酶酶活;通过单因素与响应面分析的方法优化毛酶产纤维素酶的培养条件。通过试验得出3种真菌均能产纤维素酶,毛霉能产较多的纤维素酶。毛霉产纤维素酶的最佳条件为:pH 5.0,转速 220 r/min,发酵时间47 h,发酵温度 35 ℃,纤维素酶活为6.99 U/mL。毛霉、青霉、曲霉均产纤维素酶,毛霉能降解玉米芯纤维素。
霉菌 纤维素酶 培养条件 优化
节约粮食和提高农副产品的利用率,减少农业废弃物燃烧带来的环境污染问题,已经引起众多人的关注,将农业废弃物转为可利用能源成为大家研究的课题。我国北方每年都有大量玉米芯被焚烧,如能加以利用,将节约原料成本,故降解此物成为本研究的目的。但一方面由于半纤维素与木质素等组成的致密结构,另一方面纤维素本身不能为丙酮丁醇梭菌直接利用,故需先进行一连串的预处理、酶解等[1-3],将纤维素降解为葡萄糖、木糖等单糖。纤维素酶的提取过程[4,5]较繁琐,酶损失较大,成本较高,如能直接利用纤维素酶产生菌降解纤维素为单糖,可省去酶的提取、纯化的过程,减少酶活力损失、节约成本。其降解物直接作为产能源菌的碳源,形成两菌共培养的情形。目前纤维素降解菌研究[6-9]中多为真菌,且大多为青霉、曲霉、木霉等。本文的主要研究内容为从实验室现有霉菌中寻找纤维素降解菌,比较纤维素酶活,优化培养条件,为进行共培养提供参考。
1 材料与方法
1.1 材料
1.1.1 菌种 青霉、毛霉、曲霉,来自本实验室。玉米芯:来自山西农村,往年搁置1年,风干粉碎过40目筛子备用。
1.1.2 主要仪器 纤维素酶活测定采用723PC型分
光光度计(上海欣茂),发酵溶剂分析用气相色谱仪GC112A型(上海精科),FID检测器,PEG毛细管柱。
1.1.3 试剂与培养基 柠檬酸、柠檬酸钠、CMC-Na、纤维素酶、3,5-二硝基水杨酸。
菌种培养基:葡萄糖 30 g、NaNO32 g、K2HPO4·3H2O 1 g、 KCl 0.5 g 、MgSO4·7H2O 0.5 g、FeSO4·7H2O 0.01 g,蒸馏水1 000 mL,加热至溶解,121 ℃高压灭菌20 min。
纤维素刚果红琼脂培养基:K2HPO4·3H2O 0.5 g、MgSO4·7H2O 0.25 g、纤维素粉1.88 g、刚果红0.2 g、琼脂15 g、明胶2 g,蒸馏水1 000 mL,加热至溶解,121 ℃高压灭菌20 min。
玉米芯粉刚果红琼脂培养基:将纤维素刚果红琼脂培养基中的纤维素粉换成预处理玉米芯粉。
液体产酶培养基:蛋白胨 3 g、酵母膏0.2 g、(NH4)2SO42 g、KH2PO44 g、CaCl2·7H2O 0.3 g、MgSO4·7H2O 0.3 g、CMC-Na 10 g、蒸馏水1 000 mL中,加热至溶解,121 ℃高压灭菌20 min。
1.2 方法
1.2.1 玉米芯预处理 称取15 g玉米芯粉,加入120 mL蒸馏水,滴加3%的硫酸,调pH 2-3,25℃处理48 h,70℃处理10 h,高温110℃处理0.5 h,过滤,干燥备用。
1.2.2 纤维素酶产生菌鉴定 在菌种培养基上,37℃,200 r/min培养24 h。吸取稀释好的菌液于刚果红鉴定平板上,28℃恒温培养2-3 d,转到4℃冰箱,有利于释放菌体中的纤维素酶,观察透明圈。挑取单菌落做成斜面。
1.2.3 测定纤维素酶活 挑取透明圈较大的菌落,接种于产酶培养基中,200 r/min,37℃,培养24 h,离心,取得粗酶液,测定总酶活。测定方法CMCNa酶活,见文献[9]。每分钟水解底物产生1 μmol还原糖的酶量,定义为一个酶活单位(U)。
酶活计算公式:酶活力(U/mL)=还原糖量/30*Ew
其中,30为水浴保温时间,Ew为粗酶液的体积。
1.2.4 优化产酶培养条件 采用单因素试验,改变pH(分别为2、4、6、8、10)、摇床转速(分别为100、150、200、250、300 r/min)、培养温度(分别为20℃、30℃、40℃、50℃)、发酵时间(分别为24、48、72、96、120 h)等培养条件。根据单因素的试验结果,进行响应面分析,优化试验结果。
2 结果
2.1 比较3种菌的纤维素降解能力
通过计算刚果红培养基上透明水解圈与菌落直径的比值、产酶培养基中菌种产酶活力分析3种菌的纤维素降解能力。表1为3种菌分别在碳源为纤维素粉或经预处理的玉米芯粉培养基上透明圈与菌落直径比。结果表明,青霉、毛霉、曲霉均可在纤维素粉培养基和玉米芯粉培养基上生长,但在纤维素粉培养基上的菌落直径较大,3种菌对玉米芯的利用能力较弱。毛霉的D/d值较其它两种菌大,相对而言毛霉产纤维素酶活较大。图1比较了不同真菌产酶的CMCase酶活力,进一步说明毛霉总酶活较高,达到3.28 U/mL,因此后续优化试验以毛霉为研究对象。
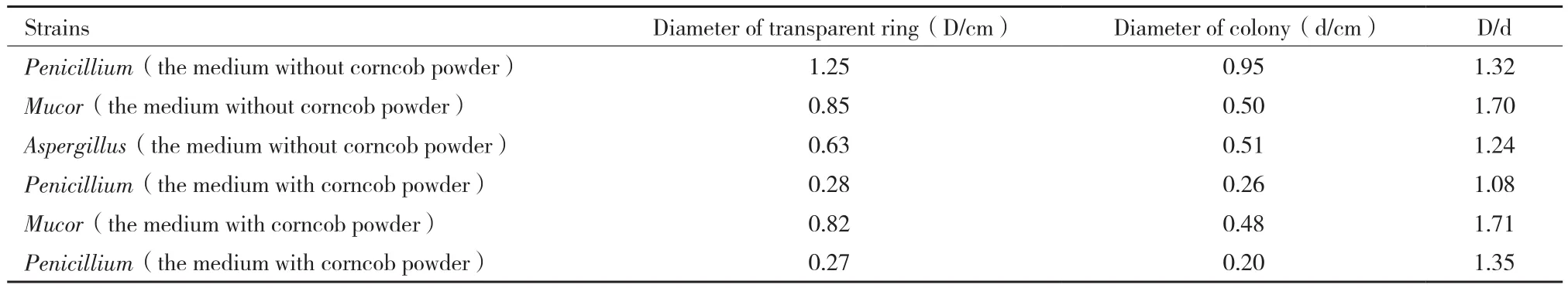
表1 不同菌株在刚果红培养基上透明圈直径比
2.2 单因素试验
不同pH条件下酶活力中心可解离基团的结构不同,由图2可知,酶活力随pH的升高先升高后下降,且经F检验得出毛霉产纤维素酶的最适初始pH值为4-6之间,其酶活力约为3.7 U/mL。
转速是影响好氧菌生长的重要参数。从图3可
看出,酶活随着转速的提高呈现先上升后下降的趋势,且经F检验,摇床转速在200 r/min左右,有较好的产纤维素酶能力,可达到2.1 U/mL。
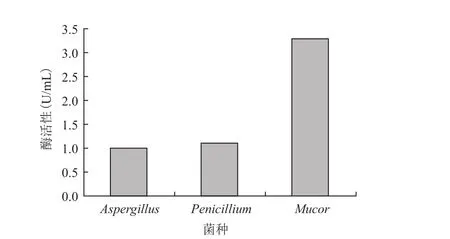
图1 不同菌种纤维素酶活

图2 初始pH对纤维素酶活的影响
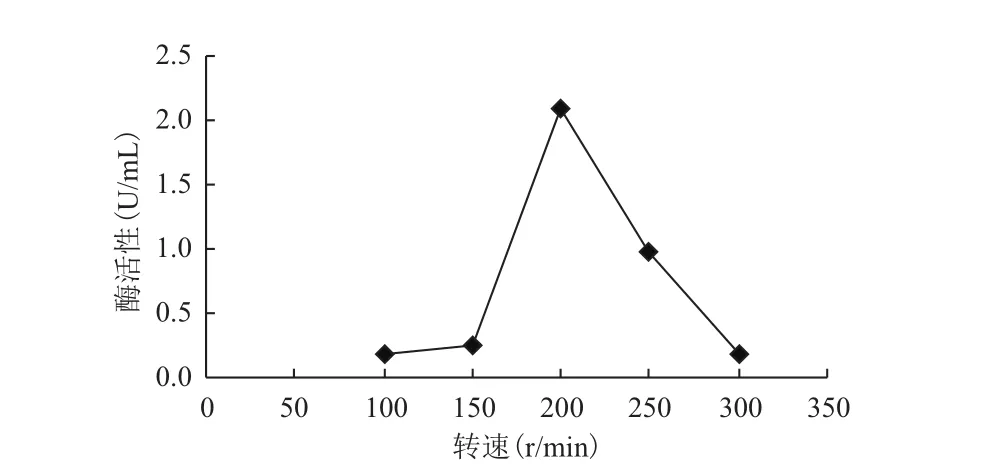
图3 摇床转速对纤维素酶活的影响
酶活随培养时间长短不同而不同。图4体现为酶活力在培养48 h时最高,在培养时间低于48 h的范围内,酶活力随时间的增大而变大,培养48 h时酶活最大为4.985 U/mL。培养时间超过48 h后,酶活力随时间的增大而逐渐变小,这应该与底物浓度降低以及代谢产物抑制有关。
同样,每种微生物都有一个最适宜纤维素酶保持酶活的温度范围。图9中酶活力在培养温度在40℃时最高,在低于40℃范围内,随温度的升高而变大,但是在大于40℃的范围内,随温度的升高而逐渐变小。说明温度在40 ℃左右比较适合毛霉产生纤维素酶并保持酶活。

图4 培养时间对纤维素酶活的影响
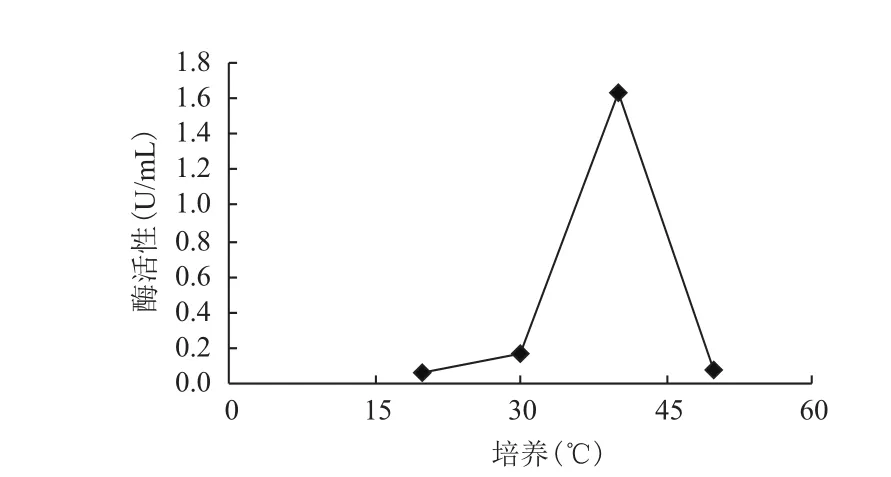
图5 培养温度对纤维素酶活的影响
2.3 响应面分析
为使发酵条件优化,在对2.3试验结果分析的基础上设置响应面试验,选用pH(x1)、转速(x2)、培养时间(x3)、培养温度(x4)四种因素三水平设计。基本依据2.3结果中较佳条件向两边扩充。试验设计及试验结果见表2,变量分析见表3。
如果P<0.05,则说明模型中项的影响是显著的,在这个模型中x3即培养时间是模型的显著项。失拟项反应的是实验数据与模型不相符的情况,它的值为1.87,与整个模型的99.14比起来较小,表示不符合的数据相对于纯误差不显著,即这个模型是比较符合实际数据。
根据Matlab与Design expert所做的分析,得二次拟合回归方程:
酶活=5.81-0.0908×x1-0.0608×x2-0.2433× x3+0.1533×x4-0.1125×x12+0.0100×x22-5.0512× x32+0.2613×x42-0.2350×x1×x2-0.0650×x1×x3-0.3075×x1×x4-0.0125×x2×x3+0.0150×x2×x4-0.0425×x3×x4
对模型进行方差分析得R2=0.991 4,说明方程有较好的拟合度,方程与实际情况比较相符,并能作出相对准确的预测。
图6中3个响应面图说明4个因素对酶活影响趋势与单因素试验结果相同,4个因素中发酵时间
是最大的影响因素。对方程求偏导为=0,得出最佳条件为:pH 5.0,转速 222 r/min,发酵时间47.4 h,发酵温度 35.4℃。

表2 三水平因子试验设计及试验结果

表3 三水平因子变量分析表

图6 pH、转速、发酵时间、培养温度对滤纸酶活的响应面图
为验证模型的符合度,做了验证试验,配制pH为5.0的产酶培养基,准备4个250 mL的摇瓶,倒入50 mL配制好的产酶培养基,放置于温度35 ℃,220 r/min,培养47 h,测定酶活。验证试验酶活力为6.99U/mL,方差不显著,符合预期,所以模型可信,且所得值是本篇论文中最高值。
利用考马斯亮蓝法测得蛋白质含量为6.81 μg/ mL,得酶比活1.03×106。实验室购买的纤维素酶比活为3.00×104,说明在酶的提取纯化过程中,损失酶活。所以,如能进一步提高酶蛋白的产量,省略酶的提取纯化过程,直接用于纤维素降解,降解产物直接被产能源的菌利用,可节约成本。
3 讨论
纤维素是由D-葡萄糖以β-1,4糖苷键组成的大分子,Wood等[10-11]研究表明刚果红与D-葡萄糖的β-1,4糖苷键、D-葡萄糖的β-1,3糖苷键等有较强的作用,显示红色。随着纤维素的降解,红色减弱形成透明圈,因此刚果红染料可用于鉴定纤维素酶的存在[12-14]。通常透明圈大小与菌落直径的比值同纤维素酶活间有一定关系,比值较大,则酶活相对较高[12,14,15]。试验室3种真菌青霉、毛霉、曲霉,均可产生纤维素酶,其中毛霉纤维素酶活相对较高。青霉属、曲霉属中也有产纤维素酶活较高的菌种,如许玉林等[17]得到的草酸青霉,习兴梅等[18]得到的黑曲霉等。本实验室现有的青霉、曲霉相对较弱。
影响产纤维素酶的培养条件中,毛霉产纤维素酶的最适培养基初始pH5.0,与相关文献中真菌产纤维素酶的最适pH范围相似[6,12]。可见毛霉为非嗜酸或嗜碱类细菌,中性偏酸的培养条件较适合其纤维素酶的生产。摇床转速220 r/min,毛霉为好氧菌,摇床转速对毛霉的生长较重要,转速太低,溶氧不足;转速太高,对毛霉剪切力较大[16]。每种微生物都有一个最适宜生长的温度范围[16],本试验中温度为35℃。
从试验结果分析,毛霉产酶活并不是很高,且完全降解纤维素仅靠1种微生物是难实现的,所以菌株的协同效应在纤维素降解中尤为重要。在选择菌种时应充分考虑菌株之间的协同作用,防止拮抗作用的发生。试验初步探讨了毛霉的产酶效果,对纤维素的高效降解具有一定的理论指导意义,至于菌株的产酶机理还有待于进一步研究。
4 结论
通过对纤维素总酶活的测定与比较,得出毛霉产酶活最高。通过对毛霉产酶条件的单因素试验与
响应面分析优化,得出较佳条件:pH 5.0,转速 222 r/min,发酵时间47.4 h,发酵温度 35.4度条件下产酶活最高为6.99 U/mL。
[1] Qureshi N, Ezeji TC, Ebener J, et al. Butanol production by Clostridium beijerinckii. Part I:Use of acid and enzyme hydrolyzed corn fiber[J]. Bioresource Technology, 2008, 99(13):5915-5922.
[2] Qureshi N, Saha BC, Dien B, et al. Production of butanol(a biofuel)from agricultural residues:Part I Use of barley straw hydrolysate[J]. Biomass and Bioenergy, 2010, 34(4):559-565.
[3] 陈守文, 马昕, 汪履绥, 赵学慧. 稻草酶法水解液的丙酮丁醇发酵[J]. 工业微生物, 1998, 28(4):30-34.
[4] 缪静, 张术臻, 程显好, 等. 纤维素酶提取工艺及酶学性质的研究[J]. 安徽农业科学, 2008, 36(19):7954 - 7955, 7960.
[5] 东平, 庞延军, 李兆兰. 绿色木霉产纤维素酶的提取分离及其性质[J]. 徐州师范学院学报, 1996, 14(2):62-66.
[6] 韩阳. 黑曲霉对海带纤维素降解条件的研究[J]. 江苏农业科学, 2010(3):358-360.
[7] 孙军德, 陈南. 秸秆纤维素降解细菌的筛选及其产酶条件的研究[J]. 沈阳农业大学学报, 2010, 41(2):210-213.
[8] 王洪媛, 范丙全. 三株高效秸秆纤维素降解真菌的筛选及其降解效果[J]. 微生物学报, 2010, 50(7):870-875.
[9] 张涛, 皮雄娥, 刘伟, 朱立颖, 王欣. 纤维素降解菌的筛选和鉴定[J]. 现代食品科技, 2010, 26(4):418-420.
[10] Wood PJ. Factors affecting precipitation and spectral changes associated with complex-formation between dyes and β-D-glucans[J]. Carbohydrate Research, 1982, 102(1):283-293.
[11] Teather RM, Wood PJ. Use of congo red-polysaccharide interactions in enumeration and characterization of cellulolytic bacteria from the bovine rumen[J]. Applied and Environmental Microbiology, 1982, 43(4):777-780.
[12] 买尔哈巴·艾合买提, 樊振, 李越中, 等. 瘤胃中纤维素分解菌的分离、鉴定及其产酶条件的优化[J]. 微生物学报, 2013, 53(5):470-477.
[13] 张欢, 寇巍, 王晓明, 等. 产纤维素酶菌株的选育分析及发酵工艺优化[J]. 环境化学, 2013, 32(4):605-611.
[14] 马雪姣, 李静, 徐静静, 杨力. 奶牛粪便纤维素降解菌的筛选[J]. 西南师范大学学报:自然科学版, 2013, 38(3):134-137.
[15] 王大为, 王影, 迟燕平. 纤维素降解菌的分离筛选及酶活测定[J]. 食品工业, 2013, 34(5):219-221.
[16] 曹军卫, 马辉文, 张甲耀. 微生物工程[M]. 第2版. 北京:科学出版社, 2007:92-113.
[17] 许玉林, 郑月霞, 叶冰莹, 等. 一株纤维素降解真菌的筛选及鉴定[J]. 微生物学通报, 2013, 40(2):220-227.
[18] 习兴梅, 曾光明, 郁红艳, 等. 黑曲霉Aspergillus niger木质纤维素降解能力及产酶研究[J]. 农业环境科学学报, 2007, 26(4):1506-1511.
(责任编辑 李楠)
Analysis on Cellulase Producing Abilities of Three Kinds of Fungi and Optimization of Cultivation Conditions
Hu Cuiying Li Liangzhi Zhao Jian Qian Wei Gu Huajie
(College of Chemistry,Biology and Materials Engineering,Suzhou University of Science and Technology,Suzhou 215009)
We analyzed the cellulose degradation ability of three kinds of fungi (Penicillium, Mucor and Aspergillus) preserved in the laboratory and optimalized the culture conditions. The transparent ring size of three kinds of fungi training in the congo red medium and in the corncob congo red medium was observed. The cellulase activity was measured of the three fungi cultured in the CMC-Na medium. Single factor and response surface methodology were used to optimize the culture condition. The three kinds of fungi all could produce cellulase. The cellulase activity of Mucor was higher than the other two cultured in the the CMC-Na medium. The optimized conditions were below:pH was 5.0, the shaking speed was 220 r/min,fermentation time was 47 h,fermentation temperature was 35 ℃. The highest CMCase activity was 6.99 U/mL training on the optimized condition. Penicillium, Mucor and Aspergillus produced cellulase and Mucor could degrade corncob.
Fungi Cellulase Culture condition Optimize
2013-10-14
作者简介:胡翠英,女,硕士,研究方向:发酵工程研究;E-mail:13151170848@163.com

