香菇dsRNA病毒LeV的RT-PCR检测
香菇dsRNA病毒LeV的RT-PCR检测
郭杰1,2吴小平1
(1.福建农林大学生命科学学院,福州 350002;2.三门峡农业科学研究院,三门峡 472000)
香菇病毒HKB(Lentinula edodes mycovirus HKB,LeV)是一种具有潜隐性特点的真菌病毒,广泛存在于香菇菌株中。为了快速、准确地检测出LeV,根据LeV病毒基因组序列(AB.429556.2)的信息,设计合成一对引物,对25个香菇菌株进行RTPCR检测,在20个香菇菌株中分别扩增出LeV病毒基因组特有的条带,在5个香菇菌株中未能扩增出条带。通过对25个香菇菌株进行dsRNA提取检测,结果也表明不存在扩增片段的菌株提取不到dsRNA,存在扩增片段的菌株能够提取得到dsRNA。因此建立的RT-PCR方法可以快速检测到香菇dsRNA病毒LeV,能够对香菇的质量检测提供技术支持。
dsRNA 真菌病毒 RT-PCR 香菇
香菇病毒HKB(Lentinula edodesmycovirus HKB,LeV),存在于多数感染病毒的香菇中。最近有报道检测到一条与其基因组相关的dsRNA,分子大小为11 282 bp,编码两个阅读框ORF1和ORF2,ORF1编码一个假定蛋白,ORF2推测编码RNA依赖的RNA聚合酶[1]。LeV是一种真菌病毒,具有潜隐性的特点,在生产过程中人们不易辩认和排除[2]。通常感染病毒的香菇可以完成自身正常的生命周期,病毒在很长的时期内不会产生明显的症状,但也会偶尔出现异常症状。如基质表面白色绒毛菌丝生长不足或转色不完全[3],子实体畸型等,这些症状往往导致严重的经济损失。因此,为满足香菇菌株质量检测和无毒化生产的需要,本试验根据LeV基因序列,拟建立快速、简单的RT-PCR方法用于香菇病毒LeV感染的检测诊断。
1 材料与方法
1.1 材料
1.1.1 供试菌株 香菇菌株236,Cr33,庆科20,春菇一号,香安,9319,L0200,L0205,L0213,L0228,L0232,L0284,L0312,L0318,L0327,L0328,L0334,L0364,L0368,L0391,L0610,L0612,L0617,L0620,感染LeV的菌株L0183[4]均为福建农林大学菌物研究中心保存。
1.1.2 培养基 PDA 培养基:马铃薯200 g,葡萄糖
20 g,琼脂20 g,水1 000 mL。
PDB培养基 马铃薯200 g,葡萄糖20 g,H2O 1 000 mL。
1.1.3 主要试剂 RT试剂,DNaseⅠ和S1 Nuclease购自Fermentas公司;PCR试剂,pMD18-T,E.coliDH5α购自TaKaRa公司;Trizol试剂盒购自Invitrogen公司;其它试剂均为国产。根据LeV的ORF2序列信息(GenBank:AB.429556.2)设计1对引物:LeVY-02-S:5'-ACAGTAGCGGTATCTCA-3',LeVY-02-A:5'-GCCAGGCAGTTTAGT-3'。
1.2 方法
1.2.1 菌丝体的制备 供试香菇菌种转接于试管中活化(含PDA培养基),满管后转接于500 mL三角瓶中(含200 mL PDB培养基),25℃下静置培养15 d,过滤收集菌丝体,用滤纸吸干,-20℃保存备用。
1.2.2 香菇dsRNA和RNA的提取 供试菌株dsRNA和RNA的提取方法分别参照dsRNA技术[4]和Trizol试剂盒操作说明书。
1.2.3 香菇dsRNA病毒RT-PCR检测反应体系 RT反应体系,首先在0.2 mL PCR管中加入RNA模版(100 ng),10 μmol/L引物LeVY-02-A 1 μL,二甲亚砜1 μL,补DEPC水至10 μL,100℃保温5 min,然后迅速放置冰上5 min。再添加5×RT Buffer 4 μL、10 mmol/L dNTPs 2 μL、40 U/μL Rnase inhibitor 0.5 μL、200 U/μL 反转录酶M-MuLV 0.5 μL、用DEPC水补充至20 μL,反应总体积为20 μL,反应程序为42℃反应1 h,70℃灭活10 min立刻置于冰上,-20℃保存。
RT反应结束后取1 μL RT产物进行PCR反应,添加10×PCR Buffer 3 μL(含15 mmol/L MgCl2),2.5 mmol/L dNTPs 1 μL、5 U/μLTaqDNA聚合酶 0.3 μL、10 μmol/L引物(LeVY-02-S,LeVY-02-A)各1 μL,用DEPC水补充至30 μL,反应总体积为30 μL,反应程序为95℃预变性5 min,95℃ 45 s,最佳退火温度52℃ 45 s,72℃ 45 s,25个循环,72℃延伸10 min。
1.2.4 病毒核酸类型鉴定 利用DNaseⅠ和S1 Nuclease鉴定该病毒基因组的核酸类型,分别参照DNaseⅠ和S1 Nuclease的操作说明书。
1.2.5 RT-PCR产物的克隆和测序 琼脂糖凝胶电泳检测RT-PCR产物后,随机选取3个菌株扩增的目的片段经PCR Fragment Recover Kit回收纯化,与pMD18-T Vector连接后转化E.coli.DH5α菌株感受态细胞,挑取阳性克隆子,菌落PCR验证后,送上海生工生物工程公司进行测序,测序结果运用NCBI Blast进行同源性搜索比较分析。
2 结果
2.1 RT-PCR检测
LeVY-02引物RT-PCR结果(图1)表明,在25个香菇菌株中,236、L0200、L0328、L0284、L0620菌株不存在特异性目的片段,其余菌株均存在一条大小约434 bp的特异性目的片段。因此,236、L0200、L0328、L0284、L0620菌株中不含有香菇真菌病毒,其余20个菌株中可能含有香菇真菌病毒LeV。

图1 RT-PCR检测香菇真菌病毒LeV的琼脂糖凝胶电泳图谱
2.2 序列分析
L0183、L0232、L0617菌株RT-PCR扩增的目的片段克隆测序后,结果(图2)表明3个片段的序列分别与LeV(AB.429556.2)对应序列的相似性为 98%(L0232)、99%(L0183)、99%(L0617)。由此,可以认为存在扩增片段的20个菌株中含有香菇真菌病毒LeV,但其dsRNA可能有差异。

图2 多序列比对结果
2.3 病毒核酸类型
经过DNaseⅠ和S1 Nuclease鉴定该病毒基因组的核酸类型为dsRNA(图3)。通过dsRNA的提取结果也表明不存在扩增片段的菌株提取不到dsRNA,存在扩增片段的菌株能够提取得到dsRNA。
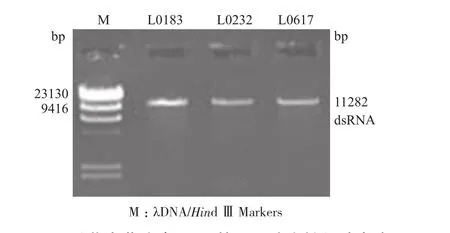
图3 香菇真菌病毒LeV基因组琼脂糖凝胶电泳
3 讨论
通常dsRNA病毒可以通过电子显微镜进行病毒颗粒的检测[5-8],但是电镜检测需要的样品量大,过程复杂且灵敏度相对较低,对于一些特殊的病毒,电镜也无法进行检测。已有研究表明,LeV是一种线性真菌病毒,通过电子显微镜没有发现同dsRNA相关的病毒颗粒,通过原子力显微镜才获得了病毒的分子成像[1],但昂贵的设备,更高要求的检测方法令一般的研究单位难以负担。dsRNA病毒还可以通过提取病毒基因组进行检测[9-11],但传统的dsRNA提取技术检测香菇病毒,经常性地出现杂带影响或提取不到dsRNA[4]。RT-PCR检测是一种常规的检测技术,在动植物病毒检测方面已有多篇报道[12-14],在食用菌dsRNA病毒检测中也有相关报道[15,16],但在国内尚未见利用RT-PCR对香菇病毒HKB(LeV)检测的报道。经过LeV的RT-PCR检测试验证实,RT-PCR方法较其他检测方法,不需要特殊且贵重的仪器设备,也无需活性病毒,只要存在未降解的核酸片段,且达到检测的最低病毒量就
能够检测,具有操作简单,快速、灵敏性高的特点,可以避免提取病毒颗粒和基因组等检测方法操作繁琐或效果不理想等问题。
香菇LeV病毒RT-PCR检测方法还需要继续完善,如进行RT-PCR方法的优化试验,提高检测的经济性;或开发具有荧光素标记或其他发光物质标记的RT-PCR,提高检测结果的可视性;或在香菇病毒分子生物学的深入研究下,完成病毒基因组的全序列分析,建立核酸分子杂交检测方法,免疫学血清检测方法,酶联免疫吸附检测方法和蛋白质微列阵检测方法等,开发出简便、灵敏的病毒检测试纸条,无论是在研究上或应用上都具有广泛的现实意义。
4 结论
建立了一种可对香菇LeV病毒核酸进行扩增的RT-PCR方法,适用于香菇LeV病毒的诊断和快速检测。
[1] Yumi M. Molecular characterization of a novel mycovirus in the cultivated mushroom, Lentinula edodes[J]. Virology Journal, 2012, 9:60.
[2] 潘迎捷, 陈明杰, 沈雪仁. 香菇病毒的分离、诊断、侵染途径和生物学特性[J]. 上海农业学报, 1992, 8(4):7-11.
[3] Ohta C, Taguchi T, Takahashi S, et al. Detection of double stranded RNA elements in cultivated Lentinula edodes(in Japanese)[J]. Mushroom Sci Biotechnol, 2008, 16:155-158.
[4] 吴小平, 王丽, 谢宝贵, 陈剑, 香菇菌株的脱毒研究[J]. 中国农学通报, 2009, 25(24):44-49.
[5] Kim YJ, Kim JY, Kim JH, et al. Identification of a Novel Pleurotus ostreatus dsRNA virus and determination of the distribution of viruses in mushroom spores[J]. The Journal of Microbiology, 2008, 46(1):95-99.
[6] Jea YH, Sun LJ, Joo LN, et al. Identification of three isometric viruses from Pleurotus ostreatus[J]. Journal of Huazhong Agricultural University, 2004, 23(1):150-156.
[7] Magae Y, Hayashi N. Double-stranded RNA and virus-like particles in the edible basidiomycete Flammulina velutipes(Enokitake)[J]. FEMS Microbiol Lett, 1999, 180(2):331-335.
[8] 姚立, 陈春乐, 张忠信, 等. 一种新香菇病毒基因组部分cDNA序列及病毒RT-PCR检测[J]. 微生物学报, 2010, 37(1):61-70.
[9] Gildow EF, Ballinger ME, Rochow WF. Identification of doublestranded RNAS associated with barley yellow dwarf virus infection in oats[J]. Phytopathology, 1983, 73:1570-1572.
[10] French RC, Price MA, Derrick KS. Circular double-stranded RNA in potato spindle tuber viroid-infected tomatoes[J]. Nature, 1982, 295:259-260.
[11] Grcgan HM, Aclie BA, Gaze RH, et al. Double-stranded RNA elements associated with the MVX disease of Agaricus bisporus[J]. Mycol Res, 2003, 107(2):147-154.
[12] 曹庆, 易干军, 陈金印, 等. 柑桔裂皮病类病毒RT-PCR检测体系优化分析[J]. 南昌工程学院学报, 2008, 27(03):64-66.
[13] 郭立新, 向本春, 朱水芳. 苹果茎沟病毒实时荧光RT-PCR反应体系的优化[J]. 北方园艺, 2009(3):8-11.
[14] 谢志勤, 谢芝勋, 廖敏, 等. RT-PCR检测猪瘟病毒方法的建立与应用[J]. 畜牧与兽医, 2002, 34(11):11-14.
[15] Peter AR, Peter JW. RT-PCR detection of dsRNAs associated with La France disease of the cultivated mushroom Agaricus bisporus(Lange)Imbach[J]. Journal of Virological Methods, 1997, 63:17-26.
[16] Kim YJ, Park S, Yie SW, et al. RT-PCR Detection of dsRNA Mycoviruses Infecting Pleurotus ostreatus and Agaricus blazei Murrill[J]. Plant Pathol, 2005, 21(4):343-348.
(责任编辑 李楠)
RT-PCR Detection of dsRNA Virus LeV in Lentinula edodes
Guo Jie1,2Wu Xiaoping1
(1. College of Life Science,Fujian Agriculture and Forestry University,Fuzhou 350002;2. Institute of SanMenxia Agriculture Science,Sanmenxia 472000)
Lentinula edodes mycovirus HKB(LeV)is a fungal virus with the potential symptoms and exists widely in Lentinula edodes strains. In order to detect LeV from abundant strains rapidly and accurately, a pair of primers were designed according to the sequence of LeV(AB.429556.2)and amplified by RT-PCR method. In a total of 25 strains, 20 strains were positive for LeV and 5 strains were negative. The result of dsRNA extraction also showed dsRNA were obtained in the positive strains and the negative strains were not. In conclusion, the study proved that RT-PCR is a rapid and sensitive method for detection of LeV in Lentinula edodes strains and can attribute to the control of strains quality.
dsRNA Mycovirus RT-PCR Lentinula edodes
2013-09-23
福建省科技厅自然科学基金项目(2013J01080)
郭杰,男,助理农艺师,硕士,研究方向:食用菌病害;E-mail:gjfywx_2008@163.com
吴小平,男,教授,博士,研究方向:食用菌教学与科研;E-mail:fjwxp@126.com

