大豆转录因子GmERF5启动子的克隆及活性分析
大豆转录因子GmERF5启动子的克隆及活性分析
翟莹1张军2赵艳1孙天国1姚雅男3杨晓杰1
(1.齐齐哈尔大学生命科学与农林学院 遗传重点实验室,齐齐哈尔 161006;2.黑龙江省兽医科学研究所,齐齐哈尔 161006;3.长春农业博览园,长春 130117)
乙烯响应因子(Ethylene-responsive factors,ERFs)广泛参与植物对生物和非生物胁迫的应答。从大豆吉林32的基因组DNA中分离到GmERF5的启动子片段,全长1 924 bp。该区段含有9种与逆境相关的顺式作用元件,即G-box、GT-1、LTRE-1、W-box、TL1、DPBF、MYB、MYC和BIHD10S。将该启动子构建到植物表达载体pCAMBIA1301上与葡萄糖苷酸酶(GUS)基因融合,注射法转化烟草叶片,并进行干旱、高盐和低温处理,通过GUS组织化学染色和GUS荧光值的测定分析启动子的启动活性。结果表明,在未处理条件下,该启动子能驱动下游GUS基因的表达。干旱和低温处理10 h能明显增强GmERF5P的启动活性。
大豆 GmERF5 GUS活性 启动子 逆境诱导
当植物处于不利的环境中时会迅速激活相关的信号转导途径[1],合成大量逆境相关的基因产物,包括酶、分子伴侣、离子通道蛋白和转运体等[2],使植物更好的适应各种生物和非生物胁迫。其中,逆境相关转录因子由于可以和启动子中特定的元件结合,通过调节自身的改变从而调控下游多个目的基因的表达而在植物适应不利环境条件方面发挥重要作用[3]。乙烯响应因子(Ethylene-responsive factors,ERFs)是植物中特有的一类转录因子,广泛参与植物对生物和非生物胁迫的应答。自Ohme-Takagi和Shinshi[4]首次从烟草中分离出4个ERF基因以来,已从拟南芥、番茄、水稻、小麦、玉米等不同植物中相继获得大量ERF基因。近年来,将拟南芥中的ERF转录因子HARDY在三叶草中异位表达,降低了转基因植物的蒸腾作用和对钠离子的摄入量,从而提高了转基因三叶草的抗旱性和抗盐性[5]。超表达SlERF1的转基因番茄与野生型相比含有更高的相对含水量、脯氨酸含量和可溶性糖含量,提高了转基因番茄的抗盐性[6]。另外,将番茄中的另一个ERF转录因子TSRF1在烟草和番茄中过表达,通过GCC-box激活抗病基因的表达可提高转基因植物的抗病性,而将其在水稻中过表达则可以通过调控胁迫响应基因的表达来提高转基因水稻的抗旱性[7]。从拟南芥中分离出一个受低氧、高盐、ABA和紫外
辐射诱导的AtERF71/HRE2,将其在拟南芥中超表达提高了转基因拟南芥对高盐、水淹和紫外辐射的抗性[8]。由此可见,ERF转录因子的应用是提高农作物综合抗逆能力的有效策略。
植物基因的启动子位于基因5'端上游区域,调控基因的转录起始和频率,使基因在不同的组织器官、不同的发育时期以及不同环境条件下表达[9]。启动子序列除含有基本元件TATA-box和CAAT-box外,还存在一些特异性的顺式作用元件,它们可以与转录因子蛋白等调节蛋白质协同作用[10]。研究转录因子基因的启动子有助于理解该基因的逆境胁迫调控机制及信号调控网络。然而,到目前为止关于ERF基因启动子及其表达调控的研究报道并不多。
本研究前期从大豆品种吉林32中分离出一个可以被逆境胁迫所调控的ERF转录因子GmERF5(GenBank登录号为JN416600)[11]。为研究GmERF5的表达调控模式及其在大豆胁迫响应中的调控功能,本研究分离出GmERF5的启动子片段,进行生物信息学分析,并构建植物表达载体转化烟草叶片,分析该启动子对干旱、高盐和低温的应答反应。
1 材料与方法
1.1 材料
供试大豆(Glycine maxL.)吉林32由吉林大学植物种质资源与利用研究室提供;烟草(Nicotiana tabacumL.)NC89由本实验室保存;载体pCAMBIA-1301、大肠杆菌(Escherichia coli)DH5α及根癌农杆菌(Agrobacterium tumefaciens)EHA105均由本实验室保存。
1.2 方法
1.2.1GmERF5基因启动子的克隆和序列分析 利用已克隆到的大豆GmERF5转录因子cDNA序列搜索大豆基因组数据库GmGDB(http://www.plantgdb. org/GmGDB/),获得其上游大概2 000 bp的启动子序列。利用引物设计软件Primer5设计引物,在其两边,引物序列如下(下划线部分为EcoRI 和NcoI酶切位点)F:5'-GGGAATTCGCTATTCCCCTAAACTTTG-3';R:5'-GGCCATGGGTTTCTTCTTCAGAACTTGAG-3'。以大豆吉林32叶片DNA为模板,进行PCR扩增。PCR程序为94℃ 8 min;94℃ 40 s,60℃ 40 s,72℃ 1 min,进行30个循环;72℃延伸8 min。PCR产物经切胶回收后连接至pMD18-T载体,将筛选获得阳性质粒命名为pMD18-T-GmERF5P,并送华大基因进行测序。测序结果利用DNAMAN软件进行序列比对,PLACE(http://www.dna.affrc.go.jp/PLACE/)数据库用于启动子顺式作用元件的预测分析。
1.2.2 表达载体的构建 将测序正确的pMD18-TGmERF5P质粒和pCAMBIA1301质粒分别用EcoR I 和NcoI 双酶切后经T4连接酶过夜连接,以菌液PCR和双酶切鉴定阳性克隆。利用冻融法将表达载体pCAMBIA1301-GmERF5P和pCAMBIA1301分别转化农杆菌EHA105。
1.2.3 烟草叶片的转化及胁迫处理 农杆菌介导的烟草叶片的转化参照Yang等[12]的方法并加以改进。烟草苗采用盆栽,于温室中培养6周后开始进行处理。将分别含有pCAMBIA1301-GmERF5P载体和pCAMBIA1301空载体的农杆菌菌液于YEP培养基中,28℃,120 r/min(摇床),振荡培养至OD600大约为0.6时,2 000×g离心15 min收集菌体,用MS液体培养基(附加10 mmol/L MES和100 μmol/L AS)重悬菌体至OD600大约为0.8。用1 mL注射器,分别抽取1 mL重悬后的菌体和对照MS重悬液注入到烟草植株幼嫩叶片的叶脉间,做好标记,覆膜保湿培养40 h后对烟草整株进行各种胁迫处理。将注射后的烟草苗分别置于含10 % PEG8000和200 mmol/L NaCl的水溶液中进行干旱和高盐处理;于4℃培养箱进行低温处理。处理后10 h取样进行GUS基因表达的检测。
1.2.4GUS基因表达的检测 参照Jefferson[13]的方法对GUS报告基因的表达进行检测。将处理后的烟草叶片剪下进行GUS组织化学染色:加入GUS染色液[14],于37℃温育过夜,用75 %的乙醇脱色至底色完全消失。另将0.1 g处理后的烟草叶片在液氮中研磨成粉末,加入600 μL酶提取缓冲液,4℃离心,用Bradford法[15]测定上清液中的蛋白浓度。取出部分上清液加GUS反应底物4-MUG,于37℃反应10 min,在荧光分光光度计上进行GUS荧光值的测定。试验设置3次生物重复,用获得的荧光值除以蛋白浓度和时间得到GUS相对活性。
2 结果
2.1GmERF5启动子的扩增
将已获得的逆境诱导相关转录因子GmERF5的cDNA序列输入大豆基因组数据库进行搜索,获得该序列上游大概2 000 bp的DNA序列。进一步设计引物,通过PCR从大豆吉林32的叶片DNA中扩增得到1 924 bp的GmERF5启动子序列,命名为Gm-ERF5P。经分析该序列富含A/T(含量达73.1 %),这是植物启动子序列的主要特征之一。
2.2GmERF5P的序列分析
利用数据库PLACE对获得的启动子序列进行分析,结果(图1)表明,GmERF5P除含有基本启动子特征元件TATA-box和CAAT-box外,还含有与逆境相关的9种顺式作用元件,即:3个与脱水响应相关的G-box元件、11个病原体和盐诱导响应相关的GT-1元件、1个低温响应相关的LTRE-1原件、1个伤害响应相关的W-box元件、1个抗病相关的TL1元件、1个ABA诱导转录因子DPBF的结合位点、4个脱水响应相关的MYB转录因子识别位点、5个脱水和冷诱导相关的MYC转录因子识别位点和2个抗病相关的OsBIHD1转录因子结合位点BIHD10S。

图1 GmERF5P DNA序列的生物信息学分析
2.3GmERF5P的逆境诱导瞬时表达
烟草叶片的GUS染色结果(图2)表明,仅注射对照重悬液的烟草叶片都没有被X-Gluc溶液染成蓝色,而转化pCAMBIA1301空载体的烟草叶片在未处理和3种逆境处理条件下都可以被X-Gluc溶液染成较一致的深蓝色,说明GUS报告基因在烟草叶片中能够被pCAMBIA1301载体上的烟草花叶病毒
35S(CaMV35S)组成型启动子启动,且基本不受以上3种逆境处理的调节。在未处理条件下,转化pCAMBIA1301-GmERF5P的烟草叶片被X-Gluc溶液染成浅蓝色,表明在正常条件下GmERF5P本身具有启动活性,但与CaMV35S相比,其启动活性较弱。经过干旱和低温处理后,烟草叶片呈现出的蓝色比未处理时的蓝色深,表明GmERF5P的启动活性在处理10 h时能被干旱和低温所诱导,使下游目的基因的表达量增高。但高盐处理10 h对GmERF5P的启动活性影响不大。

图2 逆境诱导后烟草叶片GUS组织化学染色
烟草叶片的GUS荧光值检测结果与GUS染色结果相符合。如图3所示,干旱和低温处理10 h均能使GmERF5P的启动活性有不同程度的增强,而高盐处理则没有提高GmERF5P的启动活性。
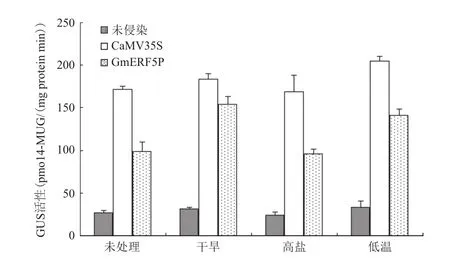
图3 逆境诱导后烟草叶片GUS活性分析
3 讨论
影响外源基因在转基因植物中表达的因素有很多,其中以启动子的调控最为关键。逆境诱导启动子仅在植物遭受逆境胁迫时才大量启动下游抗逆基因的表达,可以避免外源基因在转基因植物中持续表达所造成诸多负面影响[16,17]。因此,逆境诱导启动子的使用对植物应对逆境环境具有重要的意义。
GmERF5是从大豆吉林32中分离到的一个编码ERF转录因子基因,能够被多种生物及非生物胁迫所诱导[11]。长度为1 924 bp的GmERF5基因启动子片段能够在干旱和低温处理10 h后明显提高下游报告基因的表达量,具有一定的逆境诱导活性。此结果与前期研究结果相符,实时荧光定量PCR结果表明大豆中GmERF5基因在干旱和低温处理10 h后表达量上升明显,而高盐处理10 h后基因表达量变化不大[11]。利用生物信息学方法对GmERF5P上的顺式作用原件进行预测,发现其含有多个与脱水、高盐、低温、病原物和伤害等逆境相关的顺式作用元件,由此推测各种逆境环境可能就是通过这些顺式作用元件来调节GmERF5基因的表达,进而再通过GmERF5所介导的信号路径调控大豆对生物及非生物胁迫的响应,从而表现出复杂的调控方式。逆境处理10 h,GmERF5P对干旱处理的响应最为明显,序列分析结果表明GmERF5P上存在3个脱水响应元件G-box;其次是对低温的响应,GmERF5P序列仅存在1个低温响应元件LTRE-1;尽管GmERF5P序列上存在11个盐诱导响应元件GT-1,但其对高盐处理的响应不明显。由此表明启动子的逆境诱导活性不仅只取决于逆境诱导元件的个数,还应该由元件的种类及相对位置等共同决定[18]。另外GmERF5基因的表达还可能受到MYB转录因子、MYC转录因子等逆境相关转录因子的调控[19]。但是,具体是哪些元件在GmERF5P中发挥关键作用,尚需要进一步的研究。
启动子序列中的A/T含量与启动子的启动活性呈正相关,这些序列的功能很可能是与植物细胞核内的A/T丰富序列结合蛋白相作用,从而对基因的表达起调控作用[20,21]。GmERF5P序列中含有大量A/T序列,推测其可能具有较高的启动效率。通过
GUS组织化学染色和GUS荧光值的测定,证明了GmERF5P即使在未诱导条件下也能有效地启动下游GUS报告基因的表达。但GmERF5P启动子无论在未处理还是在逆境处理10 h后其启动强度都明显低于CaMV35S启动子,这可能是由于GmERF5P序列相对较长,远端可能存在负调控元件,也可能与逆境处理时间有关,这方面仍需做启动子缺失和逆境诱导时间相关试验来进一步验证[19]。
4 结论
本研究首次克隆了大豆转录因子GmERF5基因的启动子序列,该区段含有9种与逆境相关的顺式作用元件。将该启动子构建植物表达载体并转化烟草叶片。在未处理条件下,该启动子能驱动下游GUS基因的表达,干旱和低温处理10 h能明显增强Gm-ERF5P的启动活性。
[1] Zhu JK. Salt and drought stress signal transduction in plants[J]. Annu Rev Plant Biol, 2002, 53:247-273.
[2] Kizis D, Pages M. Maize DRE-binding proteins DBF1 and DBF2 are involved in rab17 regulation through the drought-responsive element in an ABA-dependent pathway[J]. Plant J, 2002, 30(6):679-689.
[3] Schenk PM, Kazan K, Wilson I, et al. Coordinated plant defense responses in Arabidopsis revealed by microarray analysis[J]. Proc Natl Acad Sci USA, 2000, 97(21):11655-11660.
[4] Ohme-Takagi M, Shinshi H. Ethylene-inducible DNA binding proteins that interact with an ethylene-responsive element[J]. Plant Cell, 1995, 7(2):173-182.
[5] Abgadallah GM, Nada RM, et al. Overexpression of HARDY, an AP2/ERF gene from Arabidopsis, improves drought and salt tolerance by reducing transpiration and sodium uptake in transgenic Trifolium alexandrinum L[J]. Planta, 2011, 233(6):1265-1276.
[6] Lu CW, Shao Y, Li L, et al. Overexpression of SlERF1 tomato gene encoding an ERF-type transcription activator enhances salt tolerance[J]. Russ J Plant Physiol, 2011, 58(1):118-125.
[7] Quan RD, Hu SJ, Zhang ZL, et al. Overexpression of an ERF transcription factor TSRF1 improves rice drought tolerance[J]. Plant Biotech J, 2010, 8(4):476-488.
[8] Park HY, Seok HY, et al. AtERF71/HRE2 transcription factor mediates osmotic stress response as well as hypoxia response in Arabidopsis[J]. Biochem Bioph Resys Commun, 2011, 414(1):135-141.
[9] 朱丽萍, 于壮, 邹翠霞, 等. 植物逆境相关启动子及功能[J].遗传, 2010, 32(3):229-234.
[10] 刘强, 张贵友, 陈受宜. 植物转录因子的结构与调控作用[J]. 科学通报, 2000, 45(14):1465-1474.
[11] 翟莹 杨晓杰 孙天国, 等. 大豆转录因子GmERF5的克隆、表达及功能分析[J]. 植物学报, 2013, 48(5):498-506.
[12] Yang YN, Li RG, Qi M. In vivo analysis of plant promoters and transcription factors by agroinfiltration of tobacco leaves[J]. Plant J, 2000, 22(6):543-551.
[13] Jefferson RA. Assaying chimeric genes in plants:the GUS gene fusion system[J]. Plant Mol Biol Rep, 1987, 5(4):387-405.
[14] 张庆林, 赵艳, 等. 大豆硬脂酸-ACP脱饱和酶基因启动子的克隆及其表达活性分析[J]. 作物学报, 2011, 37(7):1205-1211.
[15] Brandford MM. A rapid and sensitivee method for the quantitation of microgram quantities of protein utilizing the principle of proteindye binding[J]. Anal Biochem, 1976, 72:248-254.
[16] 李新玲, 杨传平, 曲敏, 等. rd29A启动子的克隆及提高烟草抗逆性的研究[J]. 分子植物育种, 2007, 5(1):37-42.
[17] 朱丽萍, 于壮, 邹翠霞, 等. 植物逆境相关启动子及功能[J].遗传, 2010, 32(3):229-234.
[18] 李杰, 张福城, 王文泉, 等. 高等植物启动子的研究进展[J].生物技术通讯, 2006, 17(4):658-661.
[19] 孙啸, 董建辉, 等. 大豆抗逆基因GmDREB3启动子的克隆及调控区段分析[J]. 作物学报, 2008, 34(8):1475-1479.
[20] Bustos MM, Guiltinan MJ, Jordano J, et al. Regulation of beta-glucuronidase expression in transgenic tobacco plants by an A/T-rich, cisacting sequence found upstream of a French bean beta-phaseolin gene[J]. Plant Cell, 1989, 1(9):839-853.
[21] Tjaden G, Coruzzi GM. A novel AT-rich DNA binding protein that combines an HMG I-like DNA binding domain with a putative transcription domain[J]. Plant Cell, 1994, 6(1):107-118.
(责任编辑 狄艳红)
Cloning and Activity Analysis of Soybean GmERF5Promoter
Zhai Ying1Zhang Jun2Zhao Yan1Sun Tianguo1Yao Yanan3Yang Xiaojie1
(1. College of Life Science and Agro-forestry,Qiqihaer Univesity,Key Laboratory of Genetics,Qiqihaer 161006;2. Heilongjiang Institute of Veterinary Science,Qiqihaer 161006;3. Changchun Agriculture Expo Garden,Changchun 130117)
ERF transcription factor family is extensively involved in the biotic and abiotic responses. The GmERF5 promoter(1 924 bp)was isolated from soybean genome using PCR. Sequence analysis indicated that GmERF5P contains several stress-induced elements:G-box, GT-1, LTRE-1, W-box, TL1, DPBF, MYB, MYC and BIHD10S. GmERF5P was subcloned into pCAMBIA1301 vector to drive the GUS gene to express in tobacco leaves by Agrobacterium-mediated injection transformation. The activity of GmERF5P was analyzed using histochemistry staining and GUS fluorescence intensity analysis. The results indicated that GmERF5P activated expression of GUS report gene under normal growing conditions. The activity of GmERF5P was up-regulated after the treatments of drought and low temperature for 10 h.
Soybean GmERF5P GUS activity Promoter Stress-induced
2013-09-06
齐齐哈尔大学青年教师科研启动支持计划项目(2012k-M20)
翟莹,女,博士,讲师,研究方向:大豆分子育种;E-mail:fairy39809079@126.com

