热激处理和柠檬酸提高发芽糙米中植酸酶活性
李 欣,陈 威,何 敏
(1.广东科贸职业学院,广东广州510430;2.广东省粮食科学研究所,广东广州510050)
热激处理和柠檬酸提高发芽糙米中植酸酶活性
李 欣1,陈 威2,何 敏1
(1.广东科贸职业学院,广东广州510430;2.广东省粮食科学研究所,广东广州510050)
研究了热激处理和柠檬酸发芽介质对糙米的内源植酸酶活性的影响,并采用响应面设计优化了热激处理条件。结果表明,随着热激时间的延长,糙米中植酸酶的活性逐渐升高,达到峰值后下降。利用中心组合响应面设计实验,预测并验证的优化的热激和浸泡条件为,热激温度50℃,热激时间30min,浸泡时间6h。以2mmol/L柠檬酸缓冲液(pH5.2)作为发芽介质,植酸酶活性随着发芽时间的延长,先升高后下降;发芽3d,植酸酶活性达到最高值(241.27U/kg),高于原料糙米(115.57U/kg)。本工艺提高了发芽糙米的内源植酸酶活性,为开发糙米食品中降低植酸和保持营养价值的提供了基础数据。
植酸酶,发芽糙米,热激处理,柠檬酸,响应面分析
糙米中含有丰富的营养和活性成分,同时含有较高的植酸,含量为12.7~21.6mg/kg,可螯合Zn、Fe等矿物质营养素,从而造成微量矿物质营养摄入不足[1-2]。因此,开发糙米食品时,应降低植酸含量,提高矿物质的利用率。发芽、浸泡、蒸煮和发酵等加工方法常用于降低植酸含量,其本质上是植酸酶在起作用[2-3]。但是糙米的植酸酶活性相对较低[2],如何充分激活糙米中的内源植酸酶削减植酸的含量成为亟需解决的问题。糙米发芽技术是目前主要的降低植酸含量的手段之一。研究发现,随着发芽温度的提高和发芽时间的持续,糙米在谷氨酸脱羧酶、α-淀粉酶和植酸酶等激活的内源酶作用下,不仅活性物质如γ-氨基丁酸的含量增加,而且糊化性能和适口性等发生了极大改善[4-6],同时糙米中植酸的含量逐步下降[3,7]。发芽条件,如浸泡液的种类、浸泡温度和时间、发芽温度和时间等对糙米植酸酶和植酸的影响的研究已有一些报告[7-10],如Ou等[8]研究指出,25℃是最适合的浸泡和发芽温度,浸泡糙米24h后,植酸酶活性明显降低,发芽5d植酸酶活性达到峰值;研究亦发现,0.5mmol/L CaCl2和0.1mol/L H2O2浸泡液提高了糙米的发芽率,但浸泡液的pH影响了细胞膜的通透性,pH过高或者过低均影响到糙米的风味改变,中性去离子水是最理想的浸泡液。作者的前期研究发现,发芽过程中糙米的带菌量增加,糙米的发芽率并不稳定(数据未显示),这与发芽介质关系密切。从上述研究中可以看到,浸泡时间对植酸酶的活性影响突出,浸泡过程中植酸酶是下降的,在发芽阶段先升高后下降,明显存在时间滞后现象,尽快激活糙米中内源酶体系,降低植酸含量,稳定控制浸泡和发芽条件,减少营养成分的消耗,从而有益于发芽糙米产品的开发。本实验利用高温短时热激糙米,与恒定的浸泡温度(25℃)形成短时的温度梯度,激活糙米的内源酶体系,研究植酸酶的变化规律,并用响应面法优化热激浸泡条件;同时,探讨了发芽过程中柠檬酸对植酸酶的活性影响,为充分利用发芽糙米中的植酸酶提供基础数据。
1 材料与方法
1.1 材料与仪器
籼稻谷 品种为野丝占,产地广东;硝酸、三水合乙酸、乙酸钠、氢氧化钠、柠檬酸等试剂 均为分析纯,购自广州市化学试剂厂;植酸钠、钼酸铵、磷酸二氢钾(KH2PO4)和钒酸盐 均为分析纯,购自Sigma公司。
SATAKE-THU35C检验砻谷机 日本佐竹机械(苏州)有限公司;梅特勒AB204-S型电子天平 上海梅特勒公司;LRH-250A生化培养箱 韶关市泰宏医疗器械有限公司;2-16kt台式高速冷冻离心机 德国Sigma公司;721分光光度计 上海分析仪器厂。
1.2 实验方法
1.2.1 单因素实验 分别称取50g糙米,选择40、45、50、55、60℃去离子水浸泡糙米35min进行热激温度对植酸酶影响的单因素实验;以55℃去离子水浸泡20、25、30、35、40min进行热激时间对植酸酶影响的单因素实验;选择未经激活处理的糙米进行6、12、18、24、30h浸泡,研究浸泡时间对植酸酶影响的单因素实验,根据预实验结果固定浸泡温度为25℃,米水比例为1∶5(w/v)。以上单因素实验每个实验组合均重复三次。
1.2.2 响应面设计 根据Box-Behnken中心组合设计原理,综合单因素实验结果,选择热激温度(A,℃)、热激时间(B,min)和浸泡时间(C,h)为自变量,以植酸酶为响应值,进行三因素三水平实验设计。利用Design Expert 7.1.3进行数据拟合,实验因素和水平见表1。

表1 实验因素水平表Table 1 Factors and levels of experiment
1.2.3 不同发芽介质实验 分别选取100粒糙米,用去离子水和2mmol/L柠檬酸缓冲液(pH5.2)作为糙米发芽介质,测定发芽势(3d)和发芽率(7d)以及隔天取样测定植酸酶活性,每天更换发芽介质。所有实验组合重复三次。
1.2.4 植酸酶测定 参照文献[8]的方法测定发芽糙米中植酸酶的活性。一个酶活单位(U)定义为在37℃,pH5.5条件下,每分钟从植酸中释放1μmol磷需要的酶量。以磷酸二氢钾(KH2PO4)溶液和钼酸铵显色混合液(含100g/L钼酸铵,2.35g/L钒酸盐,5mol/L硝酸,比例为1∶1∶2)反应制作标准曲线。称取约3g糙米样品于容量瓶中,加入40mL 0.22mol/L乙酸钠缓冲溶液(pH5.4),4℃浸提1h。混合液于4400×g转速下离心10min,取上清液待测。以1mL 10mmol/L植酸钠做底物,与3mL酶提取液37℃孵育1h,加入4mL钼酸铵混合显色液终止反应,取反应混合液于4400×g转速下离心10min,测定上清液在415nm处的吸光度。计算公式如下:

式中:Y为植酸酶活性,U/kg;C为根据吸光度和校准曲线计算的酶活性,U;m为样品质量,g;F为稀释倍数。
1.3 数据分析
数据采用SPSS 16.0统计,Design Expert 7.1.3软件进行响应面设计和结果处理。
2 结果与分析
2.1 单因素实验结果
根据预实验结果,糙米用70℃热水热激1h,发芽率不稳定,仅为10%~40%,因此,本研究的热激温度设计为40~60℃。用不同的热激温度处理糙米35min后测定糙米的植酸酶活性,结果表明,40、45、50、55、60℃热激处理糙米,植酸酶的活性均高于原料糙米(115.57U/kg),随着热激温度的升高,呈先升高后降低的趋势,50℃热激处理的植酸酶活性最高(图1)。该结果显示植酸酶对高温具有一定的耐受性,与温度对大麦中植酸酶的影响结果相似[9],说明短时的高温处理,激活了糙米的内源酶体系,增加了蛋白酶的合成,相应提高了植酸酶的活性,也有利于释放植酸中的磷,为调节糙米萌发提供代谢底物。由此可见,筛选适合的热激温度可调节糙米中植酸酶的活性。
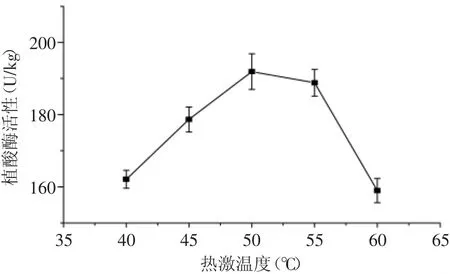
图1 热激温度对糙米植酸酶活性影响Fig.1 Effect of treatment temperature on phytase activity of brown rice
用55℃热激处理糙米,20~35min内随着热激时间的延长,糙米中植酸酶的活性逐渐升高,35min植酸酶活性最大;超过35min,植酸酶活性开始下降(图2)。这一结果表明,植酸酶的活性提高耗用了大量的蛋白酶源,若持续升高则不利于进一步萌发生理代谢,因此,出现先升后降的趋势。该结果也说明并不是热激时间越长植酸酶的活性就越高,而是存在一个最适热激时间范围。

图2 不同热激时间对糙米植酸酶的影响Fig.2 Effect of heat treatment duration on phytase activity of brown rice
测定不同的浸泡时间(25℃,去离子水浸泡)对糙米的植酸酶活性的影响,结果表明,随着浸泡时间的延长,糙米的植酸酶活性下降,浸泡24h植酸酶活性下降50%左右(原料糙米的植酸酶活性为115.57U/kg)(图3)。该结果与OU等的研究利用0.5mmol/L CaCl2和水浸泡糙米24h后的结果一致[8],研究同时认为浸泡导致了植酸含量的减少,这就说明浸泡过程中植酸的减少,可能是增加了细胞的通透性造成,而不是启动植酸酶降解植酸,仅利用浸泡处理并没有完全激活植酸酶活性。综合考虑,选择12h作为响应面实验的中心值。

图3 不同浸泡时间对糙米植酸酶的影响Fig.3 Effect of steeping duration on phytase activity of brown rice
2.2 响应面法实验设计
利用Design Expert 7.1.3软件进行数据拟合,响应面实验以及响应值见表2,回归方程为Y=169.38+ 0.28A+3.76B-1.51C+10.40AB-2.95AC+0.23BC-30.03A2-7.20B2-21.40C2。
方差分析和显著性检验结果表明(表3),对响应面值所建立的回归方程模型极其显著(p<0.0001),失拟误差不显著(p=0.7436),模型的R2=0.9913,R2adj=0.9802,说明该模型的拟合程度较好,因此可用该模型预测和分析热激浸泡糙米中植酸酶活性。热激温度、浸泡时间对植酸酶的影响不显著,热激时间则影响显著,热激温度和时间存在显著交互作用。随着热激温度的升高和时间的延长,糙米中植酸酶活性均呈现先升高后下降的趋势(图4)。
利用软件优化程序,优化的热激和浸泡条件为:热激温度50℃,热激时间30min,浸泡时间6h,糙米中植酸酶活性的预测值为169.38U/kg。经五次实验验证,实际的植酸酶活性平均值为167.71U/kg,预测值的相对误差为1%。

表2 响应面实验以及响应值Table 2 Experiment design and result of response surface method analysis

图4 热激温度和时间对糙米中植酸酶活性的响应曲面Fig.4 Response surfaces on phytase activities of brown rice treated by combination of temperature and time
2.3 不同发芽介质对糙米植酸酶的影响
去离子水和2mmol/L柠檬酸缓冲液(pH5.2)分别作为糙米发芽的介质,测定发芽势和发芽率,结果显示(表4),当糙米在2mmol/L柠檬酸缓冲液(pH5.2)中发芽时,发芽势比去离子水介质发芽势高,无显著差异(p=0.078);而发芽率则明显高于去离子水介质的发芽率(p=0.002),且糙米的风味未发生改变。这可能是酸性介质抑制了一些危害糙米发芽的微生物,从而对糙米起到保护作用。

表3 方差分析与显著性检验Fig.3 Analysis of variance and significance test

表4 不同发芽介质对糙米发芽的影响Table 4 Effect of germination mediums on germination of brown rice
研究糙米发芽过程中植酸酶的活性变化发现,在去离子水介质和柠檬酸介质中,植酸酶活性随着发芽时间的延长,先升高后下降,酸性的柠檬酸介质中糙米的植酸酶活性在发芽2d超过未发芽糙米(115.57U/kg),3d达到最高值(241.27U/kg),而去离子水介质中糙米的植酸酶出现峰值时间滞后,3d超过未发芽糙米,4d到达最高值(图5)。这一结果与稻谷、玉米、大豆等谷物发芽实验结果相似[10],在发芽前期植酸酶达到峰值,而发芽后期养分消耗等因素影响了植酸酶的进一步合成,酶活性下降。酸性柠檬酸介质促进发芽糙米更快达到峰值减少养分的进一步消耗,同时有研究认为柠檬酸可以有效改善大米中内源酶的作用方式,提高大米的糊化效果,改善米饭品质[11],本研究则表明酸性的柠檬酸介质还能提高植酸酶活性,从而降低抗营养因子植酸的含量,有利于开发发芽糙米产品。因此,低浓度的酸性柠檬酸介质是一种可利用的糙米发芽介质。

图5 不同发芽介质中糙米植酸酶的活性变化Fig.5 Changes of pytase activities of brown rice germinated in different mediums
3 结论
3.1 短时的高温处理,激活了糙米的内源酶体系,从而提高了植酸酶的活性,随着热激时间的延长,糙米中植酸酶的活性逐渐升高,达到峰值后下降。糙米经去离子水浸泡后,增加了细胞的通透性但并没有完全激活植酸酶活性,数值低于未浸泡的糙米原料。3.2 利用中心组合响应面设计实验,经Design Expert 7.1.3软件数据拟合得到二次回归方程如下:Y=169.38+ 0.28A+3.76B-1.51C+10.40AB-2.95AC+0.23BC-30.03A2-7.20B2-21.40C2;预测并验证的优化的热激和浸泡条件为:热激温度50℃,热激时间30min,浸泡时间6h。
3.3 低浓度的柠檬酸缓冲液是一种可利用的糙米发芽介质。2mmol/L柠檬酸缓冲液(pH5.2)可提高糙米的发芽率;随着发芽时间的延长,植酸酶的活性先升高后下降,发芽2d后超过原料糙米(115.57U/kg),3d达到最高值(241.27U/kg)。
[1]Moongngarm A,SaetungN.Comparison ofchemical compositions and biological compounds of germinated rough rice and brown rice[J].Food Chemistry,2010,122:782-788.
[2]Kumar V,Sinaha A K,Makkar H P S,et al.Dietaty roles of phytate and phytase in human nutrtion:A Review[J].FoodChemistry,2010,120:945-959.
[3]郑艺梅,何瑞国,郑琳,等.糙米发芽过程中营养成分及植酸含量变化的研究[J].中国粮油学报,2006,21(5):1-4.
[4]刘明,杜传林,刘艳香,等.内源酶萌发预处理时间对全谷物糙米提取物品质的影响[J].食品工业科技,2012,34(6):118-122.
[5]李思,方坚,梁建芬.浸泡液对糙米发芽的影响研究[J].食品科学,2007,28(7):138-141.
[6]李欣,陈威,陈嘉东,等.发芽糙米游离氨基酸和蒸煮特性的品种差异分析[J].广东农业科学,2013(5):84-87.
[7]王维坚,马中苏.工艺参数对发芽糙米中植酸含量的影响[J].中国粮油学报,2009,24(4):156-158.
[8]Ou Keqin,Cheng Yongqiang,Xing Ying,et al.Phytase activity in brown rice during steeping and sprouting[J].Journal of Food Science Technology,2011,48(5):598-603.
[9]Sung H,Shin H,Ha J,et al.Effect of germination temperature on characteristics of phytase production from barley[J].Bioresource Technology,2005,96:1297-1303.
[10]Marshall AA,Samuel JE,Mary UE,et al.Effect of germination on the phytase activity,phytate and total phosphorus contents of rice,maize,millet,sorghum and wheat[J].Journal of Food Science Technology,2011,48:724-729.
[11]Mabashi Yuka,Ookura Tetsuya,Tominaga Noriko,et al. Characterization of endogenous enzymes of milled rice and its application to rice cooking[J].Food Research International,2009,42:157-164.
Increase of phytase activity in brown rice treated by heat shock and germinated in citric acid medium
LI Xin1,CHEN Wei2,HE Min1
(1.Guangdong Vocational College of Science and Trade,Guangzhou 510430,China;2.Guangdong Institute of Cereal Science,Guangzhou 510050,China)
Brown rice were treated by short-time heat-shock and germinated in acidic medium to investigate changes of endogenous phytase activities,and the experiments were performed to optimize conditions of heat shock by using response surface design.The results showed that activity of phytase increased with increasing heat-shock duration,then declined after reaching peak value.The conditions of heat shock treatment and soaking time,which were optimized and validated by using central composite response surface design,were heat-shock temperature of 50℃,heat shock time of 30min,and soaking time of 6h.As the germination time extension,phytase activities of brown rice germinated in citrate buffer(2mmol/L,pH5.2)increased,and reached maximum value after 3 days(241.27U/kg),which were higher than of raw brown rice(115.57U/kg).In summary,this study achieved a novel technology to activate endogenous phytase activity of germinated brown rice to reduce phytic acid,which provided basic technical data for maintaining their nutritional value.
phytase;germinated brown rice;heat shock treatment;citric acid;response surface analysis
TS201.1
A
1002-0306(2014)08-0202-05
10.13386/j.issn1002-0306.2014.08.037
2013-11-04
李欣(1980-),女,博士,讲师,研究方向:功能食品生物技术。
广东省科技攻关计划项目(2009B020312004)。

