非小细胞肺癌吉西他滨化疗敏感性预测
吴 鹏 徐佳佳 王国庆 冯俊志 施 风
1.江苏建康职业学院医学护理系,江苏南京211800;2.东南大学附属中大医院病理科,江苏南京210009
非小细胞肺癌吉西他滨化疗敏感性预测
吴 鹏1徐佳佳2王国庆2冯俊志1施 风1
1.江苏建康职业学院医学护理系,江苏南京211800;2.东南大学附属中大医院病理科,江苏南京210009
目的探讨非小细胞肺癌(NSCLC)吉西他滨(GEM)化疗敏感性预测靶标。方法30例NSCLC组织,体外药敏试验明确GEM IC50值;Realtime-PCR检测GEM代谢酶hENT1、dCK、RRM1和RRM2mRNA表达水平。结果hENT1、dCK、RRM1和RRM2单个基因表达量与GEM IC50值无关(P>0.05);(hENT1×dCK)/(RRM1×RRM2)值与GEM IC50值呈负相关(P<0.001)。结论(hENT1×dCK)/(RRM1×RRM2)值可作为GEM化疗敏感性预测的潜在标志物。
非小细胞肺癌;吉西他滨;化疗敏感性;原代细胞
非小细胞肺癌(non small cell lung cancer,NSCLC)占肺癌80%以上,大多数患者在初诊时即有局部或远处转移,手术的机会受到限制,因此化疗仍是NSCLC临床治疗的重要手段。吉西他滨(Gemcitabine,GEM)是新一代阿糖胞苷类似物,属抗代谢类抗肿瘤药[1],临床上一线应用于NSCLC、胰腺癌、进展期膀胱癌和蒽环类失败的转移性乳腺癌的治疗[2],但GEM的原发性与继发性耐药使其临床应用受到限制,目前尚缺乏较为有效指标来预测肿瘤细胞对此药物的敏感性。多个关键酶参与GEM在体内的代谢调节,这些关键酶的表达水平可能直接影响到机体对GEM的药物敏感性[3]。本实验拟在NSCLC标本中检测GEM代谢酶hENT1、dCK、RRM1和RRM2mRNA表达水平,通过体外药敏试验分析其与GEM化疗敏感性的关系,明确其指导NSCLC个体化治疗的价值。
1 资料与方法
1.1 一般资料
30例初治NSCLC患者的术后组织标本源自2012年1月~2012年6月于江苏省肿瘤医院和东南大学附属中大医院胸外科住院患者,标本离体30 min内无菌收集,每份标本一分为二,一份用于体外药敏试验,一份用于基因表达检测。所有患者均经病理检查确诊。标本采集经患者知情同意并得到医院伦理委员会批准。
1.2 体外药敏试验
取新鲜癌组织约1 g(1 cm3),用Hank's液反复冲洗,洗去血细胞并尽量剔除其中的黑色颗粒物及非癌组织,机械法制成单细胞悬液[4]。台盼蓝染色计数活细胞数,调整细胞浓度为(2~5)×105/m L。取GEM浓度序列为0、1.0、5、10、20、40、80、160、320、640μmol/L。将上述单细胞悬液接种于96孔板(4000个/孔),每个浓度设3个平行实验孔。待细胞贴壁后分别加入含GEM相应浓度的培养液培养48 h。空白孔和对照孔为减除背景用。采用MTT法测定细胞生存率,检测波长492 nm。细胞生存率=光密度(实验孔-空白对照)/光密度(正常对照-空白对照)。实验重复3次。用Graphpad Prism 5.0软件绘制各组细胞对GEM的量效曲线并计算IC50。
1.3 Realtime-PCR
采用Trizol(美国Invitrogen公司)一步法提取癌组织总RNA,紫外分光光度计定量,取2μg RNA进行逆转录反应(1st Strand cDNA Synthesis Kit,Takara公司,大连)。Rrealtime PCR反应体系依照Takara公司SYBR premix ExTaqTM试剂盒说明配置。利用ABI7300仪器对hENT1、dCK、RRM1和RRM2 mRNA表达进行检测,β-actin作为内参。引物序列和退火温度见表1。上机反应条件为:变性95℃,15 s;退火56~60℃,30 s;延伸72℃,30 s,45个循环。每个实验组行两次以上有效重复,平行做目的基因和内参基因,每个反应做3个完全一致的PCR仪器孔重复。目的基因的mRNA相对表达量用2-ΔΔCt法分析。

表1 引物序列及产物长度
1.4 统计学方法
采用SPSS 13.0统计学软件进行数据分析,基因表达与GEM化疗敏感性的关系采用Spearman相关分析,以P<0.05为差异有统计学意义。
2 结果
2.1 原代肿瘤细胞生长状况及形态学表现
NSCLC原代细胞培养30例均成功,传3~5代后仍保持稳定。细胞呈贴壁生长,形态各异,呈梭形、三角形、多角形等,细胞轮廓清楚,胞浆均质透明,核圆形,单核或多核。见图1。
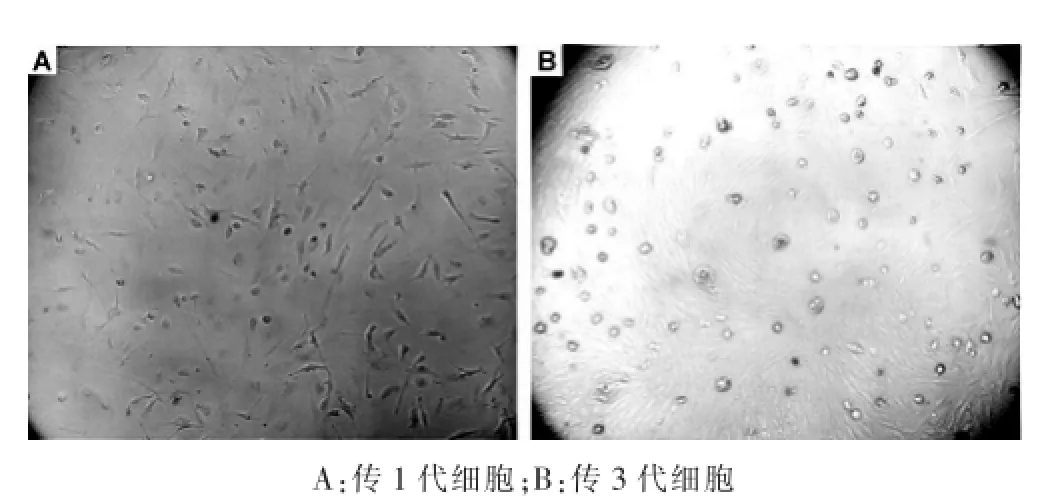
图1 非小细胞肺癌原代细胞培养
2.2 代谢酶表达与GEM化疗敏感性
NSCLC原代细胞对GEM的IC50值为10~400μmol/L。计算每例标本的hENT1、dCK、RRM1和RRM2相对表达量,与该例标本的IC50值进行相关性分析,可见hENT1和dCK表达量与IC50值有负相关的趋势,RRM1和RRM2表达量与IC50值有正相关的趋势,但差异均无统计学意义(P>0.05)。然而,(hENT1×dCK)/(RRM1×RRM2)与吉西他滨的IC50值呈负相关(r= -0.851,P<0.001)。见图2。
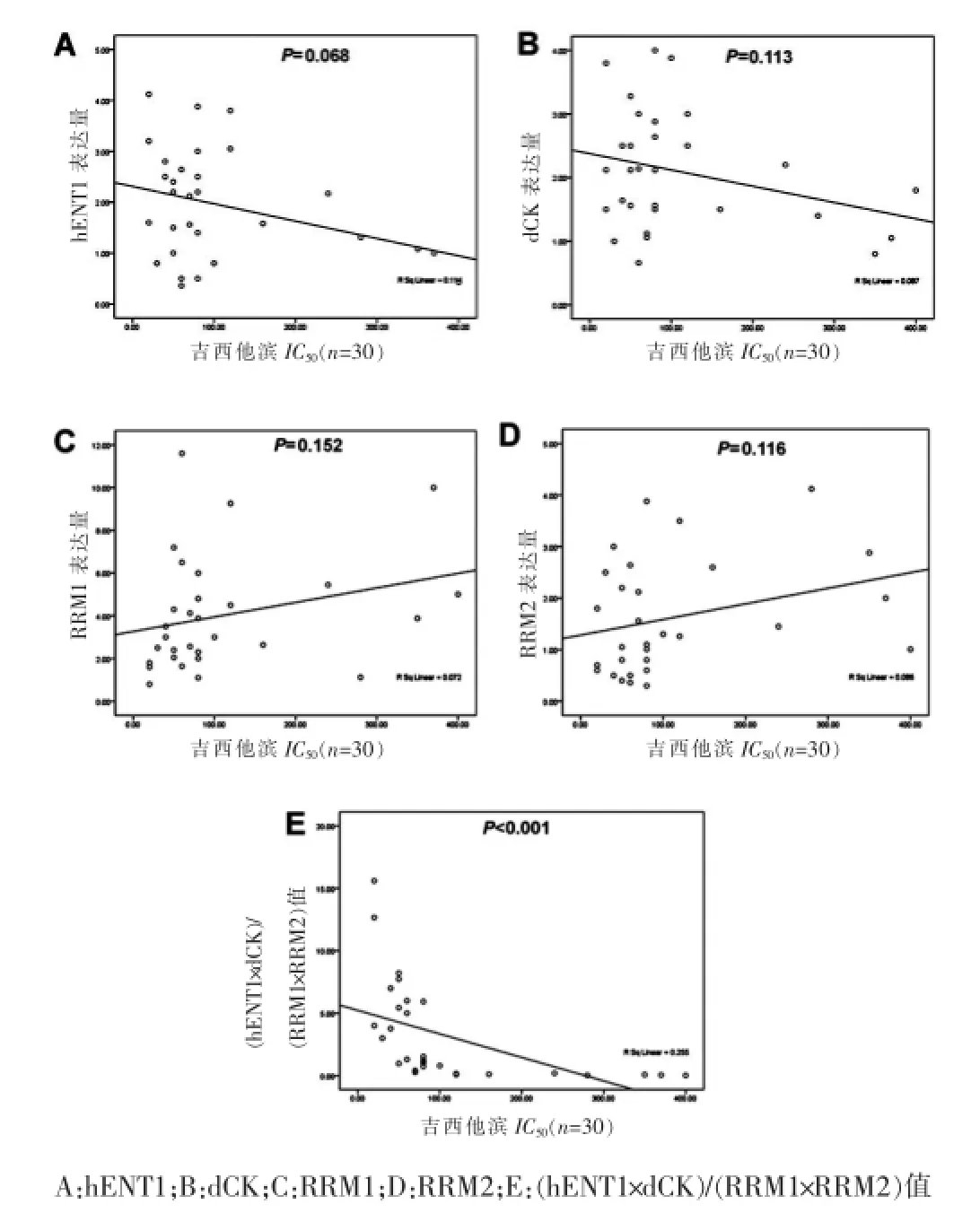
图2 代谢酶表达与GEM IC50的关系
3 讨论
原代肿瘤细胞因刚从组织中分离,生物学特性未发生很大变化,仍保留原来的遗传学特性,也最接近体内细胞生长特性,是理想的基因表达和药物毒性实验对象。本实验培养的原代NSCLC细胞不排除混杂有部分成纤维细胞等肿瘤间质细胞,考虑到肿瘤间质成分对化疗耐药也具有重要意义,尚有部分体外药敏试验采用肿瘤组织块培养法进行[5],因此未作进一步分离、鉴定。
GEM系胞嘧啶核苷衍生物,主要通过人平衡型核苷载体1(human equilibrative nucleoside transporters 1,hENT1)和浓度型核苷载体(human concentrative nucleoside transporters 1,hCNT1)进入细胞,在胞浆内,GEM被脱氧胞苷激酶(deoxycytidine kinase,dCK)磷酸化为双氟脱氧胞苷一磷酸(difluorodeoxycytidine monophosphate,dFdCMP),后者继续活化为双氟脱氧胞苷二磷酸(dFdCDP)及双氟脱氧胞苷三磷酸(dFdCTP)活性产物。dFdCDP抑制核苷酸还原酶(ribonucleotide reductase,RR)的活性,使细胞内DNA合成与修复所必需的原料脱氧二磷酸核苷减少,从而进一步抑制DNA的合成;dFdCTP是一种DNA多聚酶抑制剂,抑制DNA链延长,使DNA复制提前终止,它的浓度增加还将抑制dCMP脱氨酶,减少dFdCMP代谢,使药物活化增加,自我强化其细胞毒的作用[6]。
hENT1是GEM在细胞膜上的主要载体。体外研究表明,22株NSCLC细胞株中hENT1的表达水平与GEM的IC50值明显相关,以腺苷转运抑制剂处理细胞可降低其对GEM的敏感性[7],说明hENT1对NSCLC细胞系的药物敏感性具有重要作用。Oguri等[8]对24例NSCLC患者研究表明,hENT1表达与含有GEM化疗的客观缓解有关,7例hENT1不表达的患者对GEM化疗无效。也有研究发现,hENT1mRNA高表达的NSCLC患者并不能从吉西他滨治疗中获益[9]。
dCK可催化多种特异性底物的磷酸化反应,是重要的代谢调节酶,dCK活性降低或表达量减少可使细胞内核苷酸库平衡失调,导致肿瘤细胞对吉西他滨的耐药。研究表明,以dCK的自然底物2'-脱氧胞苷酸处理胰腺癌和NSCLC细胞株,可降低GEM的细胞毒性[10];通过RNAi下调dCK的表达导致胰腺癌对吉西他滨发生继发耐药现象[11]。Kroep等[12]对包括NSCLC在内的7种不同肿瘤模型的研究发现,dCK蛋白表达和dCK酶的活性与吉西他滨的敏感性呈正相关。通过免疫组化分析44例胰腺癌组织中的dCK表达强度,发现dCK高水平组的总生存期明显优于dCK低水平组[13]。
RR是细胞内唯一具有催化核糖核酸还原为脱氧核糖核酸功能的酶,在DNA合成与修复过程中发挥关键作用。RR基因包含2个亚单位M1与M2,其中,RRM1亚基是吉西他滨作用的主要靶点。体外实验显示,RRM1的表达上调3倍,吉西他滨的IC50值上升8倍,RRM1的表达下调则出现相反的趋势[14]。在GEM高度耐药的胰腺癌细胞系MiaPaCa2-RG中通过RNAi下调RRM1的表达可提高其对GEM的敏感性;在18例GEM术后辅助治疗的胰腺癌患者中,RRM1高表达者较低表达者预后更差(P=0.016)[15]。Rosell等[16]发现,100例以吉西他滨/顺铂方案进行化疗的NSCLC患者,RRM1低表达的总生存期明显高于高表达者,分别为13.7个月和3.6个月(P=0.009)。胆管癌细胞中,RRM1、RRM2表达与GEM的IC50值呈负相关,并且,RRM1低表达的胆管癌患者对GEM的治疗有效性与总生存均优于高表达者[17]。
由于GEM代谢过程中涉及多个关键代谢酶,所以,其药理作用也必然同时受多因素的影响。在GEM的代谢路径上,单一某个因素的升高或降低可能仅是其他因素障碍导致的代偿结果。如Nakano等[18]报道,胰腺癌细胞系的获得性耐药与单一的GEM代谢酶hENT1、dCK、RRM1和RRM2 mRNA表达水平无关,而是取决于四个因子间的平衡,(hENT1×dCK)/(RRM1×RRM2)值与吉西他滨的IC50值呈反比。另一项研究在70例以吉西他滨为主化疗的胰腺癌患者中检测hENT1、dCK、CDA、RRM1和RRM2 mRNA的表达,发现高dCK表达,低RRM2表达以及5个基因的综合评分与患者无进展生存相关[19]。
本实验发现,单个代谢酶基因表达量与原代NSCLC细胞GEM IC50值无关,但(hENT1×dCK)/(RRM1×RRM2)值与GEM IC50值呈负相关,可能作为GEM化疗敏感性预测的潜在标志物,值得临床进一步关注。鉴于既往研究的NSCLC化疗敏感性的靶标仍未得到广泛认可[20],本实验结果可望为临床指导NSCLC个体化化疗提供新的思路。
[1]DanesiR,AltavillaG,GiovannettiE,etal.Pharmacogenomics of gemcitabine in non-small-cell lung cancer and other solid tumors[J].Pharmacogenomics,2009,10(1):69-80.
[2]黄双,孙圣坤,徐阿祥,等.吉西他滨联合卡铂治疗局部浸润性膀胱癌的疗效分析[J].现代生物医学进展,2012,16(9):89-90.
[3]陈莹,钱晓萍,刘宝瑞.非小细胞肺癌吉西他滨药物耐药相关基因研究进展[J].中国肺癌杂志,2011,14(5):421-428.
[4]刘敏,王朝晖,周桂兰,等.体外肿瘤细胞培养法对非小细胞肺癌化疗药物敏感性的研究[J].大连医科大学学报,2009,31(1):64–66.
[5]毛德强,潘玲,戴勤弼,等.体外组织块培养药敏试验指导下脑胶质瘤化疗的临床疗效分析[J].中国全科医学,2011,14(10):3390-3392.
[6]DanesiR,AltavillaG,GiovannettiE,etal.Pharmacogenomics of gemcitabine in non-small-cell lung cancer and other solid tumors[J].Pharmacogenomics,2009,10(1):69-80.
[7]Achiwa H,Oguri T,Sato S,etal.Determinants of sensitivity and resistance to gemcitabine:the roles of human equilibrative nucleoside transporter 1 and deoxycytidine kinase in non-small cell lung cancer[J].Cancer Sci,2004,95(9):753-757.
[8]Oguri T,Achiwa H,Muramatsu H,et al.The absence of human equilibrative nucleoside transporter 1 expression predictsnonresponse to gemcitabine-containing chemotherapy in non-smallcell lung cancer[J].Cancer Lett,2007,256(1):112-119.
[9]卞荣荣,钱晓萍,刘宝瑞,等.hENT1 mRNA表达与非小细胞肺癌吉西他滨化疗临床预后的相关性[J].现代肿瘤医学,2012,20(4):718-721.
[10]Giovannetti E,Mey V,Danesi R,etal.Interaction between gemcitabine and topotecan in human non-small-cell lung cancer cells:effectson cell survival,cell cycle and pharmacogenetic profile[J].Br JCancer,2005,92(4):681-689.
[11]Ohhashi S,Ohuchida K,Mizumoto K,et al.Downregulation of deoxycytidine kinase enhances acquired resistance to gemcitabine in pancreatic cancer[J].Anticancer Res,2008,28(4):2205-2212.
[12]Kroep JR,LovesWJ,van der Wilt CL,et al.Pretreatment deoxycytidine kinase levels predict in vivo gemcitabine sensitivity[J].Mol Cancer Ther,2002,1(6):371-376.
[13]Sebastiani V,Ricci F,Rubio-Viqueira B,et al.Immunohistochemical and genetic evaluation of deoxycytidine kinase in pancreatic cancer:relationship to molecular mechanisms of gemcitabine resistance and survival[J]. Clin Cancer Res,2006,12(8):2492-2497.
[14]Bepler G,Kusmartseva I,Sharma S,et al.RRM1 modulated in vitro and in vivo efficacy of gemcitabine and platinum in non-small-cell lung cancer[J].JClin Oncol, 2006,24(29):4731-4737.
[15]Nakahira S,Nakamori S,Tsujie M,et al.Involvement of ribonucleotide reductase M1 subunit overexpression in gemcitabine resistance of human pancreatic cancer[J]. Int JCancer,2007,120(6):1355-1363.
[16]Rosell R,Danenberg KD,Alberola V,etal.Ribonucleotide reductase messenger RNA expression and survival in gemcitabine/cisplatin-treated advanced non-small cell lungcancerpatients[J].Clin CancerRes,2004,10(4):1318-1325.
[17]Nakamura J,Kohya N,Kai K,etal.Ribonucleotide reductase subunit M1 assessed by quantitative double-fluorescence immunohistochemistry predicts the efficacy of gemcitabine in biliary tract carcinoma[J].Int JOncol,2010,37(4):845-852.
[18]NakanoY,Tanno S,KoizumiK,etal.Gemcitabinechemoresistance and molecular markers associated with gemcitabine transport and metabolism in human pancreatic cancer cells[J].Br JCancer,2007,96(3):457-463.
[19]Fujita H,Ohuchida K,Mizumoto K,et al.Gene expression levels as predictivemarkers of outcome in pancreatic cancer after gemcitabine-based adjuvant chemotherapy[J]. Neoplasia,2010,12(10):807-817.
[20]杨惠夷,刘文超.基于基因检测的非小细胞肺癌个体化治疗的研究进展[J].中国肿瘤生物治疗杂志,2013,20(4):478-484.
Study of Gem citabine chemosensitivity prediction in non-small cell lung cancer
WU Peng1XU Jiajia2WANG Guoqing2FENG Junzhi1SHIFeng1
1.Department of Nursing,Jiangsu Jiankang Vocational College,Jiangsu Province,Nanjing 211800,China;2.Department of Pathology,Zhongda Hospital Affiliated to Southeast University,Jiangsu Province,Nanjing 210009,China
Objective To explore biomarker of Gemcitabine(GEM)chemosensitivity in non-small cell lung cancer (NSCLC).M ethods GEM IC50of 30 NSCLC tissueswere detected by susceptibility testing in vitro,mRNA expression of hENT1,dCK,RRM1 and RRM2 were determined by Realtime-PCR.Results hENT1,dCK,RRM1 or RRM2 expression levels in individual gene had no relationship with the GEM IC50value(P>0.05),however,ratio of(hENT1×dCK)/ (RRM1×RRM2)was negatively correlated with GEM IC50value(P<0.001).Conclusion Ratio of(hENT1×dCK)/ (RRM1×RRM2)may predict GEM chemosensitivity in NSCLC.
Non-small cell lung cancer;Gemcitabine;Chemosensitivity;Primary culture cell
R734.2;R730.54
A
1673-7210(2014)08(b)-0043-04
2014-05-06本文编辑:程铭)
江苏建康职业学院院级教科研项目(编号JK20 1104)。
吴鹏(1978-),男,医学硕士;研究方向:肿瘤学。

